Диабетическая полинейропатия (ДПН) – одно из самых частых осложнений сахарного диабета (СД) [2, 6, 12, 22]. По мнению зарубежных исследователей, частота болевой нейропатии варьируется от 3 [20] до 32 % [23]. Нейропатическая боль (НБ) – основной повод для обращения за медицинской помощью пациентов с СД. Наличие болевой ДПН в свою очередь четко коррелирует со снижением качества жизни больных [4].
Pfeiffer и Schumer [17] предположили, что патогенез ДПН должен быть условно разделен по времени развития на функциональные и анатомические нарушения. Функциональные изменения развиваются на ранних стадиях нейропатии и полностью или частично обратимы на фоне стабильного гликемического контроля и/или воздействия средств патогенетической терапии. Так, в исследовании DCCT (Diabetes Control and Complications Trial) было отмечено, что на фоне стабильного гликемического контроля именно у пациентов с недавно выявленной ДПН отмечен регресс клинических проявлений этого осложнения [5]. Анатомические или структурные изменения развиваются позже, и их регресс практически невозможен. Таким образом, перейдя точку необратимости, теряется возможность получения адекватного терапевтического ответа на средства патогенетической терапии. Можно предположить, что патогенетическая терапия более эффективна для пациентов с легкой и умеренной ДПН в условиях отсутствия или не ярко выраженного анатомического дефекта периферической нервной системы. Более того, из исследования C.A. Abbott, R.A. Malik и соавт. [1] известно, что доля пациентов с выраженной НБ значительно больше среди пациентов, имеющих выраженный сенсорный дефицит. Кроме того, в последние годы опубликован ряд работ, подтвердивших вовлечение центральных структур в формирование НБ при ДПН [7]. Таким образом, вероятно, речь может идти об изменениях механизмов формирования НБ, а именно о ее централизации при тяжелой ДПН с выраженным сенсорным дефицитом. Последнее определяет возрастающий интерес к приоритетному использованию симптоматических препаратов в данной подгруппе пациентов и, вероятно, ограниченной эффективности средств патогенетической терапии.
Так, эффективность терапии α-липоевой кислотой (АЛК), по разным источникам, составляет 52–76 % и, вероятно, зависит от ряда факторов: степени сенсорного дефицита, выраженности болевой симптоматики, гликемии, схемы применения, типа СД.
В большинстве случаев результативность лечения НБ оставляет желать лучшего – только порядка 50 % пациентов достигают облегчения боли на 50 %. Сравнительных исследований, определяющих вопросы выбора и тактики лечения, мало. Более того, в реальной клинической практике основные симптоматические препараты имеют сходную эффективность и выбор основывается на безопасности, индивидуальных особенностях пациента, стоимости лечения и доступности препаратов [13, 24].
В настоящее время целью лечения НБ служит снижение выраженности боли по Визуальной аналоговой шкале боли (ВАШ) по сравнению с исходными значениями на 50 % и более. Снижение выраженности НБ по ВАШ менее 30 % требует пересмотра терапии и замены препарата. Самый спорный момент – снижение выраженности НБ более 30 %, но менее 50 %.
В данном случае возможна как замена препарата, так и продолжение приема или же назначение комбинированной терапии [9]. Последняя представляет наибольший интерес, однако по данной теме опубликованы единичные работы, в основном по комбинации нескольких симптоматических препаратов [3]. Данных по комбинированной терапии симптоматических и патогенетических препаратов практически нет.
Помимо этого возникает закономерный вопрос: что считать эффектом патогенетической терапии? Объективное улучшение электрофизиологических показателей на фоне терапии АЛК хорошо известно, это определяется ее антиоксидантным и метаболическим действиями, но носит отсроченный характер. Однако на фоне внутривенной терапии АЛК или пероральной терапии с применением больших доз препаратов отмечается достаточно быстрое воздействие на нейропатическую симптоматику, что никак не может быть объяснено метаболическими эффектами. В последнее время появились данные о воздействии АЛК на активность Na-каналов, что, вероятно, определяет ее быструю антиноцицептивную активность. В данном случае очевидно смешение симптоматического и патогенетического воздействий. Возникает вопрос: можно ли рассматривать отсутствие ответа на краткосрочный курс терапии АЛК как предиктор ее дальнейшей неэффективности?
Еще один насущный и во многом спорный вопрос – это применение витаминов группы В при ДПН. Роль витаминных комплексных препаратов в лечении больных ДПН в настоящее время окончательно не определена. Из проведенных исследований можно сделать вывод о потенциальной антиноцицептивной и нейротропной активности комплекса витаминов группы В, содержащих бенфотиамин [10, 21], в отсутствие какого-либо патогенетического влияния, в частности, на нервную проводимость даже при длительном приеме [8]. Ряд авторов высказывают предположение о возможности комбинации витаминов группы В с симптоматическими препаратами, особенно в группах нонреспондеров, на монотерапию последними. В настоящее время опубликовано несколько работ, подтверждающих потенциальную эффективность комбинации витаминов группы В с габапентином и прегабалином [11, 14]. Однако данные работы в основном носили экспериментальный характер, а клинические работы включали единичных пациентов [14, 15, 18].
Основной целью нашего исследования стала оценка эффективности и безопасности симптоматической, патогенетической и комбинированной терапии больных хронической болевой ДПН с умеренным и выраженным сенсорным дефицитом, являющихся нонреспондерами на внутривенную терапию α-липоевой кислотой. Дополнительной целью была оценка эффективности и безопасности терапии габапентином и комбинацией габапентина с комплексом витаминов группы В (бенфотиамин, пиридоксин, цианокобаламин) для больных, резистентных к монотерапии габапентином.
Материал и методы
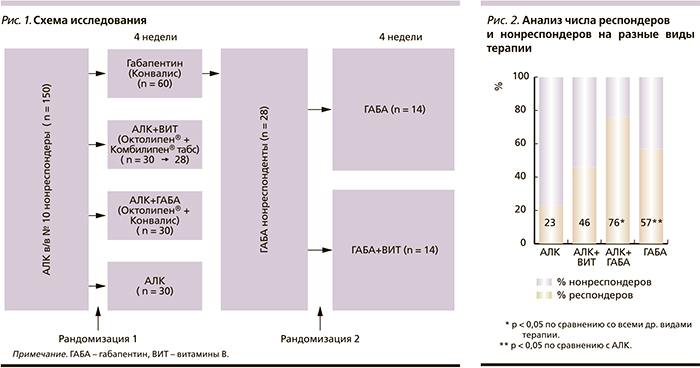
Работа представляла собой рандомизированное исследование в параллельных группах длительностью 8 недель, состоящее из двух этапов. Пациенты, прошедшие скрининг и соответствующие критериям включения, были рандомизированы в 4 группы:
- Группа 1 – прием габапентина (Конвалис, капсулы 300 мг) с постепенной титрацией дозы до 1800 мг/сут.
- Группа 2 – АЛК (Октолипен®, таблетки 600 мг) в сочетании с комплексом витаминов группы В (Комбилипен® табс, таблетки п/о).
- Группа 3 – АЛК (Октолипен®, таблетки 600 мг) и габапентин (Конвалис).
- Группа 4 – АЛК (Октолипен®, таблетки 600 мг).
Через 4 недели терапии нейропатии была проведена оценка первичной эффективности терапии болевой ДПН. Нонреспондерами считались пациенты, не достигшие снижения интенсивности боли по шкале ВАШ более чем на 50 %. Пациенты – нонреспондеры группы 1, получавшие габапентин без эффекта, были рандомизированы в 2 подгруппы:
- подгруппа 1А – продолжили терапию габапентином (Конвалис);
- подгруппа 1В – продолжили терапию габапентином (Конвалис) в комбинации с комплексом витаминов группы В (Комбилипен® табс) с последующей оценкой эффективности через 4 недели (рис. 1).
В исследование были включены пациенты с СД2 длительностью более года и СД1 длительностью более 5 лет в возрасте 18–80 лет с диагнозом ДПН, показателем MNSI (Michigan Neuropathy Screening Instrument) > 2,5 и НДСм (шкалы модифицированного нейропатического дисфункционального счета) > 6, с длительностью болевой симптоматики более 3 месяцев и силой боли по ВАШ > 40 мм (за последние 7 дней), с уровнем гликозилированного гемоглобина (HbA1c) на скрининге менее 10 %. В исследование вошли пациенты с отсутствием эффекта от внутривенной терапии α-липоевой кислотой, а именно снижения выраженности НБ по ВАШ после 10 внутривенных введений АЛК менее чем на 50 % от исходного показателя.
В исследование не включали пациентов с острой болевой ДПН, острыми макрососудистыми осложнениями в течение последних 3 месяцев, тяжелыми сопутствующими соматическими заболеваниями, синдромом диабетической стопы, скоростью клубочковой фильтрации < 30 мл/мин/1,73 м2, злоупотребляющие алкоголем, беременные и лактирующие женщины. Также был запрещен прием ряда препаратов в течение месяца до скрининга (ангиопротекторы, антиоксиданты, антидепрессанты, антиконвульсанты, трамадол, топические средства для лечения НБ).
На скрининге были использованы следующие шкалы и опросники: ВАШ, НДСм, NTSS9 (шкала общей оценки симптомов нейропатии), опросник невропатической боли DN4. Для оценки эффективности проводимой терапии использованы следующие шкалы и опросники: ВАШ, NTSS9 и процент респондеров на различные виды терапии.
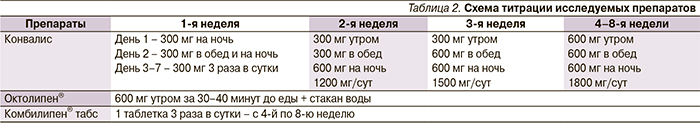
Общая характеристика пациентов представлена в табл. 1.
Обращают на себя внимание большой стаж СД, длительный и достаточно выраженный характер боли, а также выраженная степень сенсорного дефицита по НДСм.
Схема титрации исследуемых препаратов представлена в табл. 2.
Результаты и обсуждение
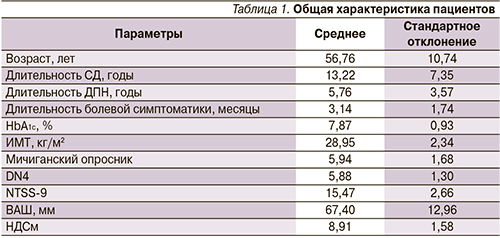
Комбинированная терапия АЛК и габапентином, а также монотерапия габапентином оказались максимально эффективными методами лечения НБ у пациентов с умеренным и выраженным сенсорным дефицитом, резистентным к внутривенной терапии АЛК (рис. 2). Пролонгация терапии АЛК перорально или добавление к АЛК витаминов группы В для пациентов с тяжелым сенсорным дефицитом не сопровождались достоверным увеличением числа респондеров, что подтверждает нецелесообразность подобного подхода к терапии НБ у данных пациентов. Вероятно, у пациентов с выраженным сенсорным дефицитом и большим стажем СД и ДПН развиваются необратимые изменения периферической нервной системы и в процесс вовлекаются центральные структуры, что определяет приоритет использования ими средств центрального действия – симптоматических препаратов.
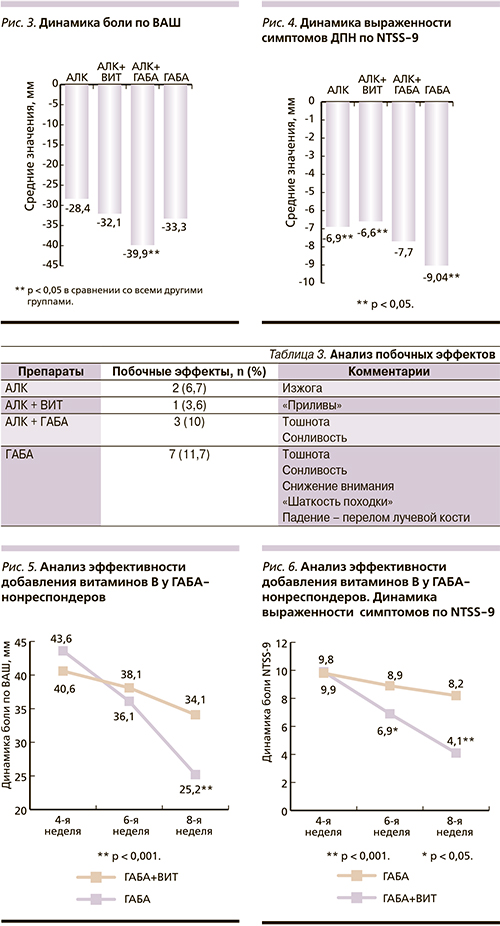
Максимальное снижение интенсивности выраженности нейропатической симптоматики по ВАШ и NTSS-9 также было отмечено в группах АЛК + габапентин и группе, получавшей монотерапию габапентином (рис. 3 и 4).
Шкала NTSS-9 учитывает не только выраженность, но и частоту симптоматики, что объясняет некоторые различия с ВАШ, полученные в нашем исследовании. Известно, что патогенетическая терапия с применением АЛК высокоэффективна при болевой ДПН как при внутривенном введении, так и при пероральном приеме. Однако следует учитывать клинические особенности пациента при выборе терапии. При легком и умеренном сенсорном дефиците эффективность патогенетической терапии выше по сравнению с тяжелой полинейропатией. Следует отметить, что в данное исследование были включены пациенты с большим стажем ДПН и выраженным сенсорным дефицитом. Доля таких больных ДПН не превышает 20–25 % от общего их числа. Поэтому полученные результаты могут рассматриваться только с учетом этих ключевых особенностей исследуемой когорты больных.
Эффективность габапентина к концу 4-й недели терапии составила 53 %, что соответствует сложившимся представлениям об эффективности препаратов данного класса: из результатов клинических исследований известно, что эффективность габапентина при болевой ДПН в виде снижения выраженности болевой симптоматики на 50 % и более составляет около 38–45 % [16, 19].
Пролонгация монотерапии габапентином ведет к несущественному увеличению числа респондеров. Комбинированная терапия габапентином и витаминами группы В (Конвалис и Комбилипен® табс) в течение 4 недель характеризуется достоверно большей эффективностью по числу респондеров: 10 из 14 (71,4 %) против 4 из 14 (28,6 %); р < 0,05. Более того, в группе комбинированной терапии отмечена более выраженная динамика интенсивности болевой симптоматики по ВАШ и по шкале NTSS-9 (рис. 5, 6). Динамика болевой симптоматики по шкале NTSS-9 в отличие от ВАШ достоверно различалась между группами уже через 2 недели комбинированной терапии. Среднее снижение выраженности боли по ВАШ составило -19,3 ± 1,34 мм в группе комбинированной терапии по сравнению с -5,6 ± 1,2 мм в группе, продолжившей монотерапию габапентином (р < 0,001).
Анализ безопасности терапии различными препаратами не выявил существенных различий между группами.
Наилучшей переносимостью характеризовался прием АЛК, максимальное число побочных эффектов отмечено среди пациентов, получавших габапентин. При этом важно подчеркнуть, что возникшие побочные эффекты при применении габапентина не повлекли за собой серьезных осложнений и не потребовали отмены препарата (табл. 3).
Полученные результаты подтверждают гипотезу о необходимости дифференцированного подхода к лечению пациентов с болевой ДПН. Особого внимания заслуживают пациенты с выраженным сенсорным дефицитом, у которых, вероятно, механизмы формирования НБ претерпевают значительную трансформацию, что определяет приоритет выбора симптоматических препаратов у данной когорты пациентов.
При выборе препаратов для лечения болевой ДПН необходимо учитывать тяжесть ДПН, особенности пациента, выраженность болевой симптоматики, степень гипергликемии и сопутствующую патологию. Несомненно, необходимы дополнительные, более масштабные клинические исследования в этом направлении.
Заключение
Пролонгированный прием АЛК, как и добавление к терапии витаминов группы В больных умеренной и тяжелой болевой ДПН, являющихся нонреспондерами на внутривенную терапию АЛК, нецелесообразно.
В данной ситуации показано применение симптоматических препаратов центрального действия как в виде монотерапии, так и в комбинации с АЛК.
Применение комплекса витаминов группы В (Комбилипен® табс) пациентами-нонреспондерами на габапентин (Конвалис) сопровождается дополнительным значимым снижением выраженности НБ.



