Последнее десятилетие мы наблюдаем, как в лечении немелкоклеточного рака легкого (НМРЛ) происходят принципиальные изменения. И хотя гистологический подтип опухоли остается важным фактором при выборе режима химиотерапии, мы сегодня знаем, что наличие некоторых ключевых повреждений генома опухолевой клетки предполагает высокую эффективность молекулярно-направленной – «таргетной» – терапии, использующей активирующую мутацию или транслокацию как «ахиллесову пяту» опухоли.
Клинические исследования гефитиниба, эрлотиниба и афатиниба уже в 1-й линии терапии распространенного НМРЛ с мутациями гена EGFR зарегистрировали более 60 % объективных эффектов и значимое увеличение выживаемости без прогрессирования (ВбП), подтвердили предикативное значение мутации EGFR в опухоли для молекулярно-направленного лечения.
Уже в 2007 г. при изучении противоопухолевой активности нового ингибитора (PF-02341066, кризотиниб) трансмембранного рецептора c-Met от нескольких больных раком легкого получен длительный и выраженный эффект. Выяснили, что в опухоли этих пациентов есть транслокации ALK (anaplastic lymphoma kinase) – гена, кодирующего киназу анапластической лимфомы. Дальнейшие исследования подтвердили, что это молекулярно-генетическое повреждение ведет к прогрессированию опухоли, а кризотиниб эффективно блокирует активированный рецептор ALK, вызывая частичные и полные эффекты среди больных диссеминированным раком легкого с транслокацией гена ALK.
Транслокации ALK как активирующая онкогенная мутация в злокачественных опухолях человека
Ген ALK («дикий») в нормальных условиях кодирует соответствующий трансмембранный тирозинкиназный рецептор ALK, передающий внутрь клетки активирующий сигнал через ряд других ферментов, включая фосфатидилинозитол-3-киназу (PI3K) и Янус (Janus)-киназу (JAK) [1]. В нормальных условиях рецептор ALK обнаруживается в центральной нервной системе, тонком кишечнике и яичках.
Уже в 1990 г. показано, что ген ALK участвует в канцерогенезе. Свое название этот ген получил от заболевания «анапластическая лимфома»; в этой опухоли был впервые выявлен этот вариант генетического нарушения [2].
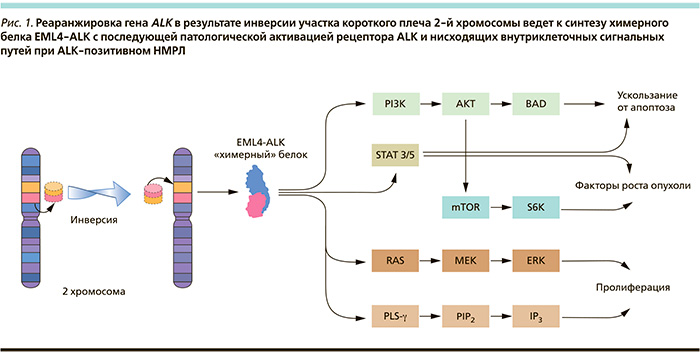
В 2007 г. при исследовании культуры опухолевых клеток, полученных из аденокарциномы легкого японского мужчины (курильщика), обнаружена онкогенная перестройка (реаранжировка, или транслокация) гена ALK, вовлекшая ген EML4 в положении 5’ [3]. Химерный ген EML4-ALK образуется в результате инверсии небольшой части 2р хромосомы со слиянием, как правило, различных участков гена EML4 и части гена ALK [3]. При раке легкого описаны и другие 5’-партнеры транслокации гена ALK (KIF5B и TFG), но EML4-ALK – основной вариант реаранжировки ALK [4, 5].
Сегодня известно, что ALK приобретает онкогенные свойства не только через транслокацию (инверсию) участка хромосомы с образованием функционально активного химерного гена, но и через приобретенные мутации гена ALK с повреждением его функций. Гиперэкспрессия химерного гена ALK сопровождается патологической активацией ALK-рецептора и связанных с ним нисходящих внутриклеточных путей (рис. 1). Однажды возникшая неконтролируемая пролиферация в клетке неизбежно приводит к ее опухолевому перерождению.
ALK-позитивный рак легкого
Современные клинические руководства выделяют уникальную подгруппу больных НМРЛ, где опухоль содержит перестроенный ген ALK, т.н. ALK-позитивный (или ALK+) рак легкого [6]. Согласно современным оценкам, варианты перестройки ALK имеются в 3–5 % случаев НМРЛ в зависимости от популяции и используемого метода выявления ALK [6, 7].
Уже в первых работах было отмечено, что ALK-позитивный рак легкого чаще регистрируется в аденокарциномах, у некурящих (или малокурящих) и молодых пациентов [8–11]. Вероятность выявления в опухоли транслокации ALK в такой особой, «обогащенной» группе больных метастатической аденокарциномой легкого без мутации EGFR составляет ~30 % [9]. Но слияние EML4-ALK наблюдалось и у ранее куривших пациентов пожилого возраста [8]. Следует отметить, что, по некоторым оценкам, скрининг в «обогащенной» популяции (аденокарцинома, некурящие) больных приводит к потере 50 % случаев ALK-позитивного НМРЛ [12]. Поэтому определение статуса ALK необходимо во всех случаях рака легкого за исключением «чистого» плоскоклеточного рака, крупноклеточного рака без иммуногистохимических признаков аденокарциномы [13].
ALK-позитивный НМРЛ – особая опухоль, исходно резистентная к ингибиторам тирозинкиназ EGFR. Она клинически схожа (гистологически аденокарцинома, мало- или некурившие) с опухолями, имеющими мутацию EGFR в опухоли. Выявление химерного ALK, как правило, исключает мутации EGFR и KRAS; но отмечены и одновременные мутации [8, 9, 14].
Диагностика транслокаций ALK
Сегодня для выработки лечебной тактики во всех случаях метастатического и местнораспространенного неплоскоклеточного рака легкого помимо патоморфологического исследования нужна молекулярно-генетическая диагностика опухоли. Для полноценного генетического тестирования необходим достаточный для анализа объем качественно подготовленной опухолевой ткани. Предпочтение отдается гистологическим образцам, хотя квалифицированные лаборатории могут выявлять мутации как в цитологических препаратах, так и в крови. По предварительным данным, биоптаты, полученные после завершения химиотерапии на основе препаратов платины, также пригодны для анализа на транслокацию EML4-ALK [15].
На сегодня в Российской Федерации нет единого общепринятого стандарта диагностики транслокаций ALK; лаборатории используют флуоресцентную гибридизацию in situ (FISH), иммуногистохимическую (ИГХ) детекцию и полимеразную цепную реакцию (ПЦР). Каждый из этих методов имеет достоинства и недостатки, но техническое усовершенствование сближает их диагностические возможности.
Стандартный метод выявления ALK-позитивного НМРЛ – это FISH, утвержден FDA (US Food and Drug Administration,) как единственный тест, подтверждающий наличие реаранжировки ALK в опухоли [16]. Практическое значение других методов обнаружения транслокации ALK – ПЦР- и ИГХ-исследования – пока не определено. Однако ИГХ-метод (с высокоспецифичными антителами) может использоваться как скрининг-тест реаранжировок ALK; положительный результат ИГХ-исследования, как правило, необходимо подтверждать FISH-тестом [17, 18].
Первые результаты использования кризотиниба
Уже первое клиническое исследование (PROFILE-1001) показало очень высокую (более 60 %) противоопухолевую эффективность молекулы PF-02341066 (кризотиниб) в отношении больных (в т.ч. и НМРЛ) с транслокацией ALK [19]. В исследовании определены оптимальный терапевтический режим кризотиниба (250 мг внутрь 2 раза в сутки длительно) и фармакокинетические параметры. Максимальная концентрация препарата отмечается через 4–6 часов после приема натощак первой дозы, период полувыведения составляет 42 часа, равновесная концентрация достигается через 15 дней регулярного приема по 2 раза в сутки. Биодоступность препарата составляет 43 %, прием пищи мало влияет на всасывание. Кризотиниб метаболизируется в печени системой ферментов CYP3A4/5: следовательно, ингибиторы (например, кетоконазол) CYP3A4/5 значимо замедляют, а индукторы (например, рифампицин) ускоряют выведение препарата.
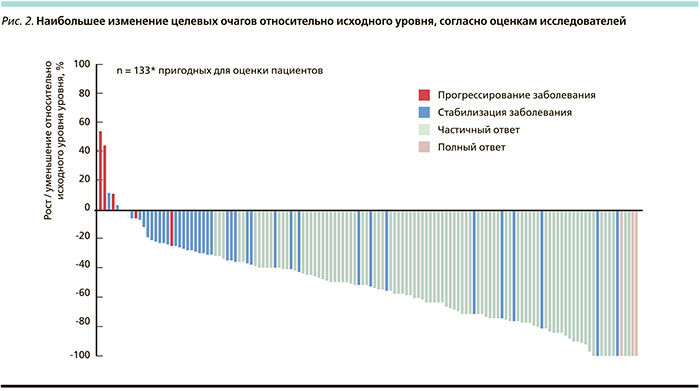
В группе из 116 больных ALK-позитивным НМРЛ, ранее получавших несколько вариантов химиотерапии, частичные и полные эффекты на терапии кризотинибом зарегистрированы в 61 % случаев; вероятность ВбП к 6-му и 12-му месяцам – в 90 и в 81 % соответственно при медиане ВбП около 10 месяцев [20]. Рис. 2 («водопад») иллюстрирует высокую противоопухолевую активность кризотиниба (n = 133, PROFILE-1001) [21].
Для небольшой группы (n = 24) больных ALK-позитивным НМРЛ, получавших кризотиниб уже в 1-й линии лечения, медиана ВбП составила 18,3 месяца [21].
Продолжается исследование II фазы PROFILE-1005: кризотиниб в дозе 250 мг 2 раза в сутки длительно назначается ранее леченным больным ALK-позитивным НМРЛ (в т.ч. с метастазами в головной мозг). По данным оценки 261 случая лечения, полные и частичные эффекты отмечены в 59,8 %, медиана без прогрессирования составила 8,1 месяца (95 % доверительный интервал [ДИ] – 6,8–9,7) [22]. При эффективном лечении симптомы заболевания быстро регрессируют – медиана времени до симптомного эффекта составляет 8 недель [22, 23]. Препарат был эффективным и при метастатическом поражении головного мозга: из 18 случаев лечения зарегистрировано 2 полных плюс 2 частичных эффекта и 12 стабилизаций [22, 23].
Кризотиниб хорошо переносится и вызывает относительно немного побочных эффектов. Чаще всего (61 % случаев) в начале лечения отмечаются преходящие нарушения зрения 1–2-й степеней. У больных отмечается диплопия, фотопсия, светобоязнь, мерцание, затуманивание, накладывающиеся тени, нарушения поля зрения, ухудшение остроты, видимость посторонних предметов, изменение яркости. При низкой освещенности пациенты отмечают сохранение изображения, вспышки света, не связанные с реальными источниками света, сохранение изображений высококонтрастных предметов [20, 24].
Нарушения зрения отмечались чаще по утрам (46–59 %) и/или вечерам (70–74 %), длительность каждого эпизода составляла ≤ 1 минуты. Большинство пациентов сообщали, что нарушения зрения совсем не беспокоили их или беспокоили немного, что практически не влияло на повседневную деятельность [25]. Механизмы этой токсичности пока неизвестны: офтальмологическое обследование не выявило значимых отклонений.
Побочные эффекты со стороны желудочно-кишечного тракта (тошнота, рвота, диарея, боли в животе, стоматит), анорексия, слабость, лихорадка чаще всего были слабо выражены и преходящи [6, 20, 26]. Иногда тошнота и рвота значительно уменьшались при приеме препарата после еды. Периферические отеки 1–2-й (28 %)степеней на фоне терапии кризотинибом могли усугубляться [20].
Редко отмечались побочные эффекты 3–4-й степеней: повышение уровней трансаминаз (аспартатаминотрансферазы и/или аланинаминотрансферазы), нейтропения, слабость. При снижении суточной дозы (иногда при перерыве в лечении) терапию можно продолжить [6, 20, 26]. Зарегистрировано несколько случаев пневмонитов и интерстициальной болезни легких, приведших к смерти [22]. Пневмонит, развившийся на терапии кризотинибом, – абсолютное противопоказание к продолжению лечения.
Довольно быстро у мужчин, получающих кризотиниб, может развиться гипогонадизм. С учетом длительности эффективной терапии необходимо активное выявление признаков снижения уровня тестостерона (астения, депрессия, снижение либидо и др.), по показаниям – измерение концентрации гормона в плазме и назначение заместительной терапии в случае подтверждения гипогонадизма [27].
Кризотиниб (Ксалкори, Pfizer), конкурентный ингибитор АТФ тирозинкиназ рецепторов ALK, MET и ROS1, рекомендован FDA 26.08.2011 для лечения распространенного ALK-позитивного НМРЛ. Препарат проявляет схожую высокую противоопухолевую активность при опухолях, несущих транслокацию ROS1 (около 1 % НМРЛ) [28].
Кризотиниб – стандарт лечения ALK-позитивного рака легкого
По результатам рандомизированного клинического исследования (РКИ) III фазы (PROFILE-1007), во 2-й линии лечения ALK-позитивного НМРЛ кризотиниб был существенно эффективнее стандартных режимов химиотерапии доцетакселом и пеметрекседом [29]. При скрининге в группе из 4967 больных аденокарциномой легкого выявлено 347 случаев ALK-позитивного НМРЛ; пациенты рандомизированы в отношении 1 : 1 – 173 на терапию кризотинибом и 174 на химиотерапию (доцетаксел или пеметрексед). Непосредственная противоопухолевая эффективность кризотиниба составила 65 % (95 % ДИ – 58–72), а химиотерапии (доцетаксел или пеметрексед) – 20 % (95 % ДИ – 14–26; р < 0,001). Эффективность кризотиниба – 66 % (95 % ДИ 58–73) достоверно выше и пеметрекседа (29 %; 95 % ДИ – 21–39) и доцетаксела (7 %; 95 % ДИ – 2–16).
Для пациентов на лечении кризотинибом медиана ВбП составила 7,7 месяца, на химиотерапии – 3 месяца (расчетная вероятность прогрессирования или смерти на кризотинибе; отношение шансов [ОШ] = 0,49; 95 % ДИ – 0,37–0,64; р < 0,001).
Медиана продолжительности жизни в сравниваемых группах не различалась и составила 20,3 месяца (95 % ДИ 18,1 – не достигнута) для кризотиниба и 22,8 месяца (95 % ДИ 18,6 – не достигнута) при химиотерапии (ОШ смерти – 1,02; 95 % ДИ – 0,68–1,54; р = 0,54). Из 174 больных, получавших химиотерапию, 112 (64 %) при прогрессировании (по выбытии из исследования) в последующем получали кризотиниб; 34 (20 %) больных после окончания химиотерапии кризотиниб не получали. Вероятно, именно последующее лечение кризотинибом значительной части больных группы химиотерапии исказило результаты сравнительного анализа общей выживаемости: различий в продолжительности жизни для сравниваемых групп не выявлено. Пациенты отмечали более выраженный симптомный эффект кризотиниба, сопровождаемый значимым улучшением качества жизни.
В 2013 г. NCCN (National Comprehensive Cancer Network) рекомендовал применение кризотиниба при ALK- и ROS1-позитивных опухолях в 1-й линии лечения распространенного НМРЛ [30].
Ожидаются результаты проспективного рандомизированного клинического исследования III фазы PROFILE-1014 (сравнение эффективности кризотиниба с режимом цис/карбоплатин + пеметрексед) при распространенном неплоскоклеточном ALK-позитивном НМРЛ 1-й линии лечения.
Заключение
Успешная и скоротечная история вокруг ALK-позитивного НМРЛ уже стала хрестоматийной. Выявление транслокации ALK при аденокарциноме легкого, доказательство онкогенного значения патологической активации трансмембранного рецептора ALK и счастливое обретение его клинически эффективного ингибитора кризотиниба – яркие достижения современной онкологии.
Но, как и в случае с другими успешными ингибиторами тирозинкиназы, несмотря на выраженный и скорый противоопухолевый эффект кризотиниба, у большинства больных разовьется резистентность. Еще предстоит выяснить механизмы приобретенной резистентности к ингибиторам тирозинкиназы ALK и разработать терапевтические стратегии преодоления возникшей лекарственной устойчивости. Есть первые успехи: церитиниб (Zykadia®, Novartis) оказался эффективным в > 60 % случаев ALK-позитивного НМРЛ, резистентного к кризотинибу, и 29.04.2014 зарегистрирован FDA по этому показанию. Несколько перспективных ALK-ингибиторов тирозинкиназы находятся на разных стадиях клинических исследований.
Кризотиниб – первый эффективный препарат лечения распространенного ALK-позитивного рака легкого. Но не менее важен другой факт: из общей группы больных НМРЛ выделена схожая группа пациентов с транслокациями генов ALK и ROS1. Пациенты, в чьих опухолях выявлены эти молекулярно-генетические повреждения, могут и должны получать эффективную молекулярно-направленную терапию, улучшающую качество жизни и, возможно, продлевающую непосредственно жизнь.


