По данным Всемирной организации здравоохранения, сердечно-сосудистые заболевания остаются ведущей причиной смерти на протяжении прошлого десятилетия. В России сосудистые заболевания мозга занимают второе место (39 %) в структуре смертности от болезней системы кровообращения и в общей смертности населения (23,4 %).
Ежегодная смертность от инсульта в России – одна из наиболее высоких в мире (175 на 100 тыс. населения). Инсульт является лидирующей причиной инвалидизации населения. По данным Национального регистра инсульта, 31 % больных, перенесших инсульт, нуждаются в посторонней помощи, 20 % не могут самостоятельно ходить [1].
По данным 34-летнего Фремин-гемского наблюдения, риск развития ишемического инсульта у больных фибрилляцией предсердий (ФП) увеличивается в 5 раз [2]. Тромбоэмболические осложнения (ТЭО) у больных ФП служат последствием развития тромбоза ушка левого предсердия, что в свою очередь становится следствием сочетания таких состояний, как дисфункция эндотелия, нарушение ламинарности кровотока и врожденная или приобретенная предрасположенность к гиперкоагуляции. Риск развития ТЭО увеличивается с возрастом, что возможно объяснить тромбоцитарно-эндотелиальной теорией старения [2, 3].
Раннее выявление больных групп высокого риска по развитию инсульта с последующим проведением превентивного медикаментозного и при необходимости хирургического лечения позволяет уменьшить число инсультов более чем в 2 раза.

Согласно данным клинических исследований, для больных старше 65 лет с ФП стратегия контроля ритма не имеет преимуществ перед стратегией контроля частоты желудочковых сокращений (ЧЖС) в качестве средства профилактики ТЭО [4]. На выбор той или иной стратегии влияет форма ФП (пароксизмальная, персистирующая, длительно персистирующая, постоянная), клинические проявления заболевания и предпочтения самого пациента.
Длительное время в арсенале врача для профилактики ТЭО у больных ФП было только две группы лекарственных препаратов – антагонисты витамина К и антиагреганты. По данным мета-анализа 29 клинических исследований, показано, что варфарин более эффективен в профилактике ТЭО у больных ФП без поражения клапанов по сравнению с антиагрегантами, в т.ч. и в режиме двойной антитромбоцитарной терапии (табл. 1) [5, 6].
Результатом действия антагонистов витамина К служит снижение биологической активности факторов свертывания II, VII, IX, X и антикоагулянтов протеинов C, S и Z. Метаболизм варфарина также связан с ферментной системой цитохрома Р450. Эффективность применения антагонистов витамина К зависит и от потребляемых продуктов. Ряд из них, содержащих витамин К, считаются естественными антидотами. Некоторые продукты и пищевые добавки растительного происхождения (грейпфрутовый сок, клюква, чеснок, гвоздика, имбирь, валериана и др.) могут изменять метаболизм варфарина, что приводит к увеличению концентрации препарата в крови и, соответственно, к повышению риска развития кровотечений.
По данным генетических исследований, в Европе от 20 до 30 % людей имеют «дефектные» гены, отвечающие за синтез ферментов эпоксидредуктазного комплекса (VKORC1 – Vitamin K epoxide reductase) и системы цитохрома P450 CYP2C9. Высокая стоимость фармакогенетического тестирования ограничивает широкое применение данного исследования. По мнению ряда авторов, проведение фармакогенетического исследования позволяет уменьшить период подбора поддерживающей дозы варфарина и снижает риск геморрагических осложнений, обусловленных фармакогенетической «гиперчувствительностью» к варфарину [8–10]. На основании данных клинических исследований показано, что с возрастом изменяется метаболизм лекарственных препаратов, в т.ч. увеличивается чувствительность к варфарину, что требует коррекции поддерживающей дозы. Для мониторинга эффективности и безопасности применения антагонистов витамина К необходимо оценивать протромбиновое время и его производное – международное нормализованное отношение (МНО).
Согласно результатам трехлетнего наблюдения D.S. Budnitz, в структуре экстренных госпитализаций пациентов старше 65 лет в связи с развитием побочных эффектов на фоне приема лекарственных препаратов 33,3 % случаев связаны с приемом варфарина. При этом риск развития геморрагических реакций можно было предотвратить на треть при наличии более четкого контроля терапии и переоценки риска кровотечений [11].
Таким образом, применение варфарина в клинической практике имеет определенные ограничения и неудобства, обусловленные рядом известных факторов.
На консультацию к кардиологу обратилась больная Л. 73 лет с жалобами на повышенную кровоточивость при бытовых мелких травмах (порезах) на фоне приема варфарина в суточной дозе от 1½ до 2 таблеток. При опросе больной были выявлены проблемы с дозированием варфарина: широкий диапазон результатов уровня МНО от 1,5–5,0.
В анамнезе заболевания у больной в течение нескольких лет имели место персистирующая форма ФП, неоднократные госпитализации для восстановления синусового ритма. После перенесенного острого нарушения мозгового кровообращения по ишемическому типу было принято решение не восстанавливать синусовый ритм и рекомендовать лекарственные препараты для поддержания нормосистолии, а также постоянный прием антикоагулянта – варфарина под контролем МНО.
На момент обращения больная Л. регулярно принимала бетаксолол, дигоксин, периндоприл, аторвастатин. По данным самоизмерений, артериальное давление (АД) составляло 120–140/80–90 мм рт. ст., частота желудочковых сокращений (ЧЖС) – 60–80 уд/мин в покое. На электрокардиограмме (ЭКГ) отмечены нормосистолическая форма ФП, амплитудные признаки гипертрофии миокарда левого желудочка (ЛЖ). По данным биохимического анализа крови, расчетный клиренс креатинина составил 47 мл/мин, по данным эхокардиографии (ЭхоКГ) – увеличение полостей предсердий, клапаны без изменений, признаки диастолической дисфункции ЛЖ, фракция выброса – 57 %; по данным ультразвуковой допплерографии магистральных артерий головы – признаки нестенозирующего поражения сонных артерий; по данным мониторирования ЭКГ – в течение суток регистрировалась постоянная форма ФП, на фоне увеличения ЧЖС до 140 ударов в минуту на высоте физической нагрузки зарегистрированы эпизоды горизонтальной депрессии интервала ST до 1,5 мм.
Поводом для обращения пациентки стал вопрос: возможно ли отменить варфарин и есть ли альтернативные лекарственные препараты, не требующие регулярного контроля лабораторных показателей свертывания крови?

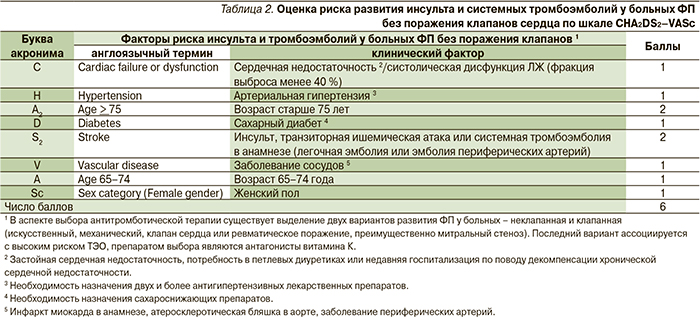
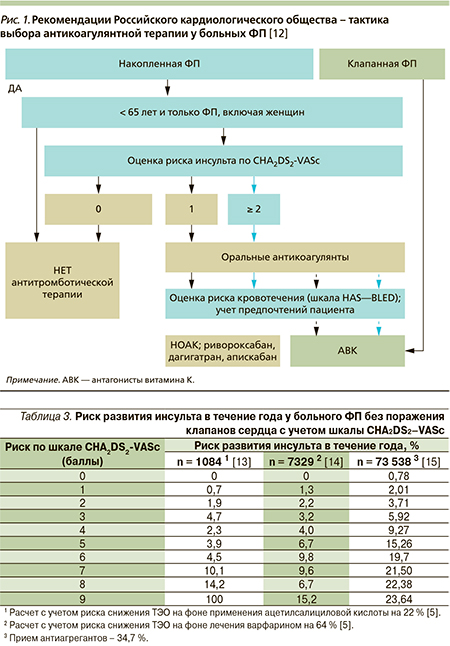
В данном случае необходимость продолжения профилактической антикоагулянтной терапии была обусловлена высоким риском развития повторного инсульта. В соответствии с современными национальными рекомендациями Российского кардиологического общества, Всероссийского научного общества аритмологов и Ассоциации сердечно-сосудистых хирургов с целью индивидуальной оценки риска ТЭО у больных ФП для решения вопроса о назначении антикоагулянтной терапии необходимо использовать шкалу CHA2DS2–VASc (congestive heart failure – сердечная недостаточность, hypertension – артериальная гипертензия, age – возраст, diabetes mellitus – сахарный диабет, stroke – инсульт, vascular disease – поражение сосудов, age – возраст, sex category – пол; рис. 1) [12]. Данная модифицированная шкала была предложена в 2009 г. группой исследователей из Бирмингема под руководством G.Y. Lip и получила название акроним CHA2DS2–VASc (табл. 2) [12].
В соответствии со шкалой CHA2DS2–VASc все факторы риска развития ТЭО у больных ФП были условно разделены на «большие факторы» (оцениваются в 2 балла) и «клинически значимые небольшие» факторы риска (оценка в 1 балл). При этом низким риском обладают больные ФП, не имеющие ни одного из перечисленных факторов (т.е. 0 баллов), а также женщины моложе 65 лет без других факторов риска. Пациентам с низким риском ТЭО антитромботическая терапия не рекомендуется. При наличии 1 балла риск оценивается как промежуточный или средний, при наличии 2 и более баллов – как высокий.
По результатам клинических исследований показано, что вероятность инсульта и системных эмболий у больных ФП возрастает с увеличением баллов, рассчитанных по шкале CHA2DS2–VASc [13–15]. По сравнению с предшествующей шкалой CHADS2 система оценки риска развития тромбоэмболических осложнений, предложенная G.Y. Lip и соавт., включает наиболее распространенные факторы риска инсульта в клинической практике и позволяет выявлять больных с низким риском, которым антитромботическая терапия не показана.
По шкале CHA2DS2–VASc (возраст старше 65 лет, женский пол, наличие острого нарушения мозгового кровообращения в анамнезе, наличие артериальной гипертензии) высокий риск ТЭО имеется при оценке 6 баллов (табл. 3).
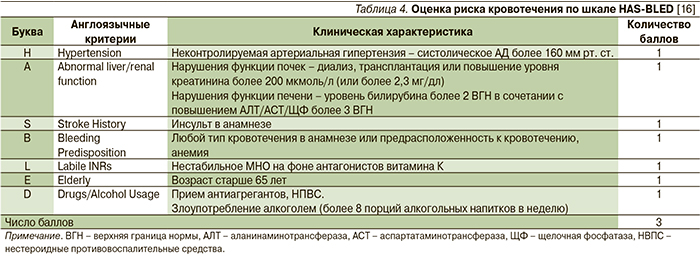
На следующем этапе при определении тактики ведения пациента с ФП в соответствии с национальными рекомендациями (класс I, уровень А) требуется оценка риска развития кровотечений по шкале HASBLED (hypertension – гипертензия, abnormal renal/liver function – нарушение функции почек и печени, stroke – инсульт, bleeding history or predisposition – кровотечения в анамнезе и/или предрасположенность к ним, labile international normalized rabio – лабильное МНО, elderly – возраст (> 65 лет), drugs/alcogol concomitantly – совместный прием медикаментов и/или алкоголя; табл. 4).
Если сумма баллов по данной шкале будет составлять 3 и более, то риск развития кровотечения следует рассматривать как высокий. При этом отказываться от назначения антикоагулянтной терапии не следует. По возможности рекомендуется скорригировать факторы, которые могут спровоцировать данное осложнение (высокое АД, прием НПВС и т.п.).
Риск развития геморрагических осложнений по шкале HASBLED у нашей пациентки составил 3 балла. Однако при оценке риска развития геморрагических осложнений на фоне антикоагулянтной терапии такой показатель, как лабильность протромбинового времени (уровень МНО), является модифицируемым. Это означает, что при более предсказуемом действии препарата риск кровотечений снижается. Вероятно, лабильность уровня МНО у пациентки Л. могла быть связана с рядом факторов, такими как образ жизни и питание.
В соответствии с национальными рекомендациями пациентам с ФП без поражения клапанов при недостаточном поддержании целевого уровня МНО рекомендован переход на новые оральные антикоагулянты – НОАК [11].
Длительное время прямые парентеральные антикоагулянты – гепарины (нефракционированный и низкомолекулярные) – оставались единственным препаратом с механизмом действия, обусловленным воздействием на активированный X-фактор и тромбин. Длительность применения данных препаратов ограничена из-за парентерального способа введения. Исследование структуры основных белковых факторов свертывания привело к разработке новых фармакологически активных молекул. Появление в клинической практике оральных антикоагулянтов, имеющих сходный механизм действия с гепаринами, по своему практическому значению ряд экспертов сравнивают с разработкой пенициллина.
В настоящее время для профилактики ТЭО у больных ФП без патологии клапанов одобрены следующие группы НОАК:
- ингибитор тромбина (дабигатран);
- ингибиторы фактора Xа (ривароксабан, апиксабан).
Характеристика НОАК представлена в табл. 5.
Согласно современным национальным рекомендациям, для большинства больных ФП без поражения клапанов НОАК более предпочтительны по отношению к антагонистам витамина К, т.к. по эффективности не уступают последним, имеют благоприятный профиль безопасности, не требуют подбора поддерживающей дозы и последующего контроля показателей свертывающей системы [11].
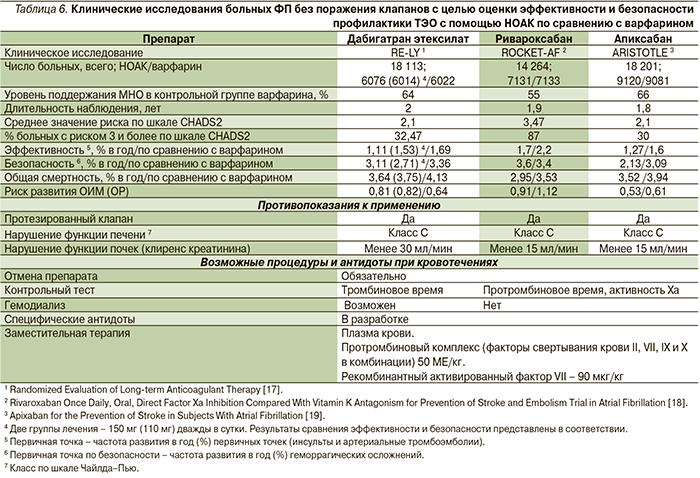
Результаты рандомизированных клинических исследований больных ФП без поражения клапанов показали, что применение НОАК по эффективности не уступает варфарину (табл. 6). Пациентов с гемодинамически значимыми пороками клапанов или с протезированными клапанами сердца в данные исследования не включали.
При этом НОАК имеют мало лекарственных взаимодействий (табл. 7).

В исследовании ROCKET AF показано, что в популяции пациентов, следовавших назначенному лечению, эффективность ривароксабана достоверно превосходит по эффективности варфарин на 21 % в отношении предотвращения инсультов и внемозговой эмболии [17]. Кроме того, при применении НОАК отмечено снижение числа внутричерепных кровотечений. В дополнение к этому в исследованиях, изучавших применение антагониста Ха-фактора ривароксабана, отмечена тенденция к снижению числа инфарктов миокарда. В подтверждение гипотезы о лучшем профиле безопасности ривароксабана для пациентов с высоким риском коронарных событий был проведен ряд исследований – мета-анализов, в которых данное предположение подтвердилось [20].
Конечно, в случае с пациенткой Л. не было сомнений в необходимости ее переключения на один из НОАК, но возник вопрос: какому препарату отдать предпочтение в данном случае?
Прямых сравнительных клинических исследований НОАК не проведено. Поэтому достоверно установить, какой новый антикоагулянт более эффективен и безопасен, в настоящее время нельзя. НОАК имеют различия в механизме действия и фармакокинетических параметрах. Лабораторный контроль в отношении НОАК необходим в тех случаях, когда развивается кровотечение или ТЭО или требуется решить вопрос о проведении хирургического вмешательства.
При выборе оптимального антикоагулянта для пациентки Л. было необходимо учесть анамнестические данные, сопутствующую патологию, ее предпочтения.
В настоящее время в научных публикациях, посвященных ФП, уделяется много внимания проблеме риска развития коронарных событий у таких больных. С целью уточнения данных по этому вопросу было проведено несколько мета-анализов. В одном из них были проанализированы данные 28 рандомизированных клинических исследований по НОАК, в которых участвовали 138 948 пациентов. Результаты продемонстрировали статистически значимое снижение риска инфаркта миокарда на фоне применения ривароксабана по сравнению с контролем (на 22 %), при этом применение ингибиторов тромбина (дабигатрана этексилата) сопровождалось повышением риска коронарных событий по сравнению с контрольной группой [21].
Кроме того, пациентка Л. уже перенесла ишемический инсульт. В исследовании ROCKET AF более 50 % больных имели инсульт или транзиторную ишемическую атаку в анамнезе. Эффективность и безопасность применения ривароксабана были подтверждены как для первичной, так и для вторичной профилактики инсульта у больных ФП без поражения клапанов [21].
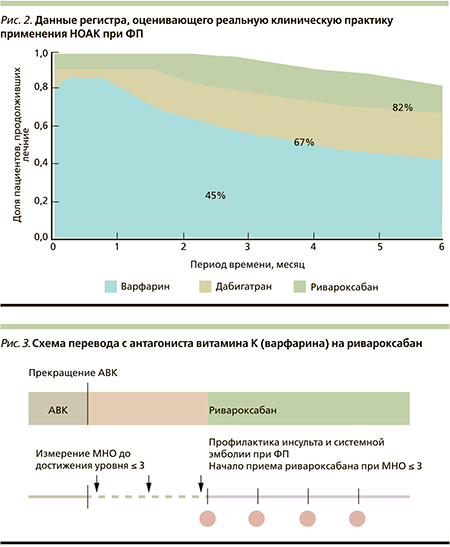
Вопрос о приверженности к длительно применяемой терапии всегда был и остается актуальным. Для решения этого вопроса проводится немало исследований препаратов различных групп, в т.ч. и по антикоагулянтам. В проведенном недавно исследовании (регистре) по данным реальной клинической практики оценивали приверженность терапии оральными антикоагулянтами пациентов ФП без поражения клапанов. По его результатам, доложенных на Европейском конгрессе кардиологов в Амстердаме, через 6 месяцев на терапии варфарином, дабигатраном и ривароксабаном оставались 45 %, 67 и 82 % пациентов соответственно (рис. 2). Таким образом, более высокая приверженность длительной терапии антикоагулянтами может способствовать более надежной профилактике инсульта [23].
В заключение хотелось отметить, что выбор препарата согласован с пациенткой. Она отметила, что однократное применение для нее предпочтительнее и будет способствовать лучшему соблюдению назначенной терапии.
С учетом высокого риска коронарных событий, наличия ишемического инсульта в анамнезе, предпочтений самой пациентки в данном случае выбор был сделан в пользу ривароксабана. Доза 15 мг 1 раз в сутки была выбрана с учетом наличия у пациентки снижения уровня клиренса креатинина ниже 50 мл/мин. Переход на новый антикоагулянт был рекомендован после отмены варфарина и снижения уровня МНО до 3,0 и менее (рис. 3).
Заключение
Результаты клинических исследований показали эффективность и безопасность применения ривароксабана больными ФП без поражения клапанов. Длительное применение ривароксабана однократно в сутки не требует рутинного лабораторного мониторинга показателей свертываемости крови, т.к. ограничен спектр лекарственных взаимодействий, характер питания не оказывает влияния. По данным мета-анализа клинических исследований, ривароксабан имеет преимущества для пациентов с высоким риском развития коронарных событий. В соответствии с инструкцией по медицинскому применению переход на ривароксабан после отмены варфарина рекомендуется при значении МНО 3,0 и менее.
Таким образом, в арсенале лекарственных средств профилактики тромбоэмболических осложнений появился новый пероральный антикоагулянт – ривароксабан.



