Тридцатого сентября 2013 г. FDA разрешило применение в США нового антидепрессанта вортиоксетина (Бринтелликс, Лундбек) для лечения больших депрессивных расстройств у взрослых [1]. До конца этого года ожидается одобрение препарата в Евросоюзе, а затем – в Японии. Эксперты предсказывают, что в течение первых нескольких лет после поступления препарата на фармацевтический рынок США объем его ежегодных продаж сможет превысить 1 млрд долл. Это обусловлено тем, что, несмотря на массу имеющихся антидепрессантов, все они обладают существенными недостатками, в т. ч. медленным развитием терапевтического эффекта, низкой долей пациентов, отвечающих на лечение конкретным препаратом (по данным американского исследования STAR*D менее 50 %) [2], и нежелательными эффектами, негативно влияющими на качество жизни больных и их приверженность терапии. В последние годы для преодоления этих недостатков предложен мультимодальный подход, т. е. разработка препаратов, имеющих минимум два механизма фармакологического действия, дополняющих друг друга с точки зрения эффективности и безопасности [3–4]. Именно к таким препаратам принадлежит вортиоксетин.
Механизм действия и фармакологические свойства вортиоксетина
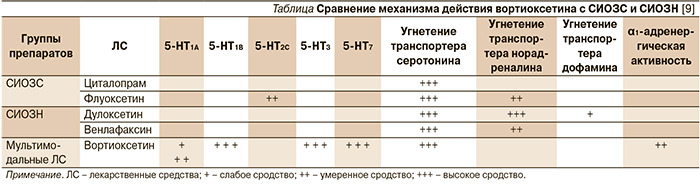
Механизм действия вортиоксетина до конца не ясен, однако в связи со способностью одновременно модулировать активность серотониновых рецепторов и угнетать обратный захват серотонина он рассматривается как мультимодальный антидепрессант (см. таблицу). Препарат проявляет антагонизм по отношению к серотониновым рецепторам 5-HT3A, 5-HT7 и 5-HT1D, является агонистом 5-HT1A- и частичным агонистом 5-HT1B-рецепторов, а также мощным ингибитором обратного захвата серотонина [5–7]. Кроме того, у него выявлено влияние на β1-адренергические рецепторы, которое не связано с терапевтическим действием, но может способствовать развитию побочных эффектов со стороны сердечно-сосудистой системы [8].
Основная роль в механизме антидепрессивного и анксиолитического действия вортиоксетина принадлежит угнетению обратного захвата серотонина [9]. Одновременная стимуляция 5-HT1A-рецепторов вызывает быструю десенсибилизацию соматодендрических ауторецепторов, ингибирующих высвобождение серотонина из нервных окончаний, и активацию постсинаптических 5-HT1A, что в итоге приводит к повышению экстрацеллюлярных концентраций серотонина и усилению антидепрессивного эффекта. Вортиоксетин имеет высокое сродство и к другим 5-НТ-рецепторам, связываясь в клинических дозах (5–20 мг) с 50–90 % из них [10], но вклад каждого из серотониновых рецепторов в реализацию его антидепрессивного эффекта остается не до конца понятным. В доклинических исследованиях применение вортиоксетина ассоциировалось с более быстрым восстановлением активности серотонинергических нейронов, чем применение флуоксетина (1 день по сравнению с 14), что может быть связано с блокадой 5-HT3-рецепторов [11]. Предполагают, что через 5-HT3-рецепторы может быть опосредовано влияние препарата на настроение и рвотный рефлекс. 5-HT7-рецепторы принимают участие в регуляции сна, циркадианных ритмов и настроения [9]. Кроме того, имеется достаточно обширная доказательная база, подтверждающая значение серотониновых рецепторов (5-HT1A-, 5-HT1B-, 5-HT2-, 5-HT3-, 5-HT4-, 5-HT6- и 5-HT7-) для когнитивной деятельности [6]. В экспериментальных исследованиях in vivo было продемонстрировано опосредованное через 5-HT-рецепторы стимулирующее действие вортиоксетина на глутаматергическую передачу [12, 13], что способствовало улучшению внимания, памяти и исполнительных функций у животных [6, 14, 15]. Этот эффект потенциально способен определять преимущества вортиоксетина перед антидепрессантами групп селективных ингибиторов обратного захвата серотонина (СИОЗС) и селективных ингибиторов обратного захвата норадреналина (СИОЗН) для определенных групп пациентов, особенно пожилого возраста [12, 13].
Вортиоксетин имеет благоприятные фармакокинетические свойства. Он хорошо всасывается в желудочно-кишечном тракте (биодоступность – 75 %), создает максимальные концентрации в крови через 7–11 часов. Стабильные концентрации в крови достигаются через 2 недели ежедневного применения. Препарат имеет линейную фармакокинетику, что позволяет прогнозировать изменение его концентраций в крови в зависимости от изменения дозы, и длительный период полувыведения (около 57 часов), предполагающий отсутствие выраженного эффекта отдачи или синдрома отмены после пропуска дозы или прекращения лечения [16]. Вортиоксетин метаболизируется с участием нескольких изоферментов системы цитохрома Р450 (CYP2D6, CYP2C9, CYP3A4/5, CYP2A6 и CYP2C19), поэтому с теоретической точки зрения его уровень в сыворотке крови не должен существенно меняться под влиянием препаратов, в биотрансформации которых принимает участие один из этих ферментов [17]. Однако в целенаправленном исследовании, посвященном изучению лекарственных взаимодействий вортиоксетина, показано, что коррекция его доз может понадобиться при одновременном приеме с рифампицином и бупропионом [18]. Выделяется вортиоксетин с мочой и калом, преимущественно в виде метаболитов.
Клинические исследования
Основанием подачи заявки на регистрацию препарата в FDA стали результаты шести краткосрочных и одного долгосрочного исследований с участием в общей сложности более 7500 пациентов в возрасте от 18 до 88 лет. В краткосрочных плацебо-контролируемых исследованиях была продемонстрирована эффективность вортиоксетина в качестве антидепрессивного средства в дозах от 5 до 20 мг/сут, однако наиболее постоянный терапевтический эффект наблюдался при применении в дозах 15–20 мг/сут [19–23]. В двух исследованиях, где применяли низкие дозы вортиоксетина (2,5–5,0 мг/сут), его эффективность не отличалась от таковой при приеме плацебо [24, 25].
Одно краткосрочное исследование было посвящено изучению вортиоксетина на пожилых больных (средний возраст – 70,6 года) [26]. Препарат применяли в суточной дозе 5 мг. Ответ на лечение при оценке по Шкале депрессии Гамильтона в конце 8-й недели наблюдался у 53,2 % пациентов основной группы по сравнению с 35,2 % в группе плацебо, ремиссия – 29,2 и 19,3 % соответственно. Кроме того, вортиоксетин продемонстрировал достоверное превосходство перед плацебо по влиянию на когнитивные функции, включая скорость обработки информации, вербальное обучение и память.
Эффективность препарата при длительном применении изучалась в двух исследованиях. Одно из них – открытое 52-недельное – стало продолжением 8-недельного двойного слепого плацебо-контролируемого сравнительного исследования вортиоксетина с дулоксетином [27]. Исследование завершили 328 участников, получавших вортиоксетин [28]. Анализ, проведенный в конце 52-й недели, показал, что терапевтический эффект препарата не только не снижается, но и возрастает при длительном использовании. Доля ответивших на лечение пациентов существенно увеличилась – с 63 до 94 %.
Рецидив развился только у 9,7 % из 226 участников, вступивших в открытую часть исследования в стадии ремиссии. Число больных с показателями по шкале Монтгомери–Асберга (MADRS) ≤ 10 увеличилось с 42 до 83 %.
Другое длительное двойное слепое плацебо-контролируемое исследование служило продолжением открытого 12-недельного исследования, участниками которого были 639 пациентов в возрасте 18–75 лет с текущим эпизодом депрессии продолжительностью 4 или более недель, которые получали вортиоксетин в дозе 5 или 10 мг/кг. Среди пациентов, достигших ремиссии (MADRS ≤ 10) на 10-й и 12-й неделях открытой части исследования, 396 были рандомизированы в группы плацебо (n = 192) или вортиоксетина (n = 204). Анализ результатов показал, что вортиоксетин значительно превосходил плацебо по показателю времени до развития рецидива (отношение рисков – 2,0; 95 % ДИ – 1,26–3,21; p = 0,0035). Частота рецидивов составила 13 % (n = 27) в группе активного препарата по сравнению с 26 % (n = 50) в группе плацебо; NNT (число пациентов, которое необходимо пролечить для предотвращения 1 рецидива) составило 8 [29].
В сравнительных исследованиях с другими антидепрессантами вортиоксетин по эффективности уступал дулоксетину [24, 26, 27], был сопоставим с венлафаксином [20] и превосходил агомелатин [30]. При этом он реже препаратов сравнения вызывал побочные эффекты, в т. ч. реже венлафаксина сексуальную дисфункцию. Однако выбор препаратов сравнения подвергался критике экспертов. В частности, агомелатин продемонстрировал недостаточную эффективностью в клинических исследованиях, в связи с чем производитель добровольно отказался от подачи заявки на его регистрацию в США [31]. Дулоксетин, не имея, по результатам мета-анализа, преимуществ перед другими антидепрессантами с точки зрения эффективности, уступает ряду СИОЗС и СИОЗН по переносимости [32]. Данные исследований по венлафаксину не подтверждают информацию производителя о более низкой частоте сексуальной дисфункции [33]. В целом вортиоксетин хорошо переносился в клинических исследованиях. Его наиболее распространенными побочными эффектами были тошнота, запоры, сухость во рту, гипотиреоз и головная боль [19, 24, 25, 28]. В краткосрочных исследованиях нежелательные реакции оказались причиной отмены препарата для 5–8 % пациентов. Вортиоксетин редко вызывал седацию, сонливость и практически не влиял на массу тела, включая длительные исследования [28].
В инструкцию по применению препарата, как и других антидепрессантов, внесено предостережение о повышенном риске суицида среди лиц в возрасте от 18 до 24 лет. К его потенциальным серьезным нежелательным реакциям относится развитие серотонинового синдрома и кровотечений, особенно на фоне лекарственных взаимодействий.
Место вортиоксетина в терапии аффективных расстройств
Место вортиоксетина в лечении депрессивных расстройств должны определять результаты последующих исследований. Дальнейшего изучения требует его эффективность по сравнению с широко применяемыми антидепрессантами в различных подгруппах пациентов, в т. ч. не отвечающих на терапию другими препаратами или плохо их переносящих вследствие седативного эффекта, прибавки веса и, возможно, сексуальной дисфункции. Особый интерес вызывает применение препарата больными сопутствующими когнитивными нарушениями, прежде всего пожилого возраста, которых нарушение когнитивных функций может приводить к развитию деменции и ассоциируется с более высоким уровнем инвалидизации и смертности [34]. В настоящее время проводятся целенаправленные клинические исследования по изучению эффектов вортиоксетина на когнитивные функции [1, 35]. Вортиоксетин также изучается в качестве анксиолитика [36–39].


