Введение
Синдром слабости синусового узла (СССУ) – клинико-патогенетическое понятие, объединяющее ряд нарушений ритма, обусловленных снижением функциональной способности синусового узла. CCCУ является одной из причин развития жизнеопасных аритмий и внезапной смерти в молодом возрасте [1, 2]. Поскольку на начальных этапах нарушение функции синусового узла может протекать бессимптомно или малосимптомно, особое значение имеет раннее выявление данной сердечно-сосудистой патологии, которое позволит оптимизировать лечение и профилактику осложнений этого состояния.
В последнее время внимание врачей-клиницистов привлекает возможность персонифицированного подхода к лечению заболевания, основанного на генетических особенностях человека. Изучение структуры генетической предрасположенности к СССУ позволит идентифицировать лиц с высоким риском развития указанного синдрома и правильно подобрать лекарственную терапию с учетом индивидуальных особенностей пациента.
Генетическая детерминированность идиопатического СССУ подтверждена рядом исследований. И.С. Батьянов и соавт. описали семейный случай СССУ. В этой семье мать пробанда, его тетя, старший брат и племянник страдали приступами синкопе, сопровождавшимися паузами на ЭКГ при холтеровском мониторировании. Сам пробанд предъявлял жалобы на головную боль, головокружение, колющую боль в области сердца, приступы потери сознания, умеренное повышение артериального давления [3].
D.W. Benson и соавт. опубликовали результаты обследования 10 детей из 7 семей с диагностированным СССУ. Всем обследованным диагноз был поставлен в первое десятилетие жизни [4]. Е. Nof и соавт. обследовали 16 членов семьи с синусовой брадикардией, у 8 из которых была выявлена изолированная дисфункция синусового узла. Сегрегационный анализ установил аутосомно-доминантный тип наследования [5]. Генотипирование больных идиопатическим СССУ выявило наличие однонуклеотидных замен в некоторых генах; отсутствие таких замен в геноме здоровых лиц (или незначительная их частота) позволяет предполагать их предикторную роль в развитии СССУ.
К таким генам относят ген сердечного миозина (MYH6), гены сердечных натриевых (SCN5A) и калиевых каналов (HCN4) [4-6]. Кроме того, интерес может представлять ген эндотелиальной синтазы оксида азота (eNOS); в литературе имеются данные о роли этого гена в развитии брадиаритмий в детском возрасте, а также ишемической болезни сердца и эссенциальной артериальной гипертензии [7–9].
Учтя актуальность изучения генетических факторов в развитии СССУ, нами была изучена распространенность полиморфизма 4а/4b гена eNOS среди больных идиопатическим СССУ по сравнению с контрольной группой.
Материал и методы
Настоящее исследование было проспективным. Из базы данных кафедры внутренних болезней № 1 Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого были отобраны семьи с идиопатическим СССУ. В исследование были включены пробанды и их родственники I, II и III степеней родства. Всего были обследованы 90 человек с СССУ (33 мужчины и 57 женщин), из них 29 пробандов. Всем пробандам и их родственникам было проведено клинико-инструментальное кардиологическое обследование (клинический осмотр, электро-, эхокардиография, холтеровское мониторирование), а также молекулярно-генетическое исследование 4а/4b полиморфизма гена eNOS. Генотипирование проведено с помощью полимеразной цепной реакции в лаборатории молекулярно-генетических исследований терапевтических заболеваний ФГБУ НИИ терапии СО РАМН Новосибирска. При оценке частот генотипов и аллелей 4а/4b полиморфизма гена eNOS у больных СССУ и их родственников в качестве контроля использовали популяционную выборку здоровых жителей Новосибирска, состоявшую из 220 обследованных в рамках международного проекта ВОЗ MONICA (Мониторинг заболеваемости и смертности от сердечно-сосудистых заболеваний). Данные генотипирования были предоставлены НИИ терапии и профилактической медицины СО РАМН (Новосибирск) в рамках договора о научном сотрудничестве от 01.12.2008. В соответствии с Хельсинкской декларацией для проведения исследования было получено разрешение локального Этического комитета при Красноярском государственном медицинском университете им. проф. В.Ф. ВойноЯсенецкого, а также информированное согласие на проведение молекулярно-генетического исследования (Протокол № 1 от 22.06.2009).
Результаты
Результаты анализа 4a/4b полиморфизма гена NOS3 среди больных СССУ и в контрольной группе представлены в таблице.
Результаты исследования показали, что частота гомозиготного генотипа 4b/4b по редкому аллелю среди больных СССУ (31,1 ± 4,9 %) статистически значимо выше, чем в контрольной группе (3,2 ± 1,2 %; р < 0,001). Отмечено также статистически значимое снижение числа носителей гомозиготного генотипа по распространенному аллелю 4а среди больных СССУ (38,9 ± 5,1 %) по сравнению с группой контроля (71,4 ± 3,0 %; р < 0,001). Анализ частот аллелей гена NOS3 также позволил выявить различия среди больных СССУ по сравнению с группой контроля. Среди больных СССУ отмечено статистически значимое преобладание редкого аллеля 4b по сравнению с контрольной группой. Суммарное значение частот гетерозиготного (4a/4b) и гомозиготного (4b/4b) генотипов по редкому аллелю (носители других генотипов) было в 2 раза выше среди больных СССУ (61,1 ± 5,1 %) по сравнению с контрольной группой (28,6 ± 3,0 %).
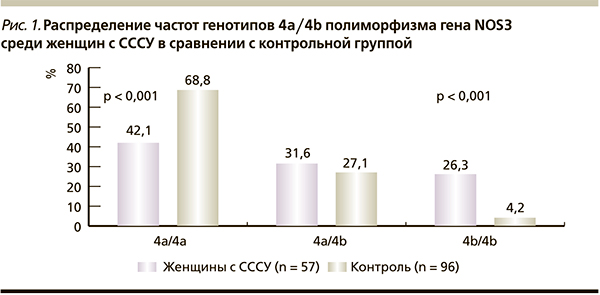
При анализе распределения частот генотипов и аллелей 4a/4b полиморфизма гена NOS3 среди женщин с СССУ были получены следующие результаты (рис. 1). Среди них в 3,8 раза чаще встречались носители редкого генотипа 4b/4b (26,7 ± 5,8 против 4,2 ± 2,0 % в группе контроля), но статистически значимо реже выявлялись носители распространенного генотипа 4а/4а (42,1 ± 6,5 против 68,8 ± 4,7 %).
Аллель 4b также был преобладающим среди женщин с СССУ (42,1 ± 4,6 против 17,7 ± 2,8 %; OШ = 3,846; 95 % ДИ – 2,451–6,024; p < 0,001). Суммарное значение частот гетерозиготного 4a/4b и гомозиготного 4b/4b генотипов по редкому аллелю у женщин с СССУ было значимо выше (57,9 ± 6,5 %), чем в группе контроля (31,3 ± 4,7 %; OШ = 3,021; 95 % ДИ – 1,531–5,988; p < 0,001).
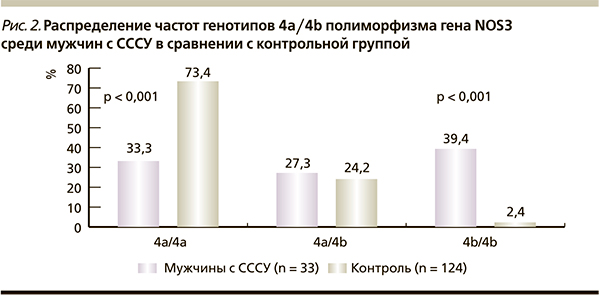
Среди мужчин с СССУ достоверно чаще встречались носители редкого генотипа 4b/4b (39,4 ± 8,5 против 2,4 ± 1,4 % в контрольной группе) и статистически значимо реже – носители распространенного генотипа 4а/4а (33,3 ± 8,2 против 73,4 ± 4,0 %; p < 0,001). Аллель 4b также был преобладающим среди мужчин с СССУ (53 ± 6,1 против 14,5 ± 2,2 %; OШ = 5,952; 95 % ДИ – 3,460–10,309; p < 0,001). Суммарное значение частот гетерозиготного (4a/4b) и гомозиготного (4b/4b) генотипов по редкому аллелю (носители других генотипов) было достоверно выше у мужчин с СССУ (66,7 ± 8,2 %) по сравнению с группой контроля (26,6 ± 4,0 %; OШ = 5,525; 95 % ДИ – 2,415–12,658; p < 0,001; рис. 2).
В подгруппе пробандов с СССУ в 4 раза чаще встречались носители редкого генотипа 4b/4b (27,6 ± 8,3 %) по сравнению с контрольной группой (3,2 ± 1,2 %), но достоверно реже выявлялись носители распространенного генотипа 4а/4а (41,4 ± 9,1 против 71,4 ± 3,0 %).
Аллель 4b также был преобладающим среди пробандов с СССУ (43,1 ± 6,5 против 15,9 ± 1,7 %; OШ = 4,0; 95 % ДИ – 2,242–7,143; p < 0,001). Суммарное значение частот гетерозиготного (4a/4b) и гомозиготного (4b/4b) генотипов по редкому аллелю (носители других генотипов) было статистически значимо выше у пробандов с СССУ (58,6 ± 9,1 %) по сравнению с группой контроля (28,6 ± 3,0 %; OШ = 3,533; 95 % ДИ – 1,595–7,812; p < 0,001).
Заключение
Таким образом, среди больных СССУ, как мужчин, так и женщин, статистически значимо преобладает гомозиготный генотип по более редкому аллелю 4b гена NOS3. Генотип 4a/4a гена NOS3 в данных группах больных является протективным в отношении развития данной патологии. Полученные на сибирской популяции результаты могут быть использованы в клинической практике для подбора рациональной фармакотерапии пациентам с генетической предрасположенностью к СССУ с целью профилактики развития указанной патологии. Так, этой группе пациентов при лечении сопутствующих заболеваний (например, артериальной гипертензии) противопоказаны лекарственные средства, ухудшающие сердечную проводимость: антагонисты кальция группы верапамила и дилтиазема, β-адреноблокаторы, ингибиторы f-каналов.


