За последние 10–15 лет были достигнуты определенные успехи в противовирусной терапии хронического гепатита В. Несмотря на это, лечение заболевания остается сложным и противоречивым. Нерешенными или спорными остаются такие вопросы, как: кого следует лечить, какими препаратами, как долго, как оценивать адекватность терапии, каковы критерии прекращения лечения [1] ?
Основная цель терапии – предотвратить прогрессирование заболевания в цирроз, декомпенсированный цирроз печени и развитие ГЦК (конечные стадии заболевания, являющиеся причинами инвалидизации и преждевременной смерти пациента). Большинству пациентов требуется длительный курс лечения, поскольку вирус гепатита В (ВГВ) обладает механизмами персистенции в инфицированном гепатоците. Неполное подавление вируса и непредсказуемая лекарственная резистентность имеют огромное значение. Правильный выбор первоначальной мощной терапии для достижения поддерживаемой длительной супрессии вирусной репликации позволяет предотвращать лекарственную устойчивость и повышать эффективность лечения [1, 2].
В настоящее время в большинстве мировых руководств критериями отбора пациентов, нуждающихся в противовирусной терапии, являются [1–3]:
Уровень аланинаминотрансферазы (АЛТ) выше верхней границы нормы.
Уровень ДНК ВГВ более чем 2000 МЕ/мл.
Активный некровоспалительный процесс в печени и/или фиброз (F2–F4) по данным гистологического исследования.
Нет противопоказаний к проведению лечения.
Безусловно к этим критериям нельзя относиться, как к “закону”. Так, у ряда пациентов уровень АЛТ может быть в норме, а уровень аспартатаминотрансферазы – повышенным. Следует учитывать, что границы нормы могут варьироваться (от 30 до 77 ЕД/л). Уровень вирусной нагрузки также может отличаться в разные временные точки у одного и того же пациента. Порог в 2000 МЕ/мл мало чем отличается от 1000 МЕ/мл. В связи с этим многие специалисты предложили считать уровень вирусной нагрузки, при которой необходимо лечение, по логарифмической шкале. Таким образом, 10 в третьей степени будет являться показанием к терапии. Это особенно актуально для HBeAg- (Hepatitis B e antigen)-негативных пациентов. В сложных и спорных случаях окончательное решение помогает принять биопсия печени, способная оценивать активность заболевания и степень фиброза. Гистологическое исследование перед противовирусной терапией оказывает неоценимую помощь врачу и пациенту, позволяя оценить необходимость проведения лечения. Пациентам с компенсированным циррозом печени и определяемой ДНК ВГВ необходимо назначать терапию даже при нормальном уровне АЛТ [2]. Пациентам с декомпенсированным циррозом печени показано незамедлительное начало терапии в условиях стационара аналогами нуклеози(ти)дов с высокой противовирусной активностью и высоким порогом резистентности (энтекавир, тенофовир). Тем не менее антивирусная терапия может быть недостаточной для спасения некоторых пациентов с крайне продвинутой стадией заболевания печени, им должно быть рекомендовано выполнение трансплантации печени [1].
В настоящее время в мире с целью лечения хронического гепатита В (ХГВ) применяется пять нуклеозидных аналогов: ламивудин (1998), адефовир (2002), энтекавир (2005), телбивудин (2006) и тенофовир (2008), которые относятся к трем классам соединений. L-нуклеозиды (ламивудин и телбивудин) обладают хорошим профилем безопасности и переносимости, но в то же время они имеют весьма значимый недостаток, а именно быстрое и стойкое формирование противовирусной устойчивости. Ациклические нуклеотидные фосфонаты (адефовир и тенофовир) имеют относительно низкие показатели формирования противовирусной резистентности, но обладают потенциальной нефротоксичностью. Энтекавир – препарат с хорошей переносимостью и низкой степенью формирования резистентности (у пациентов, не получавших L-нуклеозиды до лечения энтекавиром). Приблизительное распределение препаратов по мощности подавления ДНК ВГВ в течение 48 недель можно представить следующим образом: адефовир < ламивудин < телбивудин << тенофовир ≈ энтекавир. С учетом вышеизложенного препаратами первого выбора является тенофовир или энтекавир; другие аналоги можно использовать в особых ситуациях (см. таблицу) [2]. Следует учитывать также стоимость терапии [2, 4–10].
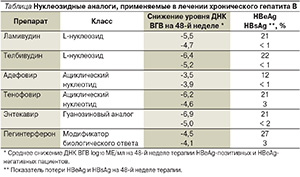 Пегилированный интерферон одобрен в качестве лечения ХГВ, однако его место в терапии остается неясным. Показатели ответа на годичный курс терапии пегинтерфероном выше по сравнению с нуклеозидными аналогами, однако в целом ответ по-прежднему неудовлетворительный. Важно отметить, что в России большинство пациентов имеют генотип D ВГВ [11], а эффективность лечения интерферонами у пациентов с данным генотипом крайне низкая [12]. Эффективность терапии нуклеозидными аналогами в течение длительного периода оказывается гораздо более успешной, чем годичный курс терапии пегинтерфероном, который вызывает много побочных эффектов и весьма дорог. Пегинтерферон может быть оптимальным выбором лечения для определенной категории пациентов: молодой возраст, высокий уровень АЛТ в сыворотке крови, генотип А ВГВ. В случае неэффективности такой терапии в дальнейшем следует назначать нуклеозидные аналоги. Кроме того, необходимо учитывать результаты лечения пегинтерфероном HBeAg-позитивных пациентов, у которых, согласно данным клинических исследований, существует возможность сероконверсии с выработкой антител к HBeAg [1].
Пегилированный интерферон одобрен в качестве лечения ХГВ, однако его место в терапии остается неясным. Показатели ответа на годичный курс терапии пегинтерфероном выше по сравнению с нуклеозидными аналогами, однако в целом ответ по-прежднему неудовлетворительный. Важно отметить, что в России большинство пациентов имеют генотип D ВГВ [11], а эффективность лечения интерферонами у пациентов с данным генотипом крайне низкая [12]. Эффективность терапии нуклеозидными аналогами в течение длительного периода оказывается гораздо более успешной, чем годичный курс терапии пегинтерфероном, который вызывает много побочных эффектов и весьма дорог. Пегинтерферон может быть оптимальным выбором лечения для определенной категории пациентов: молодой возраст, высокий уровень АЛТ в сыворотке крови, генотип А ВГВ. В случае неэффективности такой терапии в дальнейшем следует назначать нуклеозидные аналоги. Кроме того, необходимо учитывать результаты лечения пегинтерфероном HBeAg-позитивных пациентов, у которых, согласно данным клинических исследований, существует возможность сероконверсии с выработкой антител к HBeAg [1].
Проблема резистентности
Клинические исследования продемонстрировали, что препараты с высоким барьером устойчивости, такие как энтекавир и тенофовир, имеют значительно более низкие показатели резистентности по сравнению с препаратами с низким барьером устойчивости, такими как ламивудин, адефовир или телбивудин. Вирусный прорыв у пациентов, приверженных лечению, чаще всего связан с вирусной резистентностью; резистентность – с предшествующим лечением нуклеозидными аналогами или с лечением пациентов с высоким уровнем ДНК ВГВ, медленным снижением уровня ДНК или частичным вирусным ответом на лечение. Резистентность следует выявлять как можно раньше – до увеличения уровня АЛТ путем наблюдения за уровнем ДНК ВГВ. В настоящее время основным принципом ведения пациентов при возникновении устойчивости к препарату является назначение второго препарата, не имеющего перекрестной резистентности с первым, т. е. L-нуклеозиды (ламивудин и телбивудин) vs ациклические фосфонаты (адефовир и тенофовир), vs D-циклопентан (энтекавир) [13, 14]. Остается неясной тактика ведения пациентов, которым проведена последовательная монотерапия несколькими нуклеозидными аналогами.
Наибольшее обсуждение в литературе вызывает вопрос о сроках лечения ХГВ. В большинстве клинических исследований терапия нуклеозидными аналогами продолжается в течение 1–2 лет, затем прекращается. Конечная точка – потеря HBeAg или длительное подавление репликации ДНК ВГВ с нормализацией уровня печеночных ферментов и уменьшением гистологической активности. Подобные цели достигаются лишь 12–24 % пациентов, получающих лечение в течение года. Кроме того, прекращение терапии нуклеозидными аналогами может сопровождаться обострением гепатита, когда уровень вирусной нагрузки вновь повышается до исходного. Обострение может быть симптоматическим и очень тяжелым.
В литературе были описаны случаи смертельных исходов и экстренной трансплантации печени у пациентов после прекращения годового курса лечения. Таким образом, необходимо осуществлять регулярное наблюдение за пациентами, у которых терапия нуклеозидными аналогами была преждевременно прекращена, особенно в случаях краткосрочного лечения. В противном случае такое лечение может нанести больному больше вреда, чем пользы [1, 2].
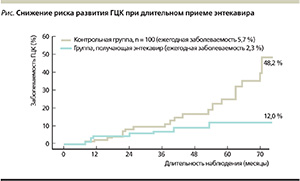
С другой стороны, длительный курс нуклеозидными аналогами сопровождается подавлением ДНК ВГВ, снижением уровня аминотрансфераз, улучшением показателей гистологической активности. В недавно опубликованных исследованиях эффективности энтекавира доказано, что длительная терапия способствует обратному развитию фиброза печени. У пациентов с уже развившимся циррозом прием нуклеозидных аналогов приводит к замедлению прогрессирования цирроза, а также способствует его обратному развитию [15]. Однако лечение данных пациентов должно быть практически пожизненным, без перерыва, чтобы избежать риска развития рецидива заболевания. Высокий уровень ДНК ВГВ и наличие цирроза являются факторами риска развития ГЦК [16]. Длительное непрерывное лечение будет подавлять репликацию вируса и, следовательно, снижать риск развития ГЦК (рисунок) [17], однако у пациентов с циррозом он все равно будет оставаться достаточно высоким [16]. Обычно нуклеозидные/нуклеотидные аналоги хорошо переносятся, а их побочные эффекты минимальны. В большинстве исследований побочные эффекты при применении энтекавира сравнимы с терапией плацебо [18].
Таким образом, продолжительность терапии нуклеозидными аналогами гепатита В – неопределенно долгая и его фиксация возможна только по достижении специфической точки, такой как потеря HBeAg или HBsAg. Этот период может составить несколько лет или десятилетий. Следует иметь в виду, что потеря HBeAg при терапии нуклеозидными аналогами менее стойкая, чем при терапии интерфероном [4]. Этот вопрос еще более сложен при лечении HBeAg-негативных форм ХГВ, рецидив которых часто возникает после прекращения терапии, иногда спустя нескольких месяцев и даже лет. Тем не менее в некоторых исследованиях допускается прекращение лечения пациентов с HBeAg-негативным вариантом ХГВ нуклеозидными аналогами с рецидивом спустя несколько лет, в течение которых ДНК ВГВ не определялась [7, 8].
Другая конечная точка терапии нуклеозидными аналогами – это потеря HBsAg. Это очень хороший результат терапии, после которого крайне редко возникает рецидив. Трудность заключается в следующем: исчезновения HBsAg может не наблюдаться в течение нескольких лет терапии ХГВ (особенно у HBeAg негативных пациентов) [2]. Это приводит к неопределенно долгой терапии с вполне определенной достаточно высокой стоимостью такого лечения. Кроме того, необходимо быть уверенными, что такой длительный курс терапии безопасен для пациента.
Безопасность длительной терапии
В настоящее время считается, что терапия ламивудином ВИЧ-позитивных пациентов и пациентов с ХГВ безопасна. Основные побочные эффекты терапии ламивудином – развитие резистентности и клиническое обострение. Это долгосрочное осложнение возникает очень часто, в связи с чем не рекомендуется длительное использование ламивудина в качестве монотерапии ХГВ [6, 18].
 Безопасность длительной терапии ациклическими нуклеотидными аналогами – адефовиром и тенофовиром – изучена частично. Важное и потенциально тяжелое осложнение от этих препаратов – развитие почечной недостаточности и почечного канальцевого ацидоза (Фанкони подобный синдром) в результате повреждения дистальных изогнутых трубочек с потерей способности к реабсорбции фосфатов, аминокислот, белка и глюкозы. Этот синдром редко встречается в первые два года терапии, но частота его увеличивается при длительном применении, особенно пожилыми пациентами и/или лицами с сопутствующим почечным заболеванием. Клинические проявления могут быть неяркими и весьма разнообразными: от минимального увеличения сывороточного креатинина до острой почечной недостаточности, от асимптоматической протеинурии или почечной глюкозурии до гипофосфатемии, почечного канальцевого ацидоза и тяжелой миастении. У некоторых пациентов развивается остеопороз и образуются патологические переломы костей. Хотя и не часто, но эти побочные эффекты могут быть тяжелыми. Таким образом, во время терапии адефовиром и тенофовиром требуется регулярный контроль уровня сывороточного креатинина и фосфатов, а также выполнение общего анализа мочи [18–21]. Итак, самый высокий профиль безопасности имеет препарат энтекавир.
Безопасность длительной терапии ациклическими нуклеотидными аналогами – адефовиром и тенофовиром – изучена частично. Важное и потенциально тяжелое осложнение от этих препаратов – развитие почечной недостаточности и почечного канальцевого ацидоза (Фанкони подобный синдром) в результате повреждения дистальных изогнутых трубочек с потерей способности к реабсорбции фосфатов, аминокислот, белка и глюкозы. Этот синдром редко встречается в первые два года терапии, но частота его увеличивается при длительном применении, особенно пожилыми пациентами и/или лицами с сопутствующим почечным заболеванием. Клинические проявления могут быть неяркими и весьма разнообразными: от минимального увеличения сывороточного креатинина до острой почечной недостаточности, от асимптоматической протеинурии или почечной глюкозурии до гипофосфатемии, почечного канальцевого ацидоза и тяжелой миастении. У некоторых пациентов развивается остеопороз и образуются патологические переломы костей. Хотя и не часто, но эти побочные эффекты могут быть тяжелыми. Таким образом, во время терапии адефовиром и тенофовиром требуется регулярный контроль уровня сывороточного креатинина и фосфатов, а также выполнение общего анализа мочи [18–21]. Итак, самый высокий профиль безопасности имеет препарат энтекавир.
Другие нуклеозидные аналоги (фиалуридин, диданозин, ставудин, зидовудин) вызывают острую жировую дистрофию и молочно-кислый ацидоз. Патогенез этих синдромов связан с повреждением митохондрий, т. к. эти нуклеозидные аналоги способны встраиваться в митохондриальную ДНК. Однако эти препараты в лечении ХГВ не используются [2].
Нерешенные вопросы
Наконец нерешенным остается еще ряд вопросов. Может ли быть прекращена терапия нуклеозидными аналогами после нескольких лет терапии и безопасно ли это для пациента? Какие критерии или маркеры показывают, что терапия может быть остановлена без риска рецидива? Длительное подавление ДНК ВГВ и даже потеря HBeAg и сероконверсия в anti-HBe не всегда гарантируют отсутствие рецидива после остановки терапии. Однако потеря HBsAg (с или без образования anti-HBs), по всей видимости, является надежным маркером со стойким ответом на терапию после ее прекращения [1–3].
Следует учитывать, что ВГВ ДНК-содержащий вирус может персистировать после “выздоровления” и потери HBsAg, даже образования anti-HBs. Химиотерапия в случае онкологических заболеваний или развития иммунодефицитного состояния может приводить к реактивации гепатита В с развитием тяжелого фульминантного гепатита или к хроническому гепатиту В с последующим формированием цирроза печени. Если планируется проведение химиотерапии или трансплантация костного мозга противовирусную терапию гепатита В, следует возобновить [2].


