Введение
Разработка новых лекарственных препаратов и терапевтических стратегий лечения инсульта является одним из важнейших направлений современной медицины [16]. Это обусловлено высокой смертностью и инвалидизацией, которыми характеризуется инсульт. В России, где смертность от инсульта вышла на первое место в мире [1, 11, 24], данная проблема особенно актуальна.
Внутривенный тромболизис рекомбинантным тканевым активатором плазминогена, начатый не позже чем через 3 часа после возникновения симптомов, является единственным методом реперфузионного лечения при остром ишемическом инсульте (ИИ) с доказанной эффективностью. Однако узкое “терапевтическое окно” (около 3 часов) и потенциально возможные геморрагические осложнения ограничивают применение данного метода терапии: только около 3 % пациентов с инсультом получают активатор плазминогена. Остальные 97 % не получают специфической терапии, что требует совершенствования существующих методов лечения и поиска новых. В связи с этим в настоящее время все больше внимания уделяется разработке новых препаратов с нейропротективным эффектом [17, 26]. Развитие нейропротективного направления лечения представляется крайне перспективным. Основной идеей нейропротекции является сохранение мозговой ткани до момента восстановления кровотока самостоятельно, в результате медикаментозного воздействия или за счет коллатерального кровотока [21]. Раннее применение нейропротективной терапии позволяет значительно уменьшать размеры инфаркта мозга, удлинять период “терапевтического окна”, защищать нейроны от реперфузионного повреждения и увеличивать долю благоприятных исходов острого нарушения мозгового кровообращения по ишемическому типу [12]. До настоящего времени клинические исследования нейропротективных препаратов, влияющих на какойлибо один из установленных патологических этапов, оказались безуспешными, несмотря на обнадеживающие результаты в разнообразных моделях инсульта [22, 23]. В связи с этим успех терапии инсульта, возможно, будет
достигнут при использовании мультифункциональных препаратов или комбинированной терапии, направленных на прерывание нескольких патофизиологических механизмов [26].
Внезапное снижение регионарного кровотока при ИИ ответственно за функциональный дефицит и запускает каскад патофизиологических механизмов, приводящих к повреждению ткани, в частности, мембран. Несмотря на ряд сложностей, на моделях животных и человеку был установлен один из механизмов повреждения мембран клеток – окисление липидов и протеинов, ускорение этих процессов в условиях ишемии и реперфузии [28]. В ГУ НИИ фармакологии РАМН была разработана субстанция сукцинат-2-этил6-метил-3-оксипиридина, способная влиять на процессы окислительного стресса в условиях ишемии [4]. Производные 3-оксипиридина (3-ОП) относятся к простейшим гетероциклическим аналогам ароматических фенолов и в связи с этим проявляют антиоксидантные и антирадикальные свойства. На основе 3-ОП разработан и внедрен в клиническую практику ряд лекарственных препаратов, в частности этилметилгидроксипиридина сукцинат (ЭМГП-С; Нейрокс®).
Основной эффект препарата реализуется через участие в свободнорадикальном окислении липидов мембран, а именно в его ингибировании; повышение активности суперокиддисмутазы и других антиоксидантных ферментов; участие в цикле Кребса, что и обусловливает противогипоксическое
действие препарата [9].
Эффективность ЭМГП-С в лечении больных ИИ оценивалась в ряде клинических работ, в частности в рандомизированном двойном слепом плацебо-контролируемом исследовании пациентов (n = 51) с ИИ в возрасте 45–85 лет. В исследовании оценивалась динамика неврологической симптоматики по шкале NIH и функциональное восстановление, оцененное по шкале Bartel. Результатом исследования стала достоверная положительная динамика неврологических нарушений к 14-му дню лечения ЭМГП-С
по сравнению с группой плацебо, а также достоверное функциональное восстановление к 21-му дню лечения (в случае начала терапии в первые 6 часов заболевания) [13]. Уменьшение неврологического дефицита на фоне применения ЭМГП-С в составе стандартной терапии позволило достичь фармакоэкономического эффекта, заключавшегося в сокращении сроков госпитализации и повышении качества жизни больных [14].
Еще одним перспективным направлением нейропротекции является воздействие на холиновый обмен в ЦНС за счет как препаратов-донаторов (при поступлении которых увеличивается содержание холина), так и препаратов, обладающих антихолинэстеразным действием [7, 20].
При проведении магнитно-резонансной спектроскопии в остром периоде инсульта в отличие от хро-
нической ишемии головного мозга выявлено изменение концентрации холина и креатинина. Если при хронической недостаточности мозгового кровообращения изменения концентрации вышеуказанных биологически активных веществ не столь выражены, то в остром периоде инсульта у пациентов достоверно снижаются их концентрации. Восстановление уровня холина происходит ко второй неделе, в то время как сниженный уровень креатинина сохраняется на протяжении 3 месяцев от момента развития инсульта [25, 27, 29].
Препараты, содержащие глицерилфосфорилхолин, восполняют уровень холина в нейронах. Глицерил-
фосфорилхолин содержит 40 % холина и трансформируется в организме в активный метаболит фосфорилхолин, проникающий через гематоэнцефалический барьер и активирующий биосинтез ацетилхолина в пресинаптических мембранах холинергических нейронов. Ранее в остром периоде ИИ
проводились пилотные исследования, которые показали положительное влияние больших доз холина альфосцерата (ХАФ; внутривенное введение в течение 5 дней в дозе 3–4 г в сутки) на клиническую динамику симптомов поражения ЦНС с преимущественным улучшением психической деятельности пациента, памяти и речевых функций [2, 10]. В частности, было показано, что применение ХАФ (Церетона®) в дозе 3000 мг/сут на протяжении первых 6 дней от момента поступления в стационар и по 1000 мг в течение последующих 10 дней у больных ИИ приводит к уменьшению очаговой неврологической симптоматики и когнитивных нарушений после инсульта. У пациентов, получавших ХАФ, отмечена меньшая степень выраженности нарушения жизнедеятельности через 3 месяца наблюдения. Показана хорошая переносимость препарата [15].
Эффективность комбинации ХАФ и ЭМГП-С оценивалась в сравнительном исследовании больных в остром периоде тяжелого ИИ. В основную группу вошли 59 пациентов, получавших комбинацию вышеуказанных препаратов на фоне базовой терапии;контрольную группу составили 53 больных, получавших только базовую терапию. На 10-й день лечения смертность в основной и контрольной группах составила 27 и 42 % соответственно, а частота благоприятных исходов – 73 и 58 %. Был отмечен хороший профиль переносимости комбинированной терапии, которая не вызывала значимых побочных реакций [10].
Представлены результаты исследования по оценке лечебного эффекта комбинированной 14-дневной терапии, включившей холина альфосцерат (Церетон) и этилметилгидроксипиридина сукцинат (Нейрокс), пациентов с ИИ легкого и среднетяжелого течения при следующем режиме дозирования:
Церетон – 1000 мг/сут, Нейрокс – 250 мг/сут.
Материал и методы
Проведено открытое активно контролируемое исследование по оценке клинической эффективности и безопасности комплексной терапии ХАВ и ЭМГП-С в качестве дополнения к стандартной терапии пациентов с ИИ в остром периоде по сравнению с базовой терапией.
Применялся следующий режим дозирования: препараты вводились в утренние часы последовательно – ЭМГП-С (Нейрокс) 250 мг/5,0 мл внутривенно, капельно на 250 мл физиологического раствора, затем ХАФ 1000 мг/сут внутривенно, болюсно, медленно. Длительность лечения – 14 дней, период наблюдения – 30 дней.
Критерии включения:
• впервые диагностированный ИИ;
• повторный ИИ, развившийся в ином, чем первый инсульт, сосудистом бассейне;
• возраст пациентов не менее 60 и не старше 85 лет;
• внезапное развитие очаговых симптомов, свойственных поражению бассейнов кровоснабжения сонных и вертебрально-базилярных артерий, возникшее в сроки до суток длительностью более 24 часов;
• показатель по шкале NIHSS более 5 баллов;
• показатель по шкале Рэнкина 0–1 балл на момент развития инсульта;
• отсутствие заболеваний, на счет которых может быть отнесено клиническое ухудшение состояния
больного и появление неврологической симптоматики.
Критерии исключения:
• непереносимость компонентов исследуемых препаратов и состояния, при которых применение
этих препаратов, что определялось инструкцией по их применению;
• уровень нарушения сознания по шкале Glasgow менее 7 баллов;
• использование препаратов, аналогичных изучаемым по действию на догоспитальном этапе оказания
помощи;
• отказ пациента от участия в исследовании (в любое время и по любой причине);
• наличие на момент рандомизации сопутствующих тяжелых или нестабильных соматических заболеваний (сепсис, почечная, печеночная или сердечная недостаточность в стадии декомпенсации), которые могли привести к досрочному прекращению участия пациента в исследовании;
• наличие других клинически значимых неврологических или психических нарушений (в частности,
деменции);
• наличие риска прерывания участия пациента в исследовании по любой причине до окончания наблюдения, по мнению врача.
Характеристика больных
В исследование были включены 49 пациентов, в т. ч. 16 с нарушением сознания. Завершили участие в исследовании 44 пациента, 5 больных были исключены в связи с диагностированием в ходе лечения сопутствующего онкологического процесса и отказом от участия в исследовании. Пациенты были разделены на две группы: основную составили 24 больных, контрольную – 20. В исследовании участвовали пациенты с повторным инсультом: в основной – 5 больных, в контрольной – 3. Исследуемые группы были сопоставимыми по полу, возрасту и тяжести течения заболевания. Частыми
сопутствующими заболеваниями были гипертоническая болезнь (100 % больных), нарушения ритма сердца и сахарный диабет. Большую долю составили пациенты с атеротромботическим генезом инсульта и микроангиопатией. Достоверных различий в основных характеристиках больных между группами выявлено не было (табл. 1).
Таблица 1. Основные характеристики больных.
Диагноз и генез ИИ установлены на основе анализа анамнестических данных, соматического и неврологического статуса, а также инструментального и лабораторного обследований. Подтип инсульта определен с помощью критериев TOAST [18]. Неврологический статус оценен с
помощью шкалы National Institutes of Health Stroke Scale (NIHSS) неврологами, прошедшими сертификацию, при поступлении, на 1-й, 6-й, 10-й, 14-й, 21-й и 30-й дни наблюдения. Для оценки степени нарушения сознания при поступлении использовалась шкала комы Glasgow. Для оценки повседневной жизненной активности применена шкала Bartel, данный параметр оценен до поступления (данные были собраны ретроспективно), а также в течение периода наблюдения на 6-й, 14-й, 21-й и 30–й дни.
Для формирования сопоставимых и однородных по исходным данным групп больных отбор пациентов в
исследование и их распределение по группам проведены методом послойной рандомизации. Основными факторами разделения на слои стали нарушение сознания, балл по шкале NIHSS, равный 9 для больных, поступивших в сознании. Распределение больных в каждом слое происходило с помощью блочной рандомизации. Базовая/стандартная терапия основывалась на национальных стандартах РФ (Протокол ведения больных “Инсульт”) и стандартах медицинской помощи пациентам с инсультом 2007 г. Во время наблюдения запрещалось применять препараты, механизмы действия которых были сходными с таковыми исследуемых лекарственных средств. От всех пациентов или их родственников было получено согласие на участие в клиническом исследовании и использование закодированных
персональных данных при обработке результатов исследования.
Для оценки клинических результатов были сформулированы критерии эффективности: доли пациентов, отнесенных к категории “с клиническим улучшением” на 30-й день наблюдения. Статус ответа интерпретировался следующим образом: доля пациентов с баллами по шкале NIHSS, равными 0–2, или регрессом суммы баллов более чем на 35 %; доля пациентов с баллами по шкале Bartel, равными 85–100, или регрессом суммы баллов более чем на 30 % по сравнению с показателем, оцененным ретроспективно со слов родственников или больного на момент поступления.
Для статистического анализа подсчитывались средние значения и стандартное отклонение. Сравнение проведено с использованием параметрического t-критерия Стьюдента, критерия Хи-квадрат для анализа таблицы сопряженности, непараметрического U-критерия Манна–Уитни. Различия считались достоверными при р < 0,05. Обработка данных проведена с помощью программных пакетов статистического анализа Биостат и STATISTICA 6.0.
Таблица 2. Динамика средних значений по шкалам Glasgow, NIHSS и Bartel у больных в контрольной и основных группах, баллы.
Результаты
Анализ полученных результатов позволяет охарактеризовать состояние участвовавших в исследовании больных при поступлении как среднетяжелое. На фоне терапии отмечена положительная динамика с точки зрения восстановления сознания, регресса очаговых неврологических симптомов как в основной, так и в контрольной группах. Динамика состояния больных на протяжении исследования отражена в табл. 2. Отмечена достоверно быстрая нормализация уровня сознания к 96 часам от момента поступления в стационар. Анализ динамики регресса неврологической симптоматики, оцененной по шкале NIHSS, показал положительную тенденцию к восстановлению в основной группе
к концу наблюдения (на 30-й день). Достоверные различия были установлены при оценке ответа на комбинированную терапию с учетом долей пациентов, у которых к моменту наблюдения балл регрессировал более чем на 35 % (рис. 1).
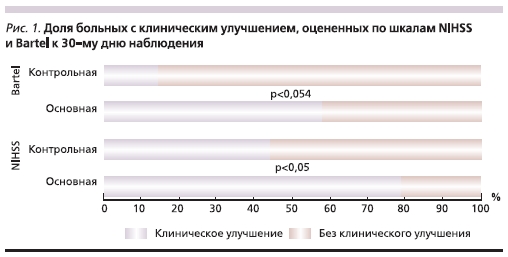
С целью выявления факторов, влияющих на положительную динамику неврологической симптоматики, в основной группе был проведен сравнительный анализ в подгруппах в зависимости от тяжести неврологического дефицита и генеза ИИ. Установлено, что наиболее отчетливая, достоверная положительная динамика наблюдалась среди пациентов с ИИ, развившимся в результате атеротромбоза и микроангиопатии. Графически данные о динамике неврологической симптоматики
в указанных подгруппах представлены на рис. 2 и 3.
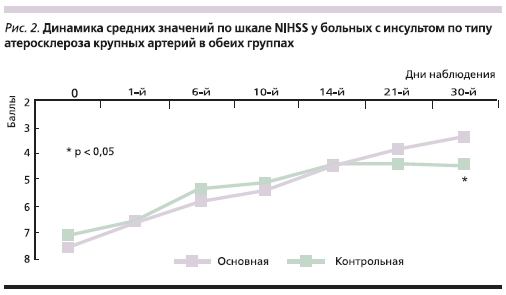
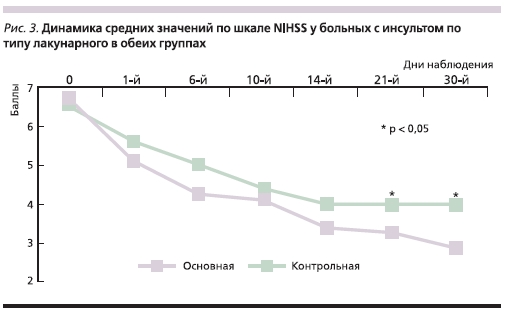
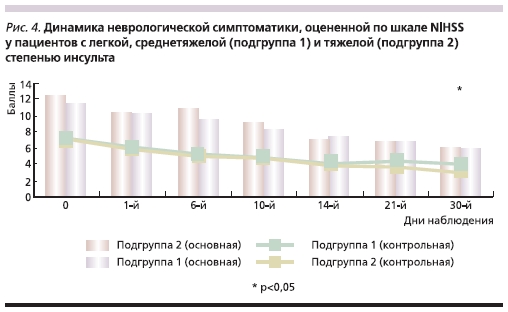
Анализ результатов лечения в зависимости от тяжести неврологического дефицита показал достоверную динамику у пациентов с легкой и средней степенью тяжести ИИ. Критерием
тяжести инсульта была степень неврологического дефицита (итоговая сумма баллов по шкале NIHSS: до 6–9 баллов – легкий и средний, более 9 –тяжелый). Результаты представлены на рис. 4.
Согласно шкале Bartel, оценка уровня повседневной активности показала положительную тенденцию, которая практически достигла уровня достоверности (р = 0,054) в группе пациентов, получавших комбинированную терапию, включившую ХАФ и ЭМГП-С (рис. 1).
Обсуждение результатов
Основным посылом к проведению данного клинического исследования стали результаты ранее выполненных работ по применению ХАВ и ЭМГП-С в лечении больных ИИ. В этих исследованиях было показано положительное влияние ХАВ на динамику общеклинической и неврологической симптоматики. В частности, выявлен “пробуждающий” эффект препарата, а также было установлено более быстрое восстановление двигательной и речевой активности на фоне улучшения психической деятельности пациентов, перенесших ИИ [2, 3, 15]. Кроме того, показано достоверное позитивное
влияние ЭМГП-С на функциональное восстановление к 21-му дню лечения в случае начала терапии в первые 6 часов заболевания [13]. Сочетанное применение двух препаратов позволило снизить смертность к 10-му дню лечения пациентов с тяжелым ИИ. При этом в большинстве случаев отмечены хорошие переносимость и безопасность данных препаратов [10].
Все указанные исследования позволяют предположить возможное наличие клинической синергии при
лечении комбинацией данных препаратов.
В связи с этим основной целью нашего клинического исследовния стал анализ клинического ответа пациентов с ИИ при назначении комбинации ХАВ и ЭМГП-С, а также выявление особенностей клинико-неврологической динамики в зависимости от генеза инсульта.
Анализ клинических данных указывает на положительный эффект больших доз ХАВ и ЭМГП-С, чем это рекомендуется производителем препаратов [5, 6]. Однако мы выбрали именно дозы, рекомендованные производителем, т. к. в большинстве лечебных учреждений придерживаются схем дозирования, указанных в инструкции по применению лекарственного средства, нежели следуют данным научной литературы. Поскольку основное лечение ИИ проходит в палатах с интенсивным наблюдением и целью исследования является оценка клинического эффекта в краткосрочном периоде, время исследования было ограничено 30 днями, т. е. тем сроком, когда закончен острый период инсульта и большинство больных выписываются из неврологического отделения больницы. Поэтому в нашем клиническом исследовании не оценивались отдаленные результаты комбинированной терапии. В исследование преимущественно включались пациенты с легким или среднетяжелым течением инсульта, т. к. из него изначально исключались больные, которые, по мнению врача, имели высокие шансы на выбывание из анализа по тем или иным причинам (главным образом из-за смерти).
Анализ изменений общемозговой симптоматики, оцененной по шкале Glasgow, показал достоверно более быструю динамку восстановления уровня сознания у пациентов основной группы к 96-му часу наблюдения. Ранее было продемонстрировано достоверно более быстрое восстановление уровня
сознания под влиянием ХАФ, описанное как “эффект пробуждения”, однако в этих исследованиях использовались более высокие дозы препарата (до 3000–4000 мг/сут) в течение первых суток [2, 3, 15]. В нашем исследовании с учетом низких доз ХАФ возможным объяснением быстрого восстановления сознания является комбинированный эффект двух препаратов, который дает эффект синергии. Речь
идет о способности ХАФ усиливать мозговой кровоток, что потенцирует действие препаратов, используемых для терапевтической реперфузии (особенно в случаях введения препарата в рамках “терапевтического окна”), а также о противогипоксическом действии ЭМГП-С, которое опосредуется специфическим влиянием данной субстанции на энергетический обмен с участием в цикле Кребса [9].
Установлено, что у пациентов, входивших в основную группу, присутствовал быстрый регресс очаговой
симптоматики по шкале NIHSS и меньший неврологический дефект к концу наблюдения независимо от генеза инсульта. С учетом использованных в исследовании критериев клинической эффективности можно сделать вывод о достоверном влиянии комбинированной терапии на восстановление неврологической симптоматики к 30-му дню наблюдения. Анализ данных в зависимости от генеза и тяжести инсульта показал, что этот результат в наибольшей степени зависел от положительной динамики неврологических симптомов у пациентов с ИИ, обусловленным атеросклерозом крупных артерий и микроангиопатией. Полученные данные могут быть объяснены преимущественным влиянием ХАФ, одним из механизмов терапевтического действия которого является донация холина, необходимого для образования медиатора ацетилхолина в пресинаптических мембранах холинергических нейронов [8]. Немаловажен и тот факт, что в развитии когнитивных нарушений у лиц пожилого и старческого возраста серьезную роль играет холинергический дефицит [19]. Поэтому
пролонгированный 14-дневный курс внутривенного введения ХАФ позволил отчасти компенсировать дефицит холина в ЦНС и улучшить общий мнестико-интеллектуальный фон больных основной группы, тем самым повысив функциональный резерв. Клинически это было более значимым для больных с легким и среднетяжелым неврологическим дефицитом, чем для пациентов с тяжелым инсультом,
который преимущественно имел тромбоэмболический генез.
Последнее подтверждается и более высокой оценкой повседневной жизненной активности по шкале Bartel у пациентов основной группы. Положительная динамика к концу лечения обусловлена лучшей адаптацией больных в реабилитационных или домашних условиях в результате изначально меньшего неврологического дефекта по окончании острого периода. Однако, исходя из критериев клинического улучшения, к 30-му дню наблюдения не было достигнуто достоверного улучшения повседневной
активности по шкале Bartel. В более ранних исследованиях было выявлено значимое влияние ЭМГП-С на восстановление повседневной активности при условии начала терапии в течение первых 6 часов. В нашем исследовании терапия начиналась примерно через 6,5 часов от начала появления первых
симптомов, что, возможно, оказало влияние на полученный результат приограниченном сроке наблюдения.
Следует отметить, что в нашемнаблюдении не было зарегистрировано нежелательных явлений и аллергических реакций, непосредственно связанных с используемыми препаратами или режимом их дозирования.
Таким образом, полученные результаты свидетельствуют о клинической эффективности и хорошей переносимости комбинированной терапии ХАФ (Церетон) в дозе 1000 мг и ЭМГП-С (Нейрокс) в дозе 250 мг в течение 14 дней пациентами с легким и среднетяжелым ИИ при наблюдении в течение 30 дней. Показано достоверное позитивное влияние комбинированной терапии на степень восстановления неврологической симптоматики к 30-му дню наблюдения. Итак, достоверный регресс неврологического дефицита отмечен среди пациентов, перенесших лакунарный инсульт и ИИ, связанный с атеросклерозом крупных артерий. В меньшей степени комбинированная терапия оказала
влияние на восстановление повседневной активности к 30-му дню наблюдения, не достигнув степени достоверности, однако выявленная положительная тенденция позволяет прогнозировать получение лучших результатов на фоне мероприятий в раннем реабилитационном периоде.
Необходимы дополнительные исследования клинической эффективности и влияния комбинированной
терапии, возможно в более высоких дозах, на отдаленные результаты, в частности, у пациентов с тяжелым инсультом, с точки зрения восстановления повседневной активности.
Исследование выполнено при поддержке компании “Сотекс”, Россия


