Введение
Системные васкулиты (СВ) представляют собой гетерогенные заболевания, которые характеризуются воспалительным поражением сосудов с полиморфизмом клинических проявлений [1]. В качестве классификационных критериев первоначально были выбраны калибр пораженных сосудов и наличие или отсутствие гранулематозного воспаления, в настоящее время к ним добаились данные об антинейтрофильных цитоплазматических антителах [2]. Эти заболевания отличаются склонностью к прогрессированию, особенно в условиях поздней диагностики и неадекватной терапии.
В обширный перечень типичных клинических проявлений СВ включается и поражение сердца, причем его проявления также весьма многообразны, существенно различаясь по клинико-морфологическим признакам и прогнозу, что определяется нозологической неоднородностью васкулитов.
В монографии “Коллагенозы” (1965) Е.М. Тареев дает развернутую клиническую картину узелкового полиартериита (УП) с детальным описанием висцеральных нарушений, в т. ч. поражение сердца, подчеркивая, что его тяжесть при УП сопоставима с ишемической болезнью сердца (ИБС) и злокачественной артериальной гипертензией (АГ) [3].
Однако в настоящее время в отечественной и иностранной литературе недостаточно систематизированных данных, касающихся патологических изменений сердца при СВ, имеются
лишь отдельные клинические наблюдения или исследования, проведенные на небольших группах пациентов, что связано с относительно редкой встречаемостью, высокой стоимостью и недостаточной доступностью многих методов исследований.
Следует отметить, что в работах, посвященных изучению поражения сердца при СВ, отмечается несоответствие между высокой частотой морфологических изменений и редкостью клинических проявлений [4–6]. Улучшение выживаемости больных аутоиммунными заболеваниями привело к изменению структуры их смертности. Если раньше причиной смерти таких пациентов чаще всего было
тяжелое поражение внутренних органов в рамках основного заболевания, то сегодня в структуре смертности увеличилась доля сердечно-сосудистых осложнений (ССО), связанных с атеросклерозом.
Целью нашего исследования было изучение частоты и структуры ССО, их взаимосвязи с факторами риска атеросклероза у больных СВ. Проведена оценка возможностей перфузионной сцинтиграфии миокарда (ПСМ) с технецием99 и мультиспиральной компьютерной томографии (МСКТ) коронарных сосудов в диагностике нарушений перфузии миокарда и оценка выраженности коронарного кальциноза.
Клиническая характеристика обследованных больных и методы исследований
В клинике нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева УКБ № 3 Первого МГМУ им. И.М. Сеченова с 1989 по 2011 г. был обследован 321 пациент с СВ, из них 206 (64,2 %) женщин и 115 (35,8 %) мужчин. Средний возраст всех больных на момент первой госпитализации
составил 40,7 ± 14,2 года, средний возраст женщин – 39,6 ± 13,8 года, мужчин – 42,6 ± 14,8 года. Нозологические формы СВ были представлены следующим образом: 138 (42,8 %) пациентов
с гранулематозом Вегенера (ГВ), 79 (24,7 %) – с артериитом Такаясу (АТ), 55 (17,2 %) – с УП и 49 (15,3 %) – с синдромом Черга–Страусс (СЧС). Анализ клинических проявлений заболевания проведен 153 (47,6 %) пациентам, проходившим обследование с 1989 по 2004 г. ретроспективно; проспективно обследованы 168 (52,4 %) больных с 2005 по 2011 г. Диагноз больным СВ установлен на основании
критериев Американской коллегии ревматологов (1990).
Оценивали следующие клинические проявления атеросклероза: стенокардия напряжения, инфаркт миокарда, острое нарушение мозгового кровообращения (ОНМК) или эндоваскулярное вмешательство в анамнезе.
В качестве традиционных факторов риска сердечно-сосудистых заболеваний были исследованы параметры, учитываемые в шкале SCORE (Systematic COronary Risk Evaluation): возраст, пол, систолическое артериальное давление (САД; ≥ 140 мм рт. ст.), уровень общего холестерина (> 5
ммоль/л), курение; в качестве дополнительных факторов риска учитывались маркеры нарушения функции почек: гиперкреатининемия (> 1,2 мг/дл) и снижение скорости клубочковой фильтрации (СКФ; < 60 мл/мин).
С целью оценки коронарного кровотока миокарда использована ПСМ с 99mTc-МИБИ, проведенная в отделении изотопных методов исследований УКБ № 1 Первого МГМУ им. И.М. Сеченова. Данное исследование проведено 99 пациентам с СВ. Томосцинтиграфия осуществлена на двудетекторной гаммакамере Millenium MG (General Electric). Исследование начинали через 1,0–1,5
часа после внутривенного введения 99mTc-МИБИ в покое. Использован стандартный протокол записи при проведении однофотонной эмиссионной компьютерной томографии миокарда с 99mTc-МИБИ.
МСКТ коронарных сосудов была проведена 32 больным системными васкулитами. Исследование осуществлено на четырехспиральном компьютерном томографе TOSHIBA Aquilion с подсчетом суммарного показателя кальциевого индекса (КИ) по методике A.S. Agatston и соавт. (1990).
Суммарный показатель КИ сравнивали с возрастной нормой. В соответствии с рекомендациями клиники
Mayo по величине суммарного КИ определена вероятность наличия ИБС (Rumberger J.A. и соавт., 2001).
Проанализированы протоколы патологоанатомических вскрытий 55 пациентов, страдавших СВ. Среди умерших были 23 (41,8 %) пациента с ГВ, 5 (9,0 %) – с АТ, 19 (34,5 %) – с УП и 8 (14,5 %) – с СЧС.
Для обработки данных была использована программа IBM SPSS Statistics 19.0 for Windows с применением различных методов статистического анализа: дисперсионный анализ, t-тест Стьюдента, а также критерий χ², z-критерий в отношении непараметрических наборов данных. Наличие нормального распределения значений количественных переменных во всех выборках проверено с помощью уравнения Колмогорова–Смирнова.
Результаты
Факторы риска атеросклероза и ССО при СВ
Нами была проанализирована структура факторов риска атеросклероза для больных СВ и их взаимосвязь с ССО, выявленных у 51 (15,9 %) из 321 пациента. В структуре ССО преобладала стабильная стенокардия, которая наблюдалась у 7,1 % больных. Развитие инфаркта миокарда имело место у 3,1 % пациентов, инсульта – у 4,6 %. Эндоваскулярные вмешательства были выполнены всего у 3 (0,9 %) пациентов. Частота ССО была выше у больных СЧС (22,3 %) и УП (18,2 %) и несколько ниже при ГВ (14,5 %) и АТ (12,6 %). Структура ССО у пациентов с различными СВ значительно различалась. Так, частота стенокардии была выше у больных ГВ (9,4 %) и СЧС (12,2 %), а частота инфаркта миокарда и инсульта – у пациентов с УП (7,3 и 9,1 % соответственно). При АТ среди ССО
преобладал инсульт, который развился у 6,3 % пациентов (табл. 1).
Таблица 1. Частота ССО при СВ.
Среди пациентов с ССО доля мужчин составила 49,0 %, среди больных без ССО их доля была статистически значимо ниже – 33,3 % (p < 0,047); кроме того, средний возраст пациентов с ССО превышал средний возраст больных без ССО (47,0 ± 14,9 и 39,6 ± 14,5 года соответственно; р = 0,001).
Результаты анализа структуры факторов риска в группе больных с ССО и без таковых представлены в табл. 2.
Таблица 2. Факторы риска ССО у больных СВ.
Несмотря на относительно молодой возраст пациентов, частота факторов риска атеросклероза в исследованной выборке была высокой, например, повышение САД ≥ 140 мм рт. ст. наблюдалось у 137 (42,8 %) больных, гиперхолестеринемия – у 205 (63,9 %). У 78 (24,3 %) пациентов было выявле-
но увеличение сывороточного уровня креатинина > 1,2 мг/дл, снижение СКФ < 60 мл/мин – у 76 (23,7 %). В то же время доля курильщиков среди всех больных была сравнительно небольшой – 96 (29,9 %) – и влияние этого фактора риска на развитие ССО установлено не было.
При анализе частоты других факторов риска атеросклероза статистически значимой разницы между двумя группами не выявлено, хотя у пациентов с ССО выше, чем у больных без ССО, была частота АГ (49,0 и 41,5 %), гиперхолестеринемии (72,5 и 62,2 %) и гиперкреатининемии (31,3 и 23,2 %).
Артериит Такаясу. Среди пациентов с АТ преобладали женщины молодого возраста; соответственно, частота ССО оказалась несколько ниже (12,6 %), чем у больных другими васкулитами (14,5–22,3 %). Средний возраст пациентов с наличием ССО и без них был сходным, частота АГ (45,5 и 42,6 %) и
гиперхолестеринемии (63,6 и 55,7 %) также была сопоставимой. У пациентов с ССО частота гиперкреатининемии была примерно в 2 раза выше, чем у больных без ССО (18,2 и 7,4 %). ля женщин с АТ наиболее значимыми факторами риска развития ССО оказались стаж заболевания (r = 0,30; р < 0,05) и уровень САД (r = 0,30; р < 0,05). Уровень общего холестерина у этих пациенток положительно коррелировал с возрастом на момент первой госпитализации (r = 0,41; р < 0,01) и уровнем САД (r = 0,40; р < 0,01).
Узелковый полиартериит. Подавляющее большинство пациентов с УП составили мужчины среднего возраста. В этой группе частота АГ (76 %) и частота нарушения функции почек (49 %) были значительно выше, чем у пациентов с другими СВ. В 10 (18,0 %) наблюдениях АГ имела злокачественный характер (АД 220/130 мм рт. ст. и выше) и сопровождалась нейроретинопатией III–IV степеней.
Обращает на себя внимание высокая частота инфаркта миокарда (7,3 %) и инсульта (9,1 %) по сравнению с другими нозологическими формами СВ. Распределение по полу и средний возраст пациентов с УП с наличием и без ССО были сходными, как и частота АГ, а также курения. У пациентов с ССО несколько выше была частота гиперхолестеринемии (80,0 и 61,0 %) и гиперкреатинемии (70,0 и 44,1 %). При УП нами выявлена положительная корреляционная связь между уровнем креатинина плазмы (r = 0,376; p < 0,05), средним уровнем САД (r = 0,318; р < 0,05) и развитием ССО. Кроме того, отмечена отрицательная корреляционная связь между суммарной дозой кортикостероидов и наличием ССО (r = -0,672; р < 0,05), что может указывать на необходимость длительной иммуносупрессивной терапии данной категории больных.
Синдром Черга–Страусс. Частота ССО у пациентов с СЧС была самой высокой в исследованной выборке (22,3 %). Доля мужчин среди пациентов с ССО была в 2 раза выше, чем среди больных без таковых (60,0 и 30,8 %), хотя средний возраст пациентов этих двух групп существенно не различался.
Частота АГ (50,0 и 51,2 %) и гиперхолестеринемии (77,8 и 74,3 %) у больных с ССО и без них была сходной. Обращает на себя внимание достоверно более высокая частота снижения СКФ (< 60 мл/мин) у пациентов с наличием ССО (70 против 18,0 %; р > 0,04). У женщин с СЧС уровень общего холестерина положительно коррелировал с развитием ССО (r = 0,378; p < 0,05). В данной группе больных высокие кумулятивные дозы кортикостероидов повышали риск развития АГ (r = 0,512; р < 0,05).
Гранулематоз Вегенера. Результаты анализа структуры факторов риска у этих пациентов соответствовали таковым во всей выборке. Среди пациентов с ССО была выше доля мужчин (50,0
против 32,3 %), а их средний возраст превышал таковой больных без ССО (52,3 ± 14,5 и 39,9 ± 13,6 года). В группе пациентов с ССО была несколько выше частота АГ (35,0 против 24,6 %) и гиперхолестеринемии (78,9 против 72,0 %) и ниже частота курения (15,0 против 29,0 %). Увеличение сывороточного уровня креатинина у пациентов с ССО и без них встречалось с примерно одинаковой частотой (25,0 и 28,8 %). У пациентов с ГВ была выявлена положительная корреляция Спирмена между возрастом на момент первой госпитализации и частотой развития ССО (r = 0,42; p = 0,01), длительностью заболевания (r =0,44; p = 0,001), средним уровнем САД (r = 0,32; p = 0,02) и суммарной дозой кортикостероидов, принятой за период наблюдения (r = 0,31; p = 0,02).
ПСМ с технецием99
Данное исследование проведено 99 больным СВ, у которых отмечены клинические проявления со стороны сердца (стенокардия, хроническая сердечная недостаточность) и/или изменения по данным эхокардиографии (диастолическая и систолическая дисфункция левого желудочка, наличие зон акинеза/гипокинеза).
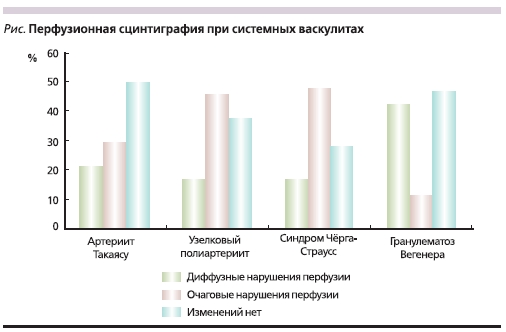
Результаты исследования перфузии миокарда указывали на разные варианты нарушения перфузии миокарда при СВ. При АТ у 20,8 % больных наблюдалось диффузное и у 29,1 % – очаговое поражения (см. рисунок). При УП и СЧС преобладало очаговое поражение миокарда – 45,8 и 48 % соответственно. У больных ГВ чаще встречались диффузные нарушения перфузии – 42,3 % больных, очаговые нарушения выявлены лишь у 11,5 % пациентов.
Выявленные очаговые дефекты перфузии у всех больных СВ соответствовали зонам гипокинезии по данным эхокардиографии.
МСКТ коронарных артерий
Исследование было проведено 32 больным СВ, у которых отмечены изменения перфузии по данным ПСМ.
Двенадцать (37,5 %) больных страдали коронарным кальцинозом (превышение возрастной нормы КИ). В возрастной группы 30–39 лет КИ не должен превышать 2 ЕД, до 50 лет – 11 , 50–59 лет – 24 и 60-69 лет – 54 ЕД. У лиц в возрасте 70 лет и старше нормальным считается КИ менее 65 ЕД. Средний возраст больных с коронарным кальцинозом составил 49,9 ± 12,3, без него – 41 ± 11,9 года (р < 0,05). У 7 (60 %) из них показатели КИ находились в диапазоне от 11 до 100 ЕД, что соответствует умеренному риску развития ИБС по рекомендациям клиники Mayo, у 5 (40 %) – в диапазоне 101–400 ЕД, что соответствует высокому риску развития ИБС (табл. 3).
Таблица 3. Уровень КИ у пациентов с СВ (n = 32).
Повышение уровня коронарного кальция, соответствующее умеренному риску развития ИБС, с одинаковой частотой отмечалось при СЧС и УП – у 37,5 % больных, при ГВ – у 44,4 %. КИ, соответствующий высокому риску ИБС, чаще всего встречался у больных СЧС (25 %) и ГВ (22,2 %). При УП выраженный коронарный кальциноз отмечался достоверно реже – у 12,5 % больных.
Достоверно более низкий КИ по сравнению с другими СВ наблюдался у больных АТ – повышение данного показателя встречалось лишь в 14,3 % наблюдений (р < 0,01).
Морфологическое исследование сердца и сосудов у больных СВ
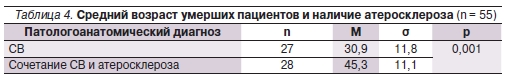
Нами проведен анализ морфологического изучения сердца и сосудов 55 умерших пациентов, страдавших СВ. Доля женщин составила 49,1 %, мужчин — 50,9 %, средний возраст всех умерших – 38,2 ± 13,4 года. Средний возраст умерших пациентов с атеросклеротическими изменениями сосудов был на 15 лет достоверно выше среднего возраста пациентов с исключительно иммуновоспалительным характером поражения сосудистой стенки (табл. 4).
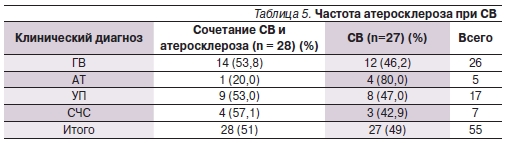
При патологоанатомическом исследовании атеросклеротические изменения в одном или более магистральных сосудах были выявлены у 28 (50,9 %) из 55 умерших. У больных АТ атеросклероз встречался достоверно реже по сравнению с другими СВ (p < 0,01; табл. 5).
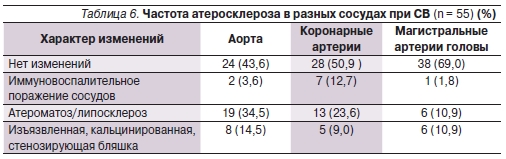
Сужение просвета сосуда атеросклеротической бляшкой на 50 % или более, изъязвленные бляшки, кальцинаты в бляшках отмечены у 20,0 % пациентов независимо от диагноза. Чаще всего признаки атеросклероза встречались в аорте и коронарных сосудах (49,0 и 32,6 % наблюдений соответственно),
несколько реже – в магистральных артериях головы (21,8 %). Кроме того, у небольшой части пациентов выявлены признаки иммуновоспалительного поражения сосудов, характерные для системных васкулитов: у 3,6 % больных – аортит, у 12,7 % – коронарит (табл. 6).
Частота гипертрофии миокарда составила 66,7 %. Обращает на себя внимание высокая частота кардиосклероза во всей выборке – 54,6 % проанализированных аутопсий. Частота мелкоочагового кардиосклероза среди пациентов с сочетанием СВ и атеросклероза составила 39,4 % и была статистически значимо выше, чем у больных без признаков атеросклероза (р = 0,005). Нами установлено, что относительный риск выявления мелкоочагового кардиосклероза у пациентов с сочетанием СВ и атеросклероза достоверно выше, чем у пациентов с изолированным иммуновоспалительным поражением сосудов (отношение шансов – 2,3; 95 % доверительный
интервал – 1,489–3,470). По результатам гистологического исследования миокарда признаки миокардита выявлены у 12 (21,8 %) пациентов (табл. 7).
Таблица 7. Частота различных форм поражения миокарда при СВ (%).
Нами проведен анализ причин смертности больных системными васкулитами. Сердечно-сосудистые
причины летальных исходов отмечены у 18 (30,9 %) пациентов с системными васкулитами. В группу ОНМК объединены геморрагические и ишемические инсульты, ни один из которых, по данным гистологического исследования, не был обусловлен атеросклеротическим поражением сосудов головного мозга. ОНМК в качестве причины смерти отмечены у 14,5 % больных, инфаркт миокарда – у 9,1 %, а ХСН – у 7,3 %.
Показано, что наличие атеросклероза может увеличивать вероятность летального исхода от хронической почечной недостаточности. Так, в группе больных с сочетанием СВ и атеросклероза хроническая почечная недостаточность стала причиной смерти в 39,3 % наблюдений, в группе с изолированным СВ – в 7,4 % (р < 0,01), а у пациентов, страдавших УП, относительный риск летального исхода от почечной недостаточности при наличии атеросклероза в 3,7 раз выше, чем в отсутствие атеросклеротических изменений в сосудах (95 % доверительный интервал – 1,397–9,624).
Обсуждение
Полученные нами данные подтверждают высокую частоту ССО у пациентов с СВ: инфаркт миокарда выявлен у 3,1 %, стенокардия – у 7,1 %, инсульт – у 4,6 % больных, что в 2,5–3,0 раза превышает частоту для общей популяции в России в сопоставимых возрастных группах [7, 8].
Анализ структуры сердечно-сосудистых факторов риска подтвердил их значение в развитии ССО при
СВ. Установлено, что у пациентов с ГВ основными факторами риска ССО были возраст, мужской пол, АГ и гиперхолестеринемия, что согласуется с данными исследования M. Faurschou и соавт. (2009), которые показали существенное увеличение риска госпитализаций по поводу ИБС и более высокую частоту развития инфаркта миокарда у больных, страдающих ГВ. Факторами риска по результатам данного исследования были возраст старше 50 лет, мужской пол и высокая кумулятивная доза циклофосфамида [9].
Больные ССО были старше, и среди них доля мужчин была выше. Кроме того, у пациентов с сердечно-
сосудистыми заболеваниями была выше частота АГ, гиперхолестеринемии и гиперкреатининемии, хотя различия между группами не достигли статистической значимости.
У больных ГВ выявлена связь между суммарной дозой кортикостероидов и развитием ССО. У данной категории пациентов достижение и поддержание ремиссии иммуновоспалительного процесса зачастую возможны лишь путем длительного, нередко пожизненного, приема этих препаратов.
При других СВ подобной взаимосвязи выявлено не было.
По результатам проведенной ПСМ у больных СВ определялись очаговые и диффузные дефекты перфузии миокарда. Обращает на себя внимание такой факт: очаговые нарушения встречаются чаще при УП и СЧС, а диффузные – при ГВ. Среди больных АТ приблизительно с одинаковой частотой встречались оба варианта нарушений перфузии. Этот факт, вероятно, объясняется разнообразными патогенетическими механизмами, имеющими место у больных СВ: иммунное воспаление
сосудов, атеросклероз, миокардит, наличие вторичного антифосфолипидного синдрома. Некоторые пациенты страдали сочетанием нескольких перечисленных факторов. Отмечена высокая частота бессимптомного поражения сердца, особенно у больных ГВ, когда при наличии изменений по данным ПСМ отсутствовали клинические проявления.
По результатам МСКТ сосудов сердца, уровень КИ, соответствующий умеренному и высокому риску ИБС, при УП отмечен у 50 % больных, СЧС – у 62,5 % и ГВ – у 66,6 %. Полученные данные могут указывать на более раннее развитие атеросклероза коронарных артерий при этих СВ, что подтверждают данные аутопсий.
В результате морфологического исследования сердца и сосудов у пациентов с СВ атеросклеротические бляшки были найдены в половине (50,9 %) наблюдений. Среди больных УП, СЧС
и ГВ отмечена приблизительно одинаковая частота атеросклероза (53–57 %), при АТ атеросклероз встречался в 2,5 раза реже по сравнению с другими васкулитами. Наши данные согласуются с результатами исследований M. Schrader и соавт. (1985) и P. Korantzopoulos и соавт. (2004), в
которых, по данным аутопсий, поражение коронарных артерий встречается у 50 % больных УП и ГВ [6, 10].
Однозначно трактовать развитие мелкоочагового кардиосклероза у больных СВ не всегда представляется возможным с учетом сложного генеза поражения коронарных сосудов. Обращает на себя внимание значительное преобладание кардиосклероза над миокардитом. Нами установлена
взаимосвязь между наличием атеросклероза и мелкоочаговым кардиосклерозом по результатам морфологического исследования.
Летальные исходы от инфаркта миокарда, хронической сердечной недостаточности и ОНМК не были ассоциированы с высокой частотой атеросклероза. При СВ причиной возникновения сердечно-сосудистых симптомов может быть поражение миокарда или сосудов сердца в рамках иммунного
воспаления. Высокая частота инсульта при АТ (6,3%) отражает наличие васкулита с поражением сонных и церебральных артерий. Можно предположить, что причиной частого развития ССО было синергическое взаимодействие между воспалительными медиаторами атерогенеза и традиционными сердечно-сосудистыми факторами риска.
Так, при УП развитие высокой АГ в течение короткого периода существенно ограничивает возможности адаптации органов-мишеней к резкому повышению АД, что может приводить к развитию ОНМК геморрагического типа и возникновению хронической сердечной недостаточности с расширением камер сердца [1, 3, 11, 12]. У больных ГВ описаны случаи инфаркта миокарда, связанного с некротизирующим васкулитом коронарных артерий [13, 14]. При СЧС наблюдается поражение коронарных сосудов, связанное с иммуновоспалительным процессом, при этом возможны варианты без развития стенозов коронарных артерий [15, 16].
Вместе с тем нами установлено, что наличие атеросклероза может увеличивать вероятность летального исхода от хронической почечной недостаточности. Таким образом, можно предполагать развитие у части больных С ишемической болезни почек, связанной с не только с иммуновоспалительным процессом, но и с атеросклерозом сосудов почек [17].
Заключение
Поражение сердца имеет место при всех нозологических формах изучаемых СВ, во многом определяя клиническую картину заболеваний и их прогноз. В нашем исследовании ССО, включая инфаркт миокарда и инсульт, отмечались в каждом шестом наблюдении.
Сочетание у одного пациента классических факторов риска атеросклероза и СВ позволяет отнести его к группе сверхвысокого риска ССО. Это обстоятельство дополнительно повышает актуальность изучения клинических и патофизиологических механизмов поражения сердечно-сосудистой системы у больных СВ, что способно обогатить терапевтическую практику.
Необходимо отметить важность ранней диагностики поражения сердца у данной категории больных, в т. ч. до развития клинических проявлений, с использованием неинвазивных методов диагностики, что позволит оптимизировать их лечение и снизить риск развития ССО. Полученные данные указывают на важность активного воздействия на факторы риска атеросклероза путем применения антигипертензивных, гиполипидемических и нефропротективных средств.



