В последние годы развернулась настоящая гонка за вывод на рынок лекарственного средства, обладающего всеми достоинствами варфарина, при этом более предсказуемого и безопасного. Расшифровка механизмов гемостаза привела к тому, что в последнее время разработчики лекарственных средств сосредоточили свои усилия на поиске специфических ингибиторов того или иного фактора свертывания. Значимый успех достигнут при создании прямых ингибиторов фактора Ха. Прямые ингибиторы фактора Ха непосредственно связываются с активным центром молекулы факто-
ра Х, блокируя образование комплекса фактор–субстрат. Поэтому прямые ингибиторы способны инактивировать как свободный, так и связанный с тромбином фактор Xa [1, 2]. Особый интерес к разработке ингибиторов фактора Ха не случаен. Во-первых, этот фактор является одним из ключевых
белков в системе свертывания крови. Во-вторых, только очень существенное снижение концентрации фактора Ха в плазме (менее 1 % от нормального уровня) сопровождается развитием серьезных кровотечений [3]. Таким образом, можно ожидать, что использование ингибиторов фактора Ха не
должно значимо нарушать функционирование системы гемостаза и приводить к тяжелым геморрагическим осложнениям. В 1987 г. был открыт первый природный ингибитор фактора Ха антистазин, выделенный из слюнных желез пиявки Haementeria officinalis [4], что дало толчок к разработке его синтетических пероральных аналогов. Компаниями Bayer и Johnson&Johnson
совместно разработана молекула ривароксабана (химическое название – 5-хлор-N-({(5S)-2-оксо-3-[4-
(3-оксо-4-морфолинил)-фенил]-1, 3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамид), обладающая
одновременно высокой аффинностью к фактору Ха и высокой биодоступностью при пероральном
приеме.
В данном обзоре суммированы факты, касающиеся первого дошедшего до клинического использования
ингибитора фактора Ха ривароксабана.
Фармакодинамика и фармакокинетика ривароксабана
Ривароксабан – прямой высокоспецифичный ингибитор фактора Ха, его связывание с субстратом конкурентно и обратимо, степень ингибирования фактора Ха пропорциональна концентрации ривароксабана в плазме [5]. В исследованиях in vitro показано, что ривароксабан связывается с фактором Ха, более чем в 10 тыс. раз селективнее, чем с другими сериновыми протеазами [5], он способен инактивировать фактор Х в составе как протромбиназного комплекса, так и тромба [6]. Ривароксабан не оказывает прямого влияния на агрегацию тромбоцитов. Однако ингибирование
образования тромбина под действием ривароксабана ведет к уменьшению активности тромбоцитов. Поэтому ривароксабан снижает индуцированную тканевым фактором агрегацию тромбоцитов [7], тогда как реакция тромбоцитов на АДФ (аденозиндифосфат), коллаген или тромбин остается без изменений [8]. Непрямое действие ривароксабана на агрегацию тромбоцитов может объяснять высокую эффективность ривароксабана в отношении как венозных, так и артериальных тромбов [5, 9]. Ривароксабан не влияет на работу системы активированного протеина С, ингибирующую образование тромбина по механизму отрицательной обратной связи [10].
В ряде клинических исследований, проведенных с участием здоровых добровольцев [11, 12], больных острым коронарным синдромом (ОКС) [13] и мерцательной аритмией (МА), больных с тромбозом глубоких вен и тробоэмболией легочной артерии, а также у пациентов после ортопедических операций [14], показано, что ривароксабан обладает высокопредсказуемым фармакокинетическим и фармакодинамическим профилем в широком диапазоне доз (5–80 мг). На концентрацию ривароксабана в плазме не оказывают значимого влияния пол, возраст и масса тела [11, 12]. Биодоступность ривароксабана при приеме внутрь 10 мг составляет 80–100 % [15], препарат быстро всасывается и пик концентрации наступает через 2–4 часа [15–17]. В дозе 20 мг биодоступность препарата составляет около 66 % натощак, повышаясь при совместном приеме препарата с пищей. Поэтому ривароксабан в дозе 10 мг и ниже можно принимать до, во время или после еды. А в дозе 15 мг и выше ривароксабан необходимо принимать совместно с пищей. Связывание с белками плазмы (преимущественно с альбумином) составляет 92–95 % [15, 18]. Ривароксабан может проникать через плаценту, но практически не проникает через гематоэнцефалический барьер [19].
Ривароксабан быстро удаляется из плазмы без образования активных метаболитов, T 1/2 препарата составляет от 5 до 9 часов у молодых и от 11 до 13 часов у пожилых [15, 17]. При лечении больных МА эффективным оказался однократный, а при лечении больных ОКС – двукратный прием лекарства. Несмотря на относительно короткий период полувыведения ривароксабана, ингибирование образования тромбина сохраняется до 24 часов после однократного приема 10–80 мг препарата [20].
Примерно треть вещества экскретируется почками в неизмененном виде (активная секреция), остальные две трети подвергаются биотрансформации с образованием неактивных метаболитов, половина которых также удаляется через почки, половина – с желчью. Суммарно через почки экскретируется около 66 % лекарства. Активная почечная секреция ривароксабана осуществляется с участием Р-гликопротеида (белок множественной лекарственной устойчивости 1). Биотрансформация в печени осуществляется преимущественно изоферментом IIIA4 цитохрома Р450, в меньшей степени – изоферментом IIJ2 [21].
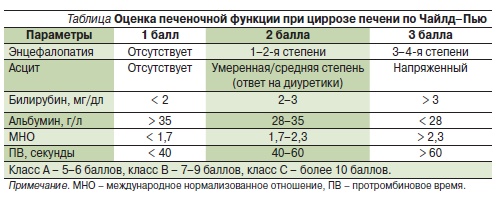
При скорости клубочковой фильтрации ниже 15 мл/мин применять ривароксабан не рекомендуется, при менее выраженной почечной недостаточности применение не противопоказано, но требуется более тщательный контроль, особенно в случаях совместного приема препаратов, повышающих концентрацию ривароксабана в плазме [15]. Наличие умеренной печеночной недостаточности (А по классификации Чайлд–Пью, см. таблицу) не оказывает значимого влияния на фармакокинетику препарата [22].
Лекарственные взаимодействия
Вопрос о лекарственных взаимодействиях ривароксабана изучен не полностью. Фармакокинетические
взаимодействия возможны на этапах всасывания препарата, окислительного метаболизма (изоформы IIIA4 и IIJ2 цитохрома Р450) и активного транспорта (Р-гликопротеид). Установлено, что только сильные ингибиторы или индукторы Р-гликопротеида или цитохрома IIIA4 в высоких дозах оказывают значимое влияние на кинетику ривароксабана [23, 24]. Поэтому ривароксабан не рекомендуется
применять больным, получающим системное лечение кетоконазолом, ритонавиром, рифампицином. Другие противогрибковые препараты азоловой группы (итраконазол, вориконазол и позаконазол) могут применяться совместно с ривароксабаном с большой осторожностью. Совместное применение ривароксабана с другими сильными индукторами цитохрома IIIA4 (фенитоином, карбамазепином,
фенобарбиталом) специально не изучалось, однако показано, что эти препараты способны приводить к снижению концентраций ривароксабана в плазме. Не следует рекомендовать совместный прием ривароксабана с растительными препаратами, содержащими экстракт зверобоя. Зверобой является мощным индуктором P-гликопротеида и цитохрома IIIA4, и соответственно, действие ривароксабана может значимо снижаться при совместном приеме.
Не найдено признаков взаимодействий ривароксабана с дигоксином, аторвастатином, антацидами
(гидроксидами алюминия и магния), Н2-блокатором ранитидином, ингибитором протонной помпы омепразолом, кларитромицином и эритромицином [15, 25–28].
Фармакодинамические взаимодействия возможны с различными препаратами, обладающими антитромботическими свойствами (ангиагрегантами, антикоагулянтами, нестероидными противовоспалительными средствами). Клинически значимых фармакокинетических или фармакодинамических взаимодействий между ривароксабаном и ацетилсалициловой кислотой не выявлено [29]. Добавление ривароксабана к стандартным дозам ацетилсалициловой кислоты сопровождается развитием дополнительного антитромботического эффекта без чрезмерного повышения риска развития кровотечений. Не обнаружено взаимодействий между ривароксабаном (однократный прием 15 мг) и клопидогрелом (нагрузочная доза 300 мг, затем 75 мг в сутки). Однако у некоторых больных отмечено значимое увеличение времени кровотечения, не коррелировавшее с агрегацией тромбоцитов, содержанием Р-селектина или GPIIb/ IIIa-рецепторов [30].
Лабораторный контроль
Ривароксабан является препаратом, антикоагулянтное действие которого высокопредсказуемо и поэтому не требует лабораторного контроля. Тем не менее существуют ситуации, когда необходимо оценить степень выраженности антикоагулянтного эффекта препарата. К ним относятся кровотечения, травмы, экстренная хирургическая операция, передозировка препарата, перевод больного на прием другого антикоагулянта.
Ривароксабан влияет на результаты стандартных коагуляционных тестов, преимуществом которых является широкая доступность. Тем не менее использование этих тестов для оценки выраженности антикоагулянтного действия ривароксабана ограничено низкой специфичностью и большой
вариабельностью получаемых результатов [31, 32]. Наиболее приемлемым способом контроля антикоагулянтного действия ривароксабана представляется метод хромогенных субстратов.
В отличие от обычных коагуляционных тестов амидолитические методы позволяют непосредственно определять (спектрофотометрически) степень активации фактора Ха. Ривароксабан оказывает четкое зависимое от дозы влияние на результаты коммерчески доступных на сегодняшний день тестов (в концентрации до 0,5 мкг/мл при использовании бычьего фактора Ха и в концентрации до 1 мкг/мл для человеческого фактора Ха), однако результаты отличаются широкой вариабельностью [33]. Разрабатываются усовершенствованные тесты (с использованием человеческого фактора Ха), которые бы позволяли с высокой точность определять активность ривароксабана в широком диапазоне концентрации препарата в плазме [34].
Клинические аспекты применения ривароксабана
К настоящему моменту изучена возможность использования ривароксабана широким кругом больных.
Установлена его эффективность для профилактики венозных тромбоэмболий (ТЭ) у терапевтических и
хирургических пациентов, для лечения венозных ТЭ, при ОКС и МА. Следует обратить внимание, что на момент написания данной статьи зарегистрированными показаниями к применению препарата в России являются только профилактика венозных ТЭ в ортопедической хирургии и профилактика тромбоэмболических осложнений (ТЭО) у больных МА.
Использование ривароксабана для предотвращения ТЭО в ортопедической хирургии изучено в 4 крупных исследованиях III фазы (программа RECORD), включивших 12 729 больных после протезирования коленного и бедренного суставов [35–38]. По сравнению с эноксапарином эффективность ривароксабана была достоверно выше для предотвращения тромбоза глубоких вен, тромбоэмболии легочной артерии и смерти от всех причин. При этом частота крупных кровотечений значимо не различалась. В России ривароксабан зарегистрирован для профилактики ТЭО в ортопедической хирургии, рекомендуемая доза составляет 10 мг 1 раз в сутки.
Применение ривароксабана для профилактики ТЭо при МА
В крупном рандомизированном исследовании III фазы ROCKET-AF (Rivaroxaban Once daily oral direct Factor Xa inhibition Compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation) изучена эффективность ривароксабана по сравнению с варфарином [39]. Первичной целью исследования явилось доказательство не меньшей, чем у варфарина, эффективности ривароксабана для профилактики ТЭО у больных МА. В исследование были включены 14 264 пациента из 45 стран
с МА неклапанного генеза, имеющих высокий риск развития ТЭО (2 и более баллов по шкале CHADS2). Средний возраст составил 73 года (четверть больных были старше 78 лет), почти 40 % были женщинами. Артериальная гипертензия встречалась у 90,5 %, сахарный диабет – у 40 %, сердечная
недостаточность – у 62,5 % больных. Более половины (54,8 %) пациентов в анамнезе имели ишемический инсульт, транзиторную ишемическую атаку или системные ТЭ. Средний балл по шкале CHADS2 составил 3,5; 87 % больных имели индекс CHADS2 ≥ 3, а 44 % ≥ 4 баллов. Итак, важнейшей особенностью данного исследования явилось включение значительного числа тяжелых больных, традиционно редко включаемых в рандомизированные исследования антикоагулянтов. По сравнению с исследованиями RE-LY (дабигатран) и ARISTOTLE (апиксабан) в исследовании ROCКET-AF число больных с высоким тромбоэмболическим и геморрагическим риском было ближе всего к реалиям клинической практики.
Больные были разделены на две группы – принимающих ривароксабан в дозе 20 мг 1 раз в сутки или варфарин в дозе, достаточной для поддержания целевого МНО от 2 до 3. При снижении клиренса креатинина менее 50 мл/мин (30–49 мл/мин) ривароксабан назначали в дозе 15 мг ежедневно. Больные
с клиренсом креатинина менее 30 мл/мин не включались в исследование. Исследование проводилось по двойному слепому протоколу, все больные получали плацебо варфарина или ривароксабана. МНО определяли слепым методом при помощи прибора point-of-care, зашифрованное значение МНО отправляли независимому контролеру, который затем сообщал реальное значение МНО для пациентов, принимавших варфарин, и фиктивное значение МНО для пациентов, принимавших ривароксабан.
Для оценки эффективности лечения использовали суммарную частоту развития инсульта (ишемического или геморрагического) и системных ТЭ. Для оценки безопасности рассчитывали частоту развития тяжелых и нетяжелых, но клинически значимых кровотечений. Критериями тяжелого кровотечения являлись кровотечение, приведшее к смерти или стойкой инвалидизации, кровотечение в жизненно важные органы (внутричерепные, интраспинальные, внутриглазные, внутрисуставные кровотечения, гемоперикард, кровотечения в межмышечное пространство, осложненные
компартмент-синдромом), кровотечение, сопровождающееся падением уровня гемоглобина ≥ 20 г/л или потребовавшее переливания ≥ 2 доз крови или эритроцитарной массы. Критерием клинически значимого кровотечения являлось отсутствие признаков тяжелого кровотечения при наличии хотя бы одного из следующих факторов: необходимость внеочередного контакта с врачом (лично или по телефону), временное прекращение приема исследуемого препарата, кровотечение, сопровождающееся выраженным болевым синдромом или другими нарушениями самочувствия.
Геморрагический инсульт одновременно включался в анализ эффективности и безопасности.
Средняя продолжительность лечения составила 590 дней (медиана –707 дней). Группы не различались по частоте приема основных сопутствующих препаратов, около трети больных из обеих групп дополнительно принимали ацетилсалициловую кислоту в дозе ≤ 100 мг. Время, на протяжении которого поддерживалось целевое МНО в группе варфарина, составило 55 %.
Анализ эффективности ривароксабана проводился тремя исходно запланированными способами. Первый – анализ “по протоколу” для подтверждения гипотезы о том, что ривароксабан не менее эффективен, чем варфарин. В этот анализ вошли все пациенты, получившие хотя бы одну дозу исследуемого препарата, не имевшие существенных отклонений от протокола исследования. Регистрация конечных точек проводилась на всем протяжении приема исследуемого препарата и в течение 2 дней после окончания лечения. В этот анализ были включены 97,6 % больных из группы
ривароксабана и 99,2 % – из группы варфарина. До начала исследования было запланировано, что если при анализе “по протоколу” будет доказано, что ривароксабан по эффективности не уступает варфарину, будет проведен второй тип анализа для доказательства бóльшей эффективности ривароксабана. Этот анализ назвали “на лечении”. В анализ включались пациенты, получившие хотя бы одну дозу исследуемого препарата, независимо от соблюдения протокола исследования. Конечные точки регистрировались на всем протяжении приема исследуемого препарата и в течение 2 дней после окончания лечения. В этот анализ вошли 99,0 и 99,3 % больных из групп ривароксабана и варфарина соответственно. Третий тип анализа – “по намерению лечить”, включивший 99,3 % пациентов, рандомизированных к приему ривароксабана, и 99,4 % пациентов, рандомизированных к приему варфарина. Регистрация конечных точек проводилась на всем протяжении исследования независимо от сроков прекращения приема исследуемого препарата. Среди включенных в этот анализ больных были и те, кто не получил ни одной дозы исследуемого препарата.
Согласно анализу “по протоколу”, частота развития инсульта и системных ТЭ составила 1,7 % в год в группе ривароксабана и 2,2 % в год в группе варфарина (отношение шансов [ОШ] = 0,79 [0,66–0,96], р < 0,001 для анализа “не менее эффективен”). При анализе “на лечении”, частота развития инсульта и системных ТЭ была ниже в группе ривароксабана и составила 1,7 % в год по сравнению с 2,2 % в год
на фоне приема варфарина (ОШ = 0,79 [0,65–0,95], р = 0,01 для анализа “более эффективен”). Согласно анализу “по намерению лечить”, частота инсульта и системных ТЭ была 2,1 % в год для ривароксабана по сравнению с 2,4 % в год для варфарина (ОШ = 0,88 [0,74–1,03], р < 0,001 для анализа “не менее эффективен”; р = 0,12 для анализа “более эффективен”).
Результаты проведенного анализа показывают, что, пока больные принимают исследуемый препарат, частота развития инсульта и системных ТЭ ниже на фоне лечения ривароксабаном, чем варфарином (1,7 и 2,2 % соответственно, р = 0,02). Однако, если больной по каким-либо причинам прекращает прием исследуемого препарата, частота развития инсультов и системных ТЭ существенно увеличивается и составляет 4,7 % в год для получавших ривароксабан и 4,3 % в год для получавших варфарин (р = 0,58). Особенно опасным периодом развития ТЭО после прекращения приема ривароксабана являются первые 30 дней. За тот период в группе больных, прекративших прием ривароксабана, развилось 22 ТЭ-события по сравнению с 7 в группе больных, прекративших прием
варфарина (р = 0,008). Возможным объяснением такой значимой разницы в частоте развития ТЭО является особенность дизайна исследования, с учетом которого для сохранения “ослепления” были запрещены визиты к врачу в течение первых 3 дней после окончания приема препарата исследования. Имеет значение также и тот факт, что при переводе больного с исследуемого препарата на открытый
прием варфарина средний срок достижения целевого МНО составил 13 дней в группе ривароксабана по сравнению с 3 днями в группе варфарина.
Важным отличием от дабигатрана является то, что на фоне применения ривароксабана частота развития инфаркта миокарда несколько (недостоверно) меньше, чем на фоне варфарина. Профилактическое действие ривароксабана в отношении коронарных эпизодов было подтверждено
в исследовании 3 фазы ATLAS ACS 2-TIMI 51 [40]. На сегодняшний день ривароксабан – единственный из новых пероральных антикоагулянтов продемонстрировал подобное действие. Очевидно, что у больных с высоким риском коронарных осложнений выбор ривароксабана наиболее предпочтителен.
Прием ривароксабана не приводил к достоверному повышению суммарной частоты тяжелых и клинически значимых кровотечений: 14,9 % – для ривароксабана и 14,5 % – для варфарина (р = 0,44). Частота тяжелых кровотечений также не различалась (3,6 и 3,4 % в год для ривароксабана и варфарина соответственно, р = 0,58). Прием ривароксабана сопровождался небольшим,
но достоверным повышением риска желудочно-кишечных кровотечений: 3,2 % по сравнению с 2,2 % для варфарина (р < 0,001). Приемлемого объяснения данному факту пока не получено.
Принципиальным результатом является выявленное снижение частоты развития геморрагических инсультов, смертельных кровотечений и кровоизлияний в жизненно важные органы в группе ривароксабана. Частота развития геморрагического инсульта составила 0,5 % в год для ривароксабана по сравнению с 0,7 % в год для варфарина (р = 0,02), частота смертельных кровотечений – 0,2 и 0,5 % в год соответственно (р = 0,003).
Причина снижения частоты развития геморрагического инсульта на фоне терапии ривароксабаном не
ясна. Возможным объяснением может быть низкая проницаемость препарата а также отсутствие влияния на фактор VII. Известно, что в сосудистом русле головного мозга содержится большое количество тканевого фактора, по-видимому играющего ключевую роль в поддержании гемостатического баланса. Ривароксабан в отличие от варфарина не влияет на образование комплекса тканевой фактор – фактор VIIа [41].
Авторы исследования сделали вывод о том, что у больных МА, имеющих высокий риск развития ТЭО, ривароксабан по эффективности сопоставим с варфарином. При этом не выявлено достоверных различий по геморрагическому риску. Профиль безопасности ривароксабана немного лучше за счет
снижения частоты наиболее тяжелых геморрагических осложнений (внутричерепных и смертельных кровотечений). Не выявлено значимого повышения уровня трансаминаз и билирубина в группе ривароксабана и различий в частоте развития побочных эффектов, не связанных с кровотечениями.
Критики исследования отмечают, что одним из его недостатков был низкий показатель времени, на протяжении которого поддерживалось целевое МНО в группе варфарина (55 %). Согласно данным других исследований, значение этого параметра колебалось от 60 до 65 % и составило 62,2 % в исследовании ARISTOTLE с апиксабаном, 64 % – в исследовании RE-LY с дабигатраном. Возможным
объяснением этому факту является высокая частота встречаемости сахарного диабета, инсультов в анамнезе, сердечной недостаточности и высокий риск эмболического инсульта (рассчитанный по шкале CHADS2) у больных, включенных в исследование ROCKET-AF, по сравнению с больными, включенными в исследования RE-LY и ARISTOTLE. Множество лекарств, которые вынуждены принимать больные, как известно, ведет к тому, что правильно поддерживать уровень МНО становится существенно труднее [42]. Дополнительными объяснениями низкого значения времени поддержания целевого МНО в исследовании ROCKET-AF могут быть двойной слепой дизайн исследования в сочетании с отсутствием в протоколе четкого алгоритма коррекции дозы варфарина и широкий географический охват исследования, включившего страны с традиционно низким качеством контроля МНО. В реалиях российской клинической практики значение времени поддержания целевого МНО редко достигает 50 %. Иначе говоря, результаты исследования имеют особую ценность в отношении более тяжелых больных.
M.R. Patel и соавт. [39] провели дифференцированный анализ эффективности ривароксабана в зависимости от значения времени поддержания целевого МНО. Все исследовательские центры были разделены на четыре группы. Первая – целевое МНО поддерживалось на протяжении менее 50,6 %
времени лечения, вторая – целевое МНО поддерживалось на протяжении 50,7–58,5 % времени лечения, третья – на протяжении 58,6–65,7 % времени и четвертая – более 65,8 % времени лечения МНО находилось в целевом диапазоне. Установлено, что во всех этих группах независимо от качества контроля МНО ривароксабан по эффективности не уступал варфарину (р < 0,05 для анализа “не менее эффективен”). Достоверной связи эффективности варфарина и значения времени поддержания целевого МНО не выявлено (р = 0,74 для доказательства взаимодействия). К сожалению, другие результаты анализа в публикации отсутствуют. Прежде всего это касается анализа безопасности ривароксабана в зависимости от времени поддержания целевого МНО. Например, аналогичный анализ, проведенный по результатам исследования RE-LY с дабигатраном [42], показал, что если целевое МНО поддерживалось на протяжении более 72 % времени, безопасность дабигатрана не превышала таковую у варфарина, за исключением более низкой частоты развития геморрагических инсультов. Проведение подобного анализа результатов ROСKET-AF должно прояснить вопрос о целесообразности
перевода больного с варфарина на ривароксабан в зависимости от эффективности контроля лечения непрямыми антикоагулянтами.
Еще одним поводом для критики препарата является увеличение риска развития ТЭО после прекращения приема ривароксабана. Учитывая приблизительно равную частоту развития ТЭО к 30-му дню и через год после прекращения приема ривароксабана, вряд ли можно с уверенностью говорить об избыточной гиперкоагуляции после отмены препарата как возможном механизме развития ТЭО. Здесь уместно отметить, что только половина больных, прекративших прием исследуемого препарата, начинали открыто принимать непрямые антикоагулянты. Время до достижения целевого МНО на фоне открытого приема антикоагулянтов значимо различалось между группами лечения и составило 13 дней для пациентов, прекративших прием ривароксабана, и 3 дня для пациентов, прекративших прием варфарина. Следует обратить внимание, что остальные лекарства (дабигатран и апиксабан) подобным образом не изучались. Период регистрации тромбоэмболических событий в исследованиях этих препаратов ограничился лишь 2 сутками после окончания исследования. Для того чтобы исключить нарастание риска ТЭО на фоне смены лечения, были разработаны специальные правила
перехода с одного лекарства на другое. Эти правила были включены в официальную инструкцию по применению лекарства и выглядят следующим образом:
• Переход с антагонистов витамина K (АВК) на ривароксабан: при МНО ≤ 3 лечение АВК следует прекратить и начать лечение ривароксабаном. При этом при переходе пациентов с АВК на ривароксабан после приемаривароксабана значения МНО будут ошибочно завышенными. МНО не подходит в качестве определения антикоагулянтной активности ривароксабана и поэтому не должно
использоваться с этой целью.
• Переход с ривароксабана на АВК: существует возможность возникновения недостаточного антикоагулянтного эффекта при переходе с ривароксабана на варфарин. В связи с этим необходимо обеспечить непрерывный достаточный антикоагулянтный эффект во время подобного перехода с помощью альтернативных антикоагулянтов. Следует отметить, что во время перехода с ривароксабана на АВК ривароксабан может способствовать повышению МНО. Таким образом, забор
крови для определения МНО должен проводиться на фоне мининмальной концентрации препарата в
крови, утром – до приема препаратов. МНО не должно использоваться для мониторинга терапевтического эффекта АВК в течение не менее 48 часов после окончательного прекращения применения ривароксабана.
• Переход с парентеральных антикоагулянтов на ривароксабан: для пациентов, получающих парентеральные антикоагулянты, применение ривароксабана следует начинать за 0–2 часа до времени следующего планового парентерального введения препарата (например, низкомолекулярного гепарина) или в момент прекращения непрерывного парентерального введения препарата (например, внутривенного введения нефракционированного гепарина).
• Переход с ривароксабана на парентеральные антикоагулянты: следует отменить ривароксабан и ввести первую дозу парентерального антикоагулянта в тот момент, когда нужно было принять следующую дозу ривароксабана [43].
На основании результатов исследования ROCКET-AF ривароксабан был зарегистрирован в России для
профилактики развития ТЭО у больных МА как альтернатива варфарину. Ркомендуемая доза препарата составляет 20 мг при однократном приеме. Итак, при выборе ривароксабана в качестве альтернативного варфарину лекарства следует учитывать следующие его особенности:
• доказательства его эффективности получены в группе больных с высоким риском тромбоэмболических и геморрагических осложнений;
• ривароксабан мало взаимодействует с другими препаратами и не зависит от диетических пристрастий больного;
• ривароксабан имеет удобный режим приема – один раз в сутки;
• для больных, имеющих высокий риск развития инфаркта миокарда, ривароксабан является наиболее
подходящей альтернативой варфарину.
Таким образом, в клинической практике появился еще один препарат, альтернативный варфарину.
Очевидно, что с накоплением сведений показания к его применению будут расширяться.


