Введение
На сегодняшний день точная диагностика и эффективное комплексное лечение пациентов с поражениями периферических нервов представляют актуальную задачу в современной медицине. В челюстно-лицевой области поражение тройничного нерва является одной из тяжелых и часто встречаемых патологий. При этом среди заболеваний третьей ветви тройничного нерва 63–85 % составляет невропатия нижнего альвеолярно-го нерва (НАН) [3]. Одной из самых частых причин повреждения указанного нерва остается травма нервнососудистого пучка нижней челюсти после стоматологических вмешательств (6–40 %) [6, 7].
Объективная оценка степени повреждения нервного ствола и уровня патологических процессов в тканях (степени гидратации), иннервируемых НАН, является одной из ведущих задач в диагностике поражения периферического отдела нервной системы и анализе эффективности применяемой терапии [1, 2, 5].
Цель исследования – повышение качества диагностики и эффективности комплексного лечения больных невропатией нижнего альвеолярного нерва.
Материал и методы
Для оценки эффективности проводимого лечения были обследованы 3 группы пациентов с травматической невропатией НАН (56 человек) в возрасте от 21 до 59 лет (21 мужчина и 35 женщин): 1-я группа, контрольная (18 человек), – пациенты, которым проведено стандартное медикаментозное лечение с использованием поливитаминных и нестероидных противовоспалительных средств (нимесулид); 2-я группа, группа сравнения (18 человек), – пациенты, которым совместно со стандартной терапией назначали курс флюктуоризации (аппарат АСБ-2М, Россия); 3-я группа, основная (20 человек), – пациенты, которым совместно со стандартной терапией назначали курс флюктуофореза 0,5 %-ного раствора ипидакрина (аппарат АСБ-2М, Россия). Обследование проведено в динамике до лечения, через 7 дней,1, 3, 6 и 12 месяцев после лечения.
Для количественной объективной характеристики сенсорных нарушений кожи и степени гидратации тканей пародонта нижней челюсти использованы методы определения порогов чувствительности кожных покровов нижней губы и подбородочной области (электростимулятор “Disa-1500”, Дания) и биоимпедансной спектрометрии (биоимпедансный анализатор “ABC-01 Медасс”, Россия).
Метод измерения порогов чувствительности кожи иннервируемой области основан на сопоставлении силы раздражителя, применение которого вызывает соответствующие ощущения у пациента. Для раздражения тканей использованы одиночные импульсы электрического тока длительностью 0,1
мс, с частотой 0,5 имп./с и амплитудой от 0,5 до 99 мА. Для определения чувствительности кожи в зоне иннервации НАН раздражающий электрод установили в проекции нижней губы и подбородочной области на стороне поражения нерва и фиксировали пластырем.
При определении порогов чувствительности использованы критерии, соответствующие определению понятий, принятых Международной ассоциацией по изучению боли: порог ощущений (ПО) – самые слабые ощущения, которые первыми появляются при увеличении интенсивности раздражителя (оценка степени повреждения толстых миелиновых волокон группы А-бета, являющихся проводниками тактильной чувствительности); порог боли (ПБ) – ощущения, при которых только появляется неприятный оттенок (оценка степени повреждения тонких миелиновых волокон группы А-дельта, проводящих сигнал от тактильных, температурных, некоторых болевых рецепторов и отвечающих за острую боль); уровень выносливости боли (УВБ) – неприятные ощущения дальнейшего увеличения интенсивности, которых пациент не желает (оценка степени повреждения тонких безмиелиновых нервных волокон группы С, передающих сигналы от болевых рецепторов, терморецепторов и
рецепторов давления).
Метод биоимпедансной спектрометрии основан на разнице прохождения тока различной частоты через ткани, при этом увеличение гидратации внеклеточной среды отражает воспалительные
процессы в тканях, снижение гидратации может быть вызвано дистрофическими процессами. Форма воспалительных процессов в тканях (преобладание экссудации или пролиферации) влияет на импедансометрические показатели. При экссудативных процессах повышается степень гидратации внеклеточного пространства (на низких частотах, 5 и 20 кГц), при пролиферативных процессах в результате количественного и качественного изменений клеточной инфильтрации повышается степень гидратации внутриклеточной среды (на высоких частотах, 50 и 100 кГц) [4]. Для измерений указанных показателей применена тетраполярная система электродов “Медасс”, установленная на вестибулярной поверхности альвеолярной части нижней челюсти в проекции повреждения НАН. С помощью программного обеспечения “Медасс” вычислена степень гидратации тканей при частотах 5, 20, 50 и 100 кГц.
Результаты исследования и обсуждение
По итогам исследования порогов чувствительности у обследуемых пациентов с травматической невропатией НАН выявлено, что ПО, ПБ и УВБ в зоне, иннервируемой НАН на стороне повреждения, статистически достоверно (p < 0,01) превышает предельные значения нормы (соответственно в 6,8; 4,2 и 3,3 раза), что подтверждает выраженные нарушения проводимости разных групп нервных волокон. Установлено, что повреждению в бóльшей степени подвержены миелиновые волокна группы А-бета и А-дельта, являющиеся проводниками тактильной, температурной и некоторой болевой чувствительности (волокна А-дельта), в меньшей степени – безмиелиновые нервные волокна группы С, передающие сигналы от рецепторов давления, болевых и температурных рецепторов.
После проведенного лечения данные исследования порогов чувствительности кожи свидетельствуют о статистически достоверном восстановлении чувствительной функции НАН в иннервации кожных покровов в зависимости от методов применяемой комплексной терапии. Через 7 дней после лечения,
по данным оценки ПО, определено, что применение метода флюктуофореза 0,5 %-ного раствора ипидакрина позволяет снижать данный показатель на 32,1 % (p < 0,01), применение флюктуоризации – на 21,3 % (p < 0,01), использование стандартной медикаментозной терапии – на 15,5 % (p < 0,01).
По данным оценки ПБ выявлено снижение данного показателя на 35,8 % (p < 0,01) для основной группы, на 23,2 % (p < 0,01) – для группы сравнения и на 14,4 % (p < 0,01) – для контрольной группы.
По данным оценки УВБ установлено, что восстановление чувствительности волокон группы С в основной группе (на 41,3 %, p < 0,01) происходит более эффективно, чем в группе сравнения (на 27,1 %, p < 0,01) и в контрольной группе (на 13,3 %, p < 0,01).
При анализе порогов чувствительности в динамике отмечены следующие закономерности:
• после проведенного лечения (через 7 дней) в зависимости от вида применяемой терапии происходит значительное снижение показателей (в среднем на 36,4 % [p < 0,01]) в основной группы, на 23,9 % (p < 0,01) – в группе сравнения и на 14,4% (p < 0,01) – в контрольной группе;
• через месяц после лечения показатели снижаются в среднем на 13,2 % (p < 0,01) в основной группе, на 9,9 % (p < 0,05) – в группе сравнения и на 7,3 % (p < 0,05) – в контрольной группе;
• через 3 месяца – на 9,7 % (p < 0,05) в основной группе, на 7,3 % (p < 0,05) – в группе сравнения и на 5,7 % (p < 0,05) – в контрольной группе;
• через 6 месяцев – на 6,5 % (p < 0,05) в основной группе, на 6,1 % (p < 0,05) – в группе сравнения и на 4,6 % (p < 0,05) – в контрольной группе;
• через 12 месяцев – на 5,4 % (p < 0,05) в основной группе, на 4,7 % (p < 0,05) – в группе сравнения и на 3,9 % (p < 0,05) – в контрольной группе.
Эти данные свидетельствуют о сохранении интенсивности эффекта от применяемой терапии в зависимости от времени. Через месяц и более после лечения интенсивность эффекта от примененного лечения снижается, однако процессы реиннервации и ремиелинизации продолжаются в течение года, причем уровень активности указанных процессов в основной группе выше, чем в группах сравнения и контрольной.Полученные результаты биоимпедансной спектрометрии показали, что обследуемые пациенты с травматической невропатией НАН страдали нарушениями гидратации внеклеточной среды со статистически достоверным уменьшением показателя при частоте 5 кГц соответственно на 15 %
(p < 0,05) относительно предельных значений нормы (дегидратация). Показатели гидратации при частоте 20, 50 и 100 кГц не заходили за пределы нормы. Данные факты свидетельствуют о наличии дистрофических процессов в тканях пародонта, иннервируемых поврежденным нервом.
После проведенного лечения выявлено статистически достоверное увеличение уровня гидратации внеклеточной среды тканей пародонта. Через 7 дней после лечения у пациентов основной группы установлено увеличение уровня гидратации при частоте 5 кГц на 13,7 % (p < 0,05), через 1, 3, 6 и 12 месяцев уровень гидратации увеличился незначительно (рис. 1).
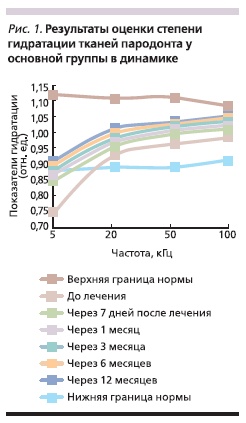
Через 7 дней после лечения у пациентов группы сравнения выявлено увеличение уровня гидратации при частоте 5 кГц на 9 % (p < 0,05), через 1, 3, 6 и 12 месяцев уровень гидратации внеклеточной среды увеличился незначительно (рис. 2).
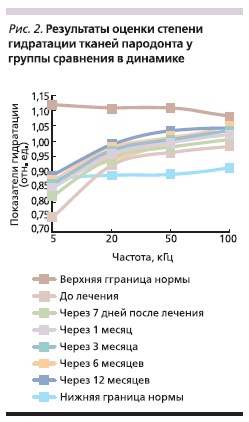
Через 7 дней после лечения у пациентов контрольной группы зафиксировано увеличение уровня гидратации при частоте 5 кГц на 5,4 % (p < 0,05), через 1, 3, 6 и 12 месяцев уровень гидратации
внеклеточной среды увеличился незначительно (рис. 3).
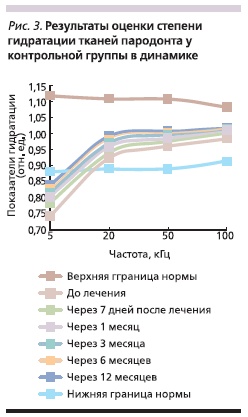
Заключение
Таким образом, по динамике порогов болевой чувствительности возможно определить степень нарушения проводимости нервного импульса в основных чувствительных группах волокон НАН, что позволяет оценить степень нарушения его функции. Применение комплексного лечения с курсом флюктуофореза ипидакрина позволяет восстановить функцию НАН в иннервации кожных покровов нижней губы и подбородочной области на 36,4 % (p < 0,01). Результаты исследований свидетельствуют о значимых изменениях степени гидратации тканей пародонта области, иннервируемой поврежденным НАН. Наиболее выраженные изменения происходят во внеклеточной среде и имеют тенденцию к дегидратации, что отражает дистрофические процессы в тканях. Комплексное лечение с применением метода сочетанной физикофармакологической терапии в виде
флюктуофореза ипидакрина позволяет улучшать нервную регуляцию и трофику тканей иннервируемой области, нормализовывать уровень гидратации тканей пародонта.


