Внебольничные инфекции дыхательных путей (ИДП) относятся к самым распространенным инфекционным заболеваниям. Наибольшее значение в структуре внебольничных бактериальных ИДП занимают острый средний отит (ОСО), острый бактериальный синусит (ОС), тонзиллофарингит и внебольничная пневмония (ВП).
При выборе антимикробного препарата (АМП) для лечения ИДП необходимо учитывать активность в отношении основных бактериальных возбудителей, вероятность наименьшего потенциала для селекции антибиотикорезистентных микроорганизмов, а также безопасность и доступность по цене [1].
В настоящее время успех антибиотикотерапии большинства инфекционных заболеваний существенно осложняется резистентностью возбудителей к АМП, что связано с широким и не всегда обоснованным использованием антибиотиков в клинической практике [2].
Основными типичными возбудителями ИДП являются Streptococcus pneumoniae, Streptococcuspyogenes, Haemophillusinfluenzae. Среди них наибольшее значение имеет распространение резистентных штаммов S. pneumoniae [2] Устойчивость S. pneumoniae к различным классам АМП отмечается во многих странах мира, но при этом уровни резистентности в значительной степени различаются. В исследовании PROTEKT устойчивость пневмококков к пенициллину составила в среднем 36,2 % с колебаниями от 3,9 % в Нидерландах до 81,0 % в Южной Корее. Высокий уровень устойчивости отмечен в Венгрии (64,9 %), Франции (62,0 %), Испании (53,4 %) и США (43,0 %). Чувствительность S. pneumoniae к цефалоспоринам II–III поколений в целом не отличалась от таковой к пенициллину [3]. Параллельно наблюдалось возрастание резистентности пневмококков к макролидным антибиотикам. По данным исследования PROTEKT, в целом устойчивость пневмококков к ним составляет около 30 % с колебаниями от < 5 % в скандинавских странах до высоких показателей (> 60 %) на юге Европы и Азии. Причем в большинстве стран резистентность пневмококков к макролидным антибиотикам оказалась выше, чем к пенициллину [4].
Однако для России эта проблема пока не актуальна. По данным мониторирования резистентности клинических штаммов S. pneumoniae в многоцентровом российском исследовании ПеГАС, доля устойчивых штаммов к пенициллину остается невысокой – 8,1–11,3 %. Хотя отмечено увеличение МПК90 S. pneumoniae с 0,06 мг/л (1999–2005) до 0,125 мг/л (2006–2009) [2]. В то же время следует отметить отсутствие проблемы макролидорезистентности пневмококков в России, т. к. фармакодинамическая активность макролидов in vitro сохраняется на относительно стабильном уровне, а доля нечувствительных штаммов не превышает 8,2 % для 14- и 15-членных макролидов и 6,3 % – для 16-членных с относительно постоянным значением МПК90. По данным PROTEKT и SAUCE-4, резистентность пневмококков к эритромицину в США составила 29,3 % [3], в Испании – 81,3 [5] и в Японии – 81,9 % [6].
В последнее время появилась информация о роли атипичных патогенов (Mycoplasma pneumoniae, Chlamydophila pneumoniae) в этиологии ИДП, особенно для лиц молодого возраста без сопутствующей патологии [7, 8] и детей [9]. Так, частота инфекции, вызванной C. pneumoniaeи M. pneumoniae, при острых респираторных инфекциях, составляет до 10 % (в среднем) во внеэпидемический период и может достигать 25–50 % во время эпидемических вспышек [7]. По данным польских исследователей, проанализировавших случаи рецидивирующих ИДП у 6335 детей в возрасте от 3 месяцев до 17 лет, M. pneumoniae была причиной 26,9 % обострений [10].
Макролидные антибиотики относятся к популярным АМП среди врачей всех специальностей, что связано с особенностями их фармакокинетических и фармакодинамических параметров, сочетающихся с хорошим профилем безопасности. Они являются альтернативой β-лактамным антибиотикам при лечении нетяжелых пневмококковых инфекций, в частности, у пациентов с аллергией на эти препараты [2].
Сегодня в России насчитывается более десяти зарегистрированных макролидов, среди которых обращает на себя внимание ранее широко использовавшийся, а сегодня незаслуженно забытый рокситромицин.
Рокситромицин – первый полусинтетический 14-членный макролид, разработанный фармацевтической компанией Hoechst Uclaf и появившийся на рынке в 1987 г. [11]. Рокситромицин обладает рядом особенностей, отличающих его от других представителей класса макролидов, прежде всего эритромицина, что позволяет рассматривать его в качестве клинически значимого АМП при лечении многих заболеваний [12].
Особенности клинической фармакологии рокситромицина
Рокситромицин – полусинтетическое производное природного эритромицина (эритромицина А), относится к 14-членным макролидам (класс IIa), включающим производные эритромицина А с замещением элементов лактонного кольца; другим представителем этого класса является кларитромицин. Отличие рокситромицина от эритромицина А в замене в 9-м положении кетогруппы этероксимной боковой цепью. По химической структуре рокситромицин представляет собой эритромицин-9-О-2-метоксиэтокси-метил оксим (рис. 1) 13].

Модификация лактонного кольца привела к появлению трех кардинальных отличий рокситромицина от эритромицина: расширение спектра антибактериальной активности за счет грамотрицательной флоры (H. influenzae, Neisseria spp. и некоторые другие грамотрицательные палочки); более высокая кислотоустойчивость и улучшенная всасываемость в желудочно-кишечном тракте (ЖКТ); способность создавать более высокие концентрации в клетках с увеличением продолжительности периода полувыведения [14].
Рокситромицин оказывает бактериостатическое действие за счет нарушения синтеза белка микробной клеткой. Это осуществляется путем связывания молекулы препарата с 50S-субъединицей рибосомы, точнее – с 23S РНК, что нарушает процесс транслокации пептидов. При этом рокситромицин в меньшей степени, нежели эритромицин, связывается с 23S РНК 50S-субъединицы рибосомы, а свою активность проявляет за счет создания более высоких внутриклеточных концентраций [15, 16].
Спектр антимикробной активности
Рокситромицин является типичным представителем 14-членных макролидов, в связи с чем спектр его активности приближается к таковому эритромицина, но при этом имеет ряд особенностей.
Рокситромицин активен в отношении Staphylococcus aureus (метициллиночувствительных штаммов – MSSA), S. pneumoniae, включая пенициллинорезистентные штаммы, β-гемолитического стрептококка группы А (БГСА). Зеленящие стрептококки малочувствительны к рокситромицину. Как и другие макролиды, рокситромицин не действует на энтерококки и метициллинорезистентные золотистые стафилококки (MRSA). Сравнительные данные по спектру активности рокситромицина и других макролидов в отношении этиологически значимых возбудителей ИДП приведены в табл. 1 [17,18].
Рокситромицин активен в отношении Listeria monocytogenes (МПК50 – 0,25 мг/л), Corynebacteriumdiphtheriae(МПК50 – 0,008 мг/л), Lactobacillusspp. (МПК50 – 0,06 мг/л). По уровню активности in vitro в отношении данных возбудителей рокситромицин уступает кларитромицину, но несколько превосходит азитромицин [15,17].
Рокситромицин высокоактивен в отношении Moraxella catarrhalis (МПК50 – 0,12 мг/л). По действию на Neisseria gonorrhoeae он несколько уступает эритромицину, кларитромицину и азитромицину (табл. 1) [17,18].
Примечание. У – устойчив.
Как и другие макролиды, рокситромицин активен в отношении Haemophilus ducreyi, Bordetella pertussis, Campylobacterjejuniи Gardnerellavaginalis. По активности в отношении Helicobacter pylori он превосходит эритромицин и азитромицин, практически не уступая кларитромицину. В отношении H. influenzае активность несколько ниже, чем у эритромицина, кларитромицина и азитромицина. Аналогично другим макролидамрокситромицин практически не действует на грамотрицательные бактерии семейств Enterobacteriaceae, Pseudomonasspp. и Acinetobacterspp. [17, 19, 20].
Рокситромицин высокоактивен in vitro в отношении M. pneumoniae, S. pneumoniaeи Legionellaspp., превосходит эритромицин и доксициклин по действию на Chlamydia trachomatis и Ureaplasma urealyticum и имеет сходный с азитромицином уровень активности в отношении C. trachomatis. Как и другие макролиды, рокситромицин малоактивен в отношении Mycoplasma hominis. По активности в отношении Legionella pneumophila не отличается от азитромицина и кларитромицина [17, 21, 22].
По сравнению с эритромицином рокситромицин лучше действует на Mycobacterium avium. В отношении Mycobacterium leprae нет данных об активности in vitro, поскольку получить чистую культуру этого микроорганизма не представляется возможным. Согласно результатам экспериментов на животных, рокситромицин превосходит по активности азитромицин, но уступает кларитромицину [17].
Рокситромицин активен in vitro в отношении Treponema pallidum, что было подтверждено в исследованиях на животных [23]. В отношении боррелий действие рокситромицина варьируется в зависимости от вида: он наиболее активен в отношении B. garinii (МПК50 – 0,01 мг/л) и B. burgdorferisensulato(МПК50 – 0,06 мг/л) [17].
Рокситромицин, как и другие макролиды, проявляет активность в отношении Porphyromonasspp., Propionibacteriumspp. и Fusobacteriumspp. В то же время такие клинически значимые представители анаэробной флоры, как Bacteroides fragilis и Clostridium difficile, устойчивы ко всем макролидам [17, 24].
Рокситромицин является одним из немногих макролидов, активных в отношении Toxoplasma gondii и Cryptosporidiumspp. Он подавляет invitroтахизоиты T. gondii, однако выраженный эффект достигается только при высоких концентрациях препарата [17, 25, 26].
Фармакокинетические особенности рокситромицина
По сравнению с эритромицином рокситромицин более устойчив к действию соляной кислоты, в связи с чем лучше и быстрее всасывается в ЖКТ и имеет более высокую биодоступность при приеме внутрь. Пища, как правило, не влияет на полноту абсорбции рокситромицина, но может замедлять ее скорость [27]. Существенная фармакокинетическая особенность рокситромицина проявляется достижением наиболее высоких по сравнению с другими макролидными антибиотиками концентраций в крови. Максимальный уровень в плазме после перорального приема в дозе 150 мг наблюдается через 2 часа и достигает в среднем 6,6–7,9 мг/л [28]. Путем прямого сравнения установлено, что площадь под фармакокинетической кривой (ПФК) при приеме 150 мг рокситромицина в 16,2 раза превышает таковую после приема 250 мг эритромицина. Аналогичные различия отмечаются и при многократных приемах этих АМП. Сравнительные исследования фармакокинетических параметров рокситромицина и трех других макролидов, подтвердившие его преимущества, были проведены в Японии (табл. 2). Высокие уровни рокситромицина в крови регистрируются и у детей. Через 1–2 часа после перорального приема антибиотика в дозе 2,5 мг/кг концентрации в плазме достигают величин порядка 10 мг/л, причем они не зависят от возраста [29].
Примечание. Сmax – максимальная концентрация в крови, Тmax– время достижения максимальной концентрации, Т1/2 – период полувыведения.
Рокситромицин характеризуется высокой степенью связывания с белками плазмы (в основном с α1-кислым гликопротеином) – около 96 %. Плазменный клиренс антибиотика зависит от его дозы и содержания белка в плазме. Препарат хорошо распределяется в организме, но практически не проникает в ликвор. Высокие концентрации рокситромицина, сопоставимые с уровнем его в плазме и превышающие МПК90 для чувствительных микроорганизмов, создаются в миндалинах, легких, придаточных пазухах носа, слезной жидкости, предстательной железе, миометрии, эндометрии, синовиальной жидкости, коже, а также в других органах и средах. У детей высокие уровни рокситромицина как после однократного приема (2,5 мг/кг), так при курсовом назначении (2,5 мг/кг 2 раза в день) определяются в миндалинах, аденоидах и экссудате среднего уха [30].
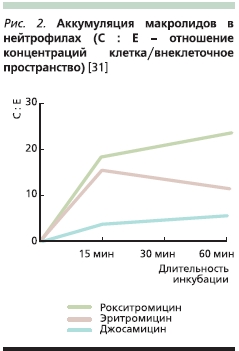
Рокситромицин способен аккумулироваться в нейтрофилах (рис. 2) [31], при этом соотношение концентраций антибиотика в их цитоплазме и внеклеточной жидкости составляет 21,9 (джозамицина – 15,5 и эритромицина – 6,6). Накопление рокситромицина отмечается также и в альвеолярных макрофагах. По степени аккумуляции в нейтрофилах рокситромицин превосходит, в частности, эритромицин и джозамицин [31].
Рокситромицин почти не подвергается биотрансформации в организме. Только 5 % введенной в организм дозы экскретируется в метаболизированном виде. Значительная часть препарата выделяется через ЖКТ, от 7 до 10 % (включая метаболиты) – с мочой. Кроме того, до 15 % его количества может элиминироваться через легкие. В исследованиях на здоровых добровольцах выявлено, что почечный клиренс рокситромицина возрастает при увеличении дозы со 150 до 450 мг. У пожилых лиц выведение препарата через почки снижено [29].
T1/2 для взрослых в среднем составляет 8–10 часов (что значительно больше, чем у эритромицина) и может увеличиваться до 15 часов при выраженной почечной недостаточности (клиренс креатинина < 10 мл/мин), но специальной коррекции дозы в этом случае не требуется. Поскольку рокситромицин не удаляется из организма во время гемодиализа, никакие изменения режима его дозирования больным, находящимся на диализе, не производятся [29]. Длительность T1/2 может значительно увеличиваться для больных циррозом печени, и в этом случае требуется 50 %-ное снижение дозы антибиотика [32]. У детей T1/2, как правило, имеет большую, чем у взрослых, продолжительность, – до 20 часов [30].
Безопасность рокситромицина
Макролиды рассматриваются как одна из самых безопасных групп лекарственных средств, а рокситромицин отличается наилучшей переносимостью среди макролидов, что является одним из важнейших его достоинств [12]. Нежелательные лекарственные реакции развиваются только у 3–4 % пациентов. Как правило, это симптомы со стороны ЖКТ (< 80 %) – абдоминальные боли, тошнота, диарея. Лучшая переносимость рокситромицина по сравнению с эритромицином безусловно связана со значительно менее выраженным влиянием на кишечную флору и моторику ЖКТ. Рокситромицин очень редко вызывает аллергию, может использоваться больными бронхиальной астмой и другими заболеваниями аллергической природы. У отдельных пациентов возможно появление головных болей, головокружения, сыпи, лимфоцитопении, эозинофилии, обратимых отклонений в показателях активности печеночных ферментов и глюкозы сыворотки крови. Описаны единичные случаи развития холестатического гепатита и один эпизод острого гепатита [15].
Макролиды, в частности эритромицин и рокситромицин, плохо проникают через плаценту и поэтому создают низкие концентрации в кровотоке плода – 3,0 и 2,6 % соответственно от концентрации в крови матери. В то же время уровень кларитромицина достигает 6,1 % от концентрации в крови матери [33]. В крупном клиническом исследовании не было выявлено статистически значимого повышения частоты встречаемости аномалий развития при использовании рокситромицина беременными, тогда как применение олеандомицина ассоциировалось с трехкратным повышением риска рождения незрелого плода [34].
Особенности клинического применения рокситромицина
Основной областью применения рокситромицина являются ИДП. Кроме того, как и другие макролиды, препарат может применяться при инфекциях кожи и мягких тканей, а также при ородентальных и урогенитальных инфекциях. Обычная доза рокситромицина составляет 300 мг в день. Согласно данным проведенного клинического исследования, эффективность антибиотика одинаково высока независимо от того, назначается ли он в 1 или в 2 (по 150 мг) приема (табл. 3) [35].
* Выделены следующие патогены: S. pyogenes (103 штамма), S. pneumoniae (148 штаммов), S. aureus (105 штаммов), S. epidermidis (1 штамм), H. influenzae (30 штаммов), M. catarrhalis (12 штаммов).
В настоящее время рокситромицин официально одобрен для терапии инфекций верхних и нижних отделов дыхательных путей, инфекций кожи и мягких тканей, урогенитальных и ородентальных инфекций [36, 37].
Высокая эффективность рокситромицина при лечении инфекций дыхательных путей подтверждена результатами многих рандомизированных клинических исследований. Так, клиническая эффективность рокситромицина, назначенного 10-дневным курсом, была сопоставимой с таковой β-лактамов (амоксициллина/ клавуланата, цефаклора) и других макролидов (азитромицина, кларитромицина) при лечении острого фарингита, тонзиллита, ОС и ОСО [38–41]. Согласно данным N.C. Karalus и соавт. (1995), рокситромицин по эффективности не отличается от амоксициллина/клавуланата при респираторных инфекциях различной локализации, но лучше переносится [42]. В другом клиническом исследовании эффективность рокситромицина, назначенного однократно (300 мг/сут) 100 пациентам с ОСО (85 %), тонзиллофарингитом (31 %) и ОС (11 %), сравнивалась с амоксициллином/клавуланатом (1,0 г 2 раза в сутки).
По окончании терапии эффективность лечения рокситромицином составила 82 %, амоксициллином/клавуланатом – 78 % [43].
При обострении хронического бронхита клиническая эффективность рокситромицина не отличалась от таковой доксициклина – 81 и 80 % соответственно [44].
В крупном международном открытом исследовании с участием 40 тыс. пациентов терапия рокситромицином продолжительностью от 7 до 14 дней сопровождалась клиническим эффектом более чем для 95 % больных с инфекциями верхних и нижних отделов дыхательных путей (выздоровление или улучшение). При этом частота отмеченных нежелательных явлений не превышала 4 % [45].
Как и другие макролиды, рокситромицин успешно используется при лечении ВП. Проведено множество сравнительных клинических исследований, в которых было установлено, что выраженность клинического эффекта препарата при данном заболевании практически такая же, как у других макролидов – эритромицина, мидекамицина; пенициллинов – амоксициллина, амоксициллина/клавуланата; пероральных цефалоспоринов – цефрадина, цефиксима, а также доксициклина и ципрофлоксацина (табл. 4).
* Бактериологические исследования проводились не всем больным. НД – нет данных.
По клинической эффективности при лечении атипичной пневмонии рокситромицин сопоставим с азитромицином и кларитромицином [46–48]. Согласно данным фармакоэкономического исследования, рокситромицин при инфекциях нижних дыхательных путей предпочтительней амоксициллина/клавуланата, если оценивать данные препараты по критерию стоимость–эффективность [49].
Эффективность рокситромицина в педиатрии
По данным международного многоцентрового исследования, в котором приняли участие 205 детей, было установлено, что рокситромицин эффективен при лечении тонзиллита, фарингита, суперинфицированного ринофарингита, пневмококковой пневмонии, а также импетиго и пиодермии. Препарат назначался из расчета 6 мг/кг/сут в течение 8 дней. Клиническое выздоровление отмечено в 87,5–100 % случаев с высокой степенью эрадикации БГСА, S. pneumoniae, S. aureus, H. influenzaeи М. рnеumoniae[50]. В ряде других исследований показана высокая клиническая эффективность рокситромицина при инфекциях верхних и нижних отделов дыхательных путей – ОСО (91–96 %), пневмонии и фарингите (100 %) [51–53]. Для детей с ВП, средний возраст которых составил 9,4 года, клиническая эффективность рокситромицина в дозе 5 мг/кг/сут в 2 приема оказалась выше (100 %), чем амоксициллина (95 %) [54]. Согласно результатам рандомизированного клинического исследования, при инфекциях нижних дыхательных путей рокситромицин в дозе 5–8 мг/кг/сут в 2 приема по клинической эффективности не уступает (96 %) эритромицина этилсукцинату [55]. Эффективность рокситромицина для детей с ОСО оказалась одинаково высокой при применении как 2, так и 1 раз в сутки. Детям с массой тела менее 10 кг рокситромицин назначался в дозе 5 мг/кг/сут, более 10 кг – 10 мг/кг/сут [56].
В России Г.А. Самсыгиной (2000) было проведено сравнительное контролируемое параллельное исследование клинической эффективности двух макролидных антибиотиков: рокситромицина (Рулид) и спирамицина (Ровамицин), для 82 детей, 40 из которых получали спирамицин, 42 – рокситромицин. Во всех случаях были диагностированы бронхит бактериальной этиологии или нетяжелая сегментарная, или полисегментарная бронхопневмония. Клиническая эффективность изучаемых препаратов составила 92,8 и 92,5 % соответственно. Отсутствие клинического эффекта при применении этих макролидов также оказалось идентичным по частоте (4,8 % для рокситромицина и 5,0 % для спирамицина; p > 0,05) [56].
В настоящее время в России на фармацевтическом рынке присутствует препарат рокситромицина (Эспарокси), производителем которого является фармацевтическая компания Линдофарм ГмбХ (Германия) [13], биоэквивалентный оригинальному препарату, активно применяется в Германии и отличается доступной ценой. Препарат выпускается в форме таблеток по 150 мг. Разрешен к применению взрослыми и детьми старше 12 лет с массой тела более 40 кг. Режим дозирования: 150 мг 2 раза в сутки или 300 мг однократно.



