В настоящее время фибрилляция предсердий (ФП) является наиболее распространенным нарушением ритма – до 2 % населения развитых стран страдают этим видом аритмии. В связи с постарением населения к 2050 г. прогнозируется увеличение числа больных ФП в 2 раза. На фоне ФП риск инсульта повышается в 5 раз, а смертность – примерно в 2 раза. За последние 20 лет количество госпитализаций по поводу ФП увеличилось более чем в 2 раза.
Всероссийское научное общество кардиологов и Всероссийское научное общество аритмологов в 2011 г. приняли новые Национальные рекомендации по диагностике и лечению фибрилляции предсердий [1]. Одним из основных антиаритмических препаратов (ААП), используемых в лечении этой категории больных, является амиодарон. Это один из наиболее изученных лекарственных препаратов, эффективность которого доказана более чем в 30 клинических исследованиях с участием около 25 тыс. пациентов. Амиодарон показан к профилактикие и купированию пароксизмов ФП, особенно для пациентов с органическими заболеваниями сердца (IA). Для больных хронической сердечной недостаточностью (ХСН) III–IV функциональных классов (ФК) или нестабильной ХСН II ФК амиодарон
в настоящее время является препаратом выбора (IB). При сочетании ФП и желудочковых аритмий также отдается предпочтение терапии амиодароном. Кроме того, амиодарон можно вводить внутривенно пациентам с ФП в остром периоде инфаркта миокарда для контроля частоты сердечных
сокращений и улучшения гемодинамики. После успешных катетерных абляций легочных вен амиодарон назначают существенно чаще прочих препаратов (пропафенона, соталола, флекаинида). Таким образом, можно констатировать, что при лечении ФП амиодарон во многих клинических ситуациях является препаратом выбора [1, 2]. Не менее важная роль отводится амиодарону в рекомендациях по профилактике внезапной смерти [3].Амиодарон был открыт Tondeur и Binon в 1960 г. как антиишемическое средство, а первое сообщение о его антиаритмическом действии появилось
в 1969 г. Препарат является представителем III класса ААП в классификации Vaughan Williams (1992), отличается способностью удлинять интервал QT за счет увеличения продолжительности потенциала действия и рефрактерности миокарда. Амиодарон является не только самым эффективным, но и
наиболее безопасным в плане развития проаритмических эффектов (после β-адреноблокаторов) препаратом: частота возникновения желудочковой тахикардии типа “пируэт” на фоне приема амиодарона составляет менее 1 %, в то время как у соталола гидрохлорида достигает 4–5 %, а некоторых препаратов I С класса – 20 % [4]. Удлинение интервала QT на 15 % и более с появлением зубца U при применении амиодарона является одним из предикторов эффективности препарата.
Основной недостаток амиодарона – развитие достаточно большого числа экстракардиальных побочных эффектов, таких как фотосенсибилизация, изменение цвета кожи, повышение активности трансаминаз, периферические невропатии, мышечная слабость, тремор, атаксия, нарушения зрения.
Частота встречаемости этих эффектов достигает 10–52 % [5]. Практически все эти побочные эффекты обратимы и исчезают после отмены или при уменьшении дозы амиодарона.
Наиболее клинически значимым экстракардиальным побочным эффектом амиодарона считается нарушение функции щитовидной железы, которое наблюдается в 10–25 % случаев [6, 7] и значительно ограничивает область его использования лицами с патологией щитовидной железы. В первую очередь это связано с тем, что в 1 таблетке, содержащей 200 мг амиодарона, находится 75 мг йода. Пациенты, принимающие амиодарон, постоянно испытывают влияние избытка йода на щитовидную железу. Физиологической нормой йода является 100–200 мкг/ сут, следовательно, в 1 таблетке амиодарона содержится до 375 суточных физиологических доз йода [8].
Еще один важный момент – длительный период полувыведения. В среднем ежедневно высвобождается
9 мг неорганического йода, с которым и связывают йодную нагрузку. Предполагается, что избыток йода, высвобождаемый при метаболизме амиодарона, может приводить к индукции или манифестации аутоиммунных изменений в щитовидной железе. Риск тиреотоксического действия зависит
от возраста пациента и длительности приема препарата. У детей он повышен в 2 раза, у подростков – в 5, в возрасте старше 50 лет – в 3, старше 70 лет – в 6, при суточной дозе более 400 мг – в 8, при длительности приема более 3 лет – в 12, при исходной патологии щитовидной железы – в 19 раз.
Амиодарон снижает чувствительность клеток, особенно кардиомиоцитов, к тиреоидным гормонам, приводя к “местному” тканевому гипотиреозу [9]. Развитию этого состояния способствуют взаимодействие амиодарона с рецепторами тиреоидных гормонов, сокращение числа катехоламиновых рецепторов и снижение эффекта трийодтиронина (ТЗ) на кардиомиоциты.
На клеточном уровне амиодарон действует как антагонист тиреоидных гормонов [6]. Снижение проникновения Т3 в кардиомиоциты оказывает антиаритмический эффект за счет изменения экспрессии генов ионных каналов и других функциональных белков (рис. 1).
Рисунок 1. Кардиомиоцит: точки приложения T3 (F. Epstein).
Согласно рекомендациям, в процессе лечения амиодароном необходимо не реже 1 раза в 6 месяцев мониторировать функцию щитовидной железы. Традиционно при выявлении отклонения от нормы одного из показателей (тиреотропного гормона – ТТГ, свободного тироксина – свТ4, Т3) препарат, как правило, отменяют и больные зачастую остаются без эффективной антиаритмической терапии.
Альтернативу амиодарону в таких клинических ситуациях найти достаточно сложно, а подчас и невозможно. При наличии фракции выброса (ФВ) меньше 30–35 % больному нужно предложить имплантацию кардиовертерадефибриллятора (ИКД), что в условиях отечественного здравоохранения возможно далеко не всегда. Например, в США в 2006 г. было имплантировано 390 ИКД на 1 млн населения, в Италии – 133, в Польше – 4, в то время как в России – всего 1,5 на 1 млн насе-ления [10].
Однако выявление дисфункции щитовидной железы, вызываемой амиодароном, не всегда требует
отмены последнего. Алгоритм ведения больных в подобных ситуациях в отечественной литературе описан мало. Н.Ю. Свириденко и соавт. [11] установлено, что среди трети пациентов в процессе лечения амиодароном наблюдается повышение уровня общего и свободного Т4, реверсивного
(неактивного) Т3 (рТ3), уменьшение уровня Т3. Это обусловлено подавлением активности 5-дейодиназы I типа, нарушающей конверсию Т4 в Т3 в периферических тканях, особенно в печени. Подавление активности 5-дейодиназы может сохраняться на протяжении нескольких месяцев и
после отмены препарата. Кроме того, препарат снижает проникновение тиреоидных гормонов в клетки периферических тканей. В конечном итоге оба механизма способствуют развитию повышенных уровней общего и свободного Т4, рТ3 с нормальным или субнормальным уровнем Т3. Несмотря
на повышенный уровень свТ4, признаков тиреотоксикоза у пациентов не отмечено (рис. 2).
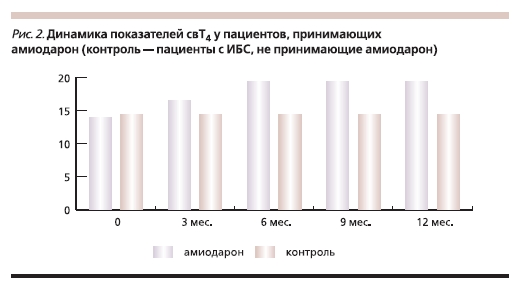
Эутиреоидная гипертироксинемия не требует медикаментозной коррекции, а диагноз тиреотоксикоза не должен основываться на одном только обнаружении повышенного уровня тироксина у больных, получающих амиодарон [12]. В процессе лечения амиодароном у ряда больных может произойти изменение уровня ТТГ в сыворотке крови без клинических проявлений нарушения функции щитовидной железы. Повышение концентрации ТТГ у клинически эутиреоидных пациентов зависит как от дозы, так и от длительности приема препарата. Так, при ежедневном приеме 200–400 мг амиодарона уровень ТТГ обычно находится в пределах нормы [11]. При более высокой дозе препарата увеличение концентрации ТТГ может произойти в первые месяцы приема с последующим возвращением к норме.
Амиодарон-ассоциированная дисфункция щитовидной
железы
Длительный прием амиодарона в высоких дозах может приводить как к гипотиреозу, так и к тиреотоксикозу. Возникновение гипотиреоза объясняется длительным блоком органификации йода и нарушением синтеза тиреоидных гормонов (эффект Вольфа–Чайкова), а также ингибированием
тиреоидных рецепторов в тканях. Распространенность гипотиреоза на фоне приема амиодарона варьируется от 6 % в странах с низким потреблением йода до 13 % – с высоким потреблением йода. Гипотиреоз наиболее часто встречается среди пожилых людей, чаще у женщин (соотношение полов –
1,5 : 1,0).
В клинической картине отмечаются классические признаки гипотиреоза (утомляемость, сухость кожи,
зябкость, запоры, сонливость, ухудшение внимания, отечный синдром, брадиаритмии). Субклинический
вариант протекает бессимптомно, но возможны нарушение липидного обмена, ухудшение памяти, депрессия. Диагностика этого состояния основана на определении сниженного уровня свТ4 и повышенного ТТГ (обычно >10 мЕд/л) или нормального уровня свТ4 при повышенном уровне ТТГ
при субклиническом варианте течения. Уровень Т3 не является надежным индикатором, т. к. при гипо-
тиреозе он может быть в пределах нормы или даже несколько повышен в результате компенсаторного дейодирования Т4 в биологически более активный Т3.
Лечение амиодарон-ассоциированного гипотиреоза
После отмены амиодарона эутиреоз восстанавливается, однако это длительный процесс, т. к. период полувыведения амиодарона составляет от 30 дней. Вместе с тем, если из-за тяжести состояния пациента отмена амиодарона невозможна, лечение им продолжают с одновременным назначением L-тироксина. Рекомендуется начинать заместительную терапию с минимальных доз (12,5–25 мкг/сут) с
постепенным повышением под контролем уровня ТТГ с интервалом в 4–6 недель до достижения необходимого эффекта. Пожилым пациентам с сопутствующей сердечной недостаточностью целесообразно начинать лечение L-тироксином с минимальных доз (6,5–12,5 мкг/сут). При субклиническом течении гипотиреоза вопрос о заместительной терапии решается индивидуально. Если уровень ТТГ не превышает 10 мЕД/л, относительным показанием к назначению L-тироксина с использованием минимально эффективных доз и хорошей переносимостью препарата является наличие зоба (увеличения объема щитовидной железы у женщин свыше 18 мл, у мужчин свыше 25 мл)
и дислипидемии. В остальных случаях проводится динамическое наблюдение с определением ТТГ 1 раз в 6 месяцев и ультразвуковое исследование (УЗИ) щитовидной железы 1 раз в год. Назначение L-тироксина может быть показано при сопутствующем нарушении липидного профиля, депрессии,
повышении уровня ТТГ более чем на 10 мЕД/л [13].
Тиреотоксикоз может развиваться через 2–3 года от момента приема препарата. В клинической картине доминируют симптомы со стороны сердечно-сосудистой системы (ухудшение течения аритмий, обострение ишемической болезни сердца) и психические расстройства (нарушение сна,
слабость, депрессия), что может затруднять диагностику. Для лиц пожилого возраста симптомы тиреотоксикоза, как правило, незначительны или отсутствуют. Необходимо обратить внимание на то, что в большинстве проведенных исследований основным и наиболее ранним проявлением амиодаронассоциированного тиреотоксикоза (АмАТ) стала потеря антиаритмической эффективности амиодарона.
В основе патогенеза тиреотоксикоза, развивающегося на фоне приема амиодарона, лежат два основных механизма, приводящих к формированию двух вариантов АмАТ:
АмАТ I типа обусловлен повышением синтеза тиреоидных гормонов в существующих зонах автономии в
железе под действием йода, высвобождаемого из препарата. АмАТ I типа развивается в основном у лиц с исходной патологией щитовидной железы, включая узловой зоб, автономию или диффузный токсический зоб; при УЗИ отмечаются признаки узлового или аутоиммунного зоба с нормальным
или повышенным кровотоком.
АмАТ II типа, описанный у пациентов без предшествующих или сопутствующих заболеваний щитовидной железы, связан с развитием деструктивных процессов, причиной которых является не только действие йода, но и непосредственное влияние самого амиодарона (т. е. форма лекарственного тиреоидита). Главная клиническая особенность этих форм – внезапное развитие и тяжелое течение тиреотоксикоза с развитием болевых форм, клинически похожих на подострый тиреоидит. При исследовании с радиоактивным йодом отмечается снижение накопления препарата в
железе. В биоптате щитовидной железы существует масса коллоида и деструкция тиреоцитов. Часто наблюдается отсутствие или снижение кровотока в щитовидной железе, определяемое при УЗИ с цветным допплеровским картированием. Встречаются также смешанные варианты течения с черта-
ми АмАТ I и II типов.
Лечение АмАТ, как правило, сопряжено с определенными трудностями и требует индивидуального подхода в каждом случае. У пациентов с легким тиреотоксикозом, исходно неизмененной щитовидной железой и небольшим зобом тиреотоксикоз устраняется после отмены препарата. Если отмена амиодарона невозможна, лечение тиреотоксикоза проводят на фоне приема амиодарона. Назначают тионамиды, пропилтиоурацил, высокие дозы глюкокортикоидов. За рубежом используют конкурентный ингибитор захвата йода щитовидной железой – перхлорат калия.
Для компенсации тиреотоксикоза требуются большие дозы антитиреоидных препаратов (например, тиамазола 40–60 мг или пропилтиоурацила 300–600 мг). Для нормализации уровня свТ4 может потребоваться 6–12 и более недель. Лечение тиреотоксикоза рекомендуется продолжать не менее 2 лет. Некоторые исследователи предпочитают проводить терапию поддерживающими дозами тиреостатиков с целью сохранения полного или частичного блока синтеза тиреоидных гормонов в
течение всего периода терапии амиодароном. В случае развития гипотиреоза к лечению добавляется L-тироксин.
В основе патогенеза АмАТ II типа, особенно возникшего у лиц без предшествующих изменений щитовидной железы, лежит развитие деструктивного тиреоидита и выход ранее синтезированных гормонов в кровоток. В такой ситуации показаны глюкокортикоиды. Преднизолон назначают в
дозе 30–40 мг/сут. Курс лечения может продолжаться до 3 месяцев. В случае развития гипотиреоза к лечению добавляют L-тироксин. По показаниям к проводимой терапии добавляют β-адреноблокаторы, нестероидные противовоспалительные и другие симптоматические средства.
При тяжелом течении АмАТ, особенно при сочетании двух форм, используют комбинацию тионамида и глюкокортикоида. Если комбинированная лекарственная терапия неэффективна, может потребоваться хирургическое вмешательство (субтотальная резекция щитовидной железы). Оперативное лечение проводится в случае невозможности достижения компенсации заболевания после длительного (около 6 месяцев) курса медикаментозной терапии или при сочетании АмАТ с
узловым зобом. В качестве подготовки к операции в тяжелых случаях назначается плазмаферез, после чего проводится хирургическое лечение.
Радиоактивный йод обычно неэффективен в лечении пациентов с АмАТ, т. к. большая концентрация йода предотвращает достаточное поглощение щитовидной железой радиоизотопа. Кроме того, это может приводить к усилению тиреотоксикоза в результате высвобождения гормонов. Однако пациенты с диффузным или узловым зобом, у которых наблюдается нормальное или повышенное поглощение радиоизотопа, несмотря на прием амиодарона, могут отвечать на терапию радиоактивным йодом.
Амиодарон назначают при тяжелых, жизнеугрожающих аритмиях, часто рефрактерных к другой терапии. Отмена препарата в такой ситуации может быть недопустимой по жизненным показаниям. В литературе описаны случаи успешного ведения пациентов с тиреотоксикозом без отмены амиодарона, поэтому в каждом конкретном случае решение о смене антиаритмического препарата должно приниматься индивидуально, совместно кардиологом и эндокринологом. Ряд авторов предполагают, что даже в тех случаях, когда планируется отмена препарата, пациенты должны принимать амиодарон, пока тиреотоксикоз не будет полностью компенсирован.
Практикующие врачи, назначающие амиодарон, должны соблюдать следующий алгоритм обследования пациента: определение ТТГ с последующей консультацией эндокринолога; при измененном уровне ТТГ – уровень свТ4; определение антител к тиреоидной пероксидазе; УЗИ щитовидной железы; сцинтиграфия щитовидной железы при наличии узлового зоба, снижении
уровня ТТГ (подозрение на автономию); пункционная биопсия щитовидной железы (при наличии узлов, подозрении на новообразование).
Повторное определение уровня свТ4, ТТГ можно повторять через 3 месяца от начала терапии, а затем через каждые 6 месяцев. При нормальных показателях мониторинг осуществляется по уровню ТТГ 1–2 раза в год. Ухудшение течения предшествующей аритмии, частичная утрата антиаритмической активности амиодарона должны настораживать кардиолога и направлять его поиск на выяснение возможной эндокринной причины неэффективности лечения.
Важным аспектом рассматриваемой темы является установленная зависимость между развитием вышеописанных осложнений и применением генерических форм амиодарона.
Исследование С.Г. Канорского [14] выявило увеличение частоты рецидивов мерцания предсердий в 12 раз при замене оригинального амиодарона на его генерики. В США и Канаде ежегодно регистрируется около 20 тыс. госпитализаций, которые являются следствием замены амиодарона на
генерические копии [15]. Эти факты необходимо учитывать при выборе между оригинальным и генерическим амиодароном.
Таким образом, в настоящее время амиодарон является препаратом выбора во многих клинических ситуациях. Применение амиодарона может вызывать нарушение функционирования щитовидной железы, однако вопрос об его отмене или продолжении лечения должен решаться индивидуально для
каждого пациента. Клинический опыт показывает, что в большинстве случаев выбор может быть сделан в пользу продолжения лечения оригинальным лекарственным средством. Развитие амиодарон-ассоциированного гипотиреоза и эутиреоидной гипертироксинемии не сопровождается потерей
антиаритмической активности препарата, а его компенсация L-тироксином – возобновлением нарушений ритма. Развитие амиодарон-ассоциированного гипертиреоза сопряжено с потерей
антиаритмической активности препарата, а его коррекция – с восстановлением этого эффекта.


