Лечение больных местнораспространенным первично неоперабельным раком прямой кишки (РПК) представляет собой одну из наиболее сложных проблем онкопроктологии. Возможность
удаления опухоли является основным фактором прогноза этих пациентов, и долгое время успех их лечения определялся только мастерством оперирующего хирурга. Развитие комбинированной химиолучевой терапии в дополнение к хирургическому методу кардинальным образом изменило тактику ведения таких больных. Возможность достижения значительного регресса опухоли сделала предоперационный этап лечения при местнораспространенном РПК особенно важным, зачастую определяющим успех дальнейшего лечения. Неоадьювантная терапия не только может повышать
частоту R0-резекций у исходно сомнительно операбельных пациентов, но и позволяет уменьшать объем оперативных вмешательств в пользу менее травматичных, снижать риск развития рецидива заболевания [1, 2].
Сам термин “операбельность” подразумевает значительную субъективность критериев включения пациентов в эту группу, что делает его применение в рамках научных исследований нежелательным. Предложенные рядом авторов диагностические параметры и классификации не нашли широкого
применения в клинической практике и в ряде случаев лишь отражали новые субъективные методы оценки (например, подвижность опухоли) [3–5]. Термин “неоперабельный/нерезектабельный РПК” широко распространился как в отечественной, так и в западной литературе, несмотря на значительные разночтения в его трактовке и практическую невозможность объективного сравнения опыта различных клиник. В связи с этим большой интерес представляют клинические исследования, основанные на опыте работы одних и тех же клиник с использованием различных схем комбинированного лечения. Использование единых критериев включения больных, сравнимое качество хирургического лечения и сопроводительной терапии позволяют более объективно оценивать вклад современных методов химио- и лучевой терапии в лечение данной категории пациентов.
Целью данного исследования было проведение сравнительного анализа результатов двух вариантов комплексного лечения больных местнораспространенным первично неоперабельным РПК, использовавшихся в отделении проктологии РОНЦ им. Н.Н. Блохина с 2002 по 2006-й и с 2006 по 2011 г.
Материал и методы
Пациенты
В исследование включали только больных первично неоперабельным местно-распространенным РПК
Т4NxM0. Все опухоли были исходно иммобильными, инфильтрировали стенки таза, крестец или магистральные сосуды. Другими критериями включения были общий статус по шкале Карновского 80 и выше, отсутствие отдаленных метастазов и метахронных злокачественных новообразований.
В обязательную программу обследования входило проведение пальцевого ректального исследования, колоноскопии, ирригографии, трансректального ультразвукового исследования, компьютерной томографии (КТ) органов грудной и брюшной полостей с внутривенным контрастированием, КТ или магнитно-резонансная томография органов малого таза, рентгенографии легких, определение уровней маркеров РЭА и СА 19.9.
Результаты лечения в группе А анализировали ретроспективно и основывались на опыте отделения за 2002–2006 гг. Результаты лечения в группе Б анализировали проспективно с 2006 по 2011 г. Общие данные об исследуемых группах представлены в табл. 1.
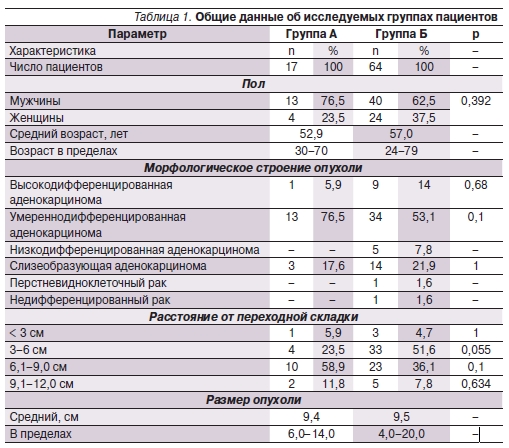
Таким образом, исследуемые группы были сопоставимыми по всем параметрам, за исключением того, что в группе Б отмечена выраженная тенденция к преобладанию прогностически неблагопиятных опухолей дистальной локализации.
Схемы лечения
Пациентам группы А проведена неоадьювантная терморадиохимиотерапия, включившая лучевую терапию (РОД 4 Гр, СОД 36 Гр) на фоне применения фторурацила 750 мг/м2 в 1-й и 3-й дни, недели 1–3; цисплатина 15 мг/м2 в 2-й и 4-й дни, недели 1–3; 3 сеансов локальной гипертермии в течение курса лечения. Попытка хирургического лечения осуществлена через 4–6 недель после окончания
неоадьювантного лечения.
В качестве премедикации перед введением цисплатина использован ондансентрон 8 мг внутривенно и дексаметазон 8 мг внутривенно, кроме того, после введения препарата осуществлена водная нагрузка: 1600 мл 0,9 %-ного раствора NaCl внутривенно.
В группе Б использована оригинальная схема комплексного лечения, разработанная РОНЦ, включающая лучевую терапию, химиотерапию капецитабином и оксалиплатином, локальную гипертермию и использование метронидазола для локального применения в составе полимерной композиции (патент РФ № 2414936; рис. 1).
Рисунок 1. Схема лечения местно-распространенного первично-неоперабельного рака прямой кишки (патент РФ №2414936).
Пациенты получали капецитабин в дозе 650 мг/м2 2 раза в день перорально в течение всего курса лучевой терапии. На 3-й, 10-й и 17-й дни лечения проведена внутривенная инфузия окса-
липлатина в дозе 50 мг/м2. В качестве премедикации использован ондансентрон 8 мг внутривенно и дексаметазон 8 мг внутривенно. Метронидазол в составе полимерной композиции в концентрации 10 мг/м2 введен внутриректально во время первого и третьего сеансов локальной гипертермии с экспозицией 5 часов перед сеансом лучевой терапии. Хирургическое лечение состоялось через 6–8 недель после окончания курса лучевой терапии.
Методика проведения лучевой терапии и локальной гипертермии
Дистанционная лучевая терапия проведена на линейных ускорителях фотонами энергией 6 MB. Клинический объем облучения включал первичную опухоль и все регионарные лимфатические узлы таза – параректальные, внутренние, наружные и общие подвздошные, обтураторные. Лучевое воздействие осуществлялось 3 раза в неделю – РОД 4 Гр.
Локальная гипертермия выполнена после достижения суммарной дозы 16 Гр после сеанса лучевой терапии в течение 60 минут при температуре 41–45 °С на аппарате “Яхта-4” или “Ягель”. Температура в опухоли во время сеанса локальной гипертермии оценена при помощи термодатчика, находящегося на верхушке гибкого зонда диаметром 1 мм.
Хирургическое лечение
В стандартные операции включены чрезбрюшная резекция прямой кишки, брюшно-анальная резекция прямой кишки с низведением сигмовидной кишки и брюшно-промежностная экстирпация прямой кишки. При вовлечении соседних органов и тканей они резецировались en block с первичной опухолью.
Статистическая обработка информации проведена при помощи программы Statistica Software (Statsoft, Tulsa, OK), версия 7.1. Критерии оценки: общая и безрецидивная 2-летняя выживаемость, частота рецидивов и метастазов, частота послеоперационных осложнений.
Основной критерий оценки: общая выживаемость больных, рассчитанная от даты начала лечения до даты последнего наблюдения/смерти. Выбывшие из-под наблюдения пациенты оценены по дате их последнего визита. Время до прогрессирования определено от даты начала лечения до даты прогрессирования/смерти больного либо даты последнего контакта с больным. Выживаемость анализировалась в соответствии с методом Каплана–Мейера и сравнивалась по Log-Rank-тесту. Для сравнения качественных признаков использован χ2-тест с поправкой Йетса на непрерывность при таблицах сопряжения 2 × 2 или точный критерий Фишера при малых выборках. Во всех случаях применены 95 % доверительный интервал и двусторонний показатель р.
Токсичность лечения оценивалась по шкале NCI-CTC v.3.0, степень лечебного патоморфоза – по шкале
Dworak.
Результаты
Токсичность лечения
Общая частота развития токсических реакций составила 47,1 % (n = 8) в группе А и 54,7 % (n = 35) в группе В. Частота развития токсических реакций III–IV степей cоставила 11,8 % (n = 2) и 20,3 % (n = 13) соответственно.
В группе А токсичность III степени была представлена диареей у всех пациентов. У одного пациента при достижении СОД 28 Гр отмечено развитие диареи IV степени, ректита II степени, тошноты III степени, энтероколита II степени, рвоты IV степени, потери веса II степени. В связи с развившимися осложнениями лечение было прервано, проведена инфузионная, симптоматическая терапия. Несмотря на лечение, состояние пациента оставалось тяжелым и через 45 дней он погиб от осложнений ком-
плексной терапии.
В группе Б распределение по степеням токсичности было следующим: у 21 (32,8 %) пациента – I степени, у 18 (28,1 %) – II, у 12 (18,7 %) – III, у 1 (1,6 %) – IV степени. Для 1 (1,6 %) больной побочные эффекты лечения потребовали терапии в стационарных условиях и значительной (117 дней)
отсрочки хирургического этапа лечения. В структуре осложнений преобладали диарея – у 22 (34,4 %), рвота – у 12 (18,9 %), кожные реакции – у 11 (17,2 %), цистит – у 10 (15,6 %), ректит – у 10 (15,6 %), лейкопения – у 7 (10,9 %) пациентов.
Отмеченная тенденция к более низкой частоте токсических реакций III–IV степеней в группе А была статистически недостоверной (р = 0,726).
Хирургическое лечение
Интраоперационных осложнений и послеоперационной летальности не отмечено. Одиннадцати (64,7 %) пациентам группы А и 59 (92,2 %) – группы Б удалось выполнить удаление опухоли (p = 0,009).
В группе А у 5 (29,4 %) пациентов опухоль осталась неоперабельной без признаков регресса. Одна больная погибла от осложнений комплексного лечения. Среди 5 пациентов, которым не было выполнено удаление опухоли, у 2 больных отмечена инфильтрация подвздошных сосудов, у 3 – опухоль была вколоченной, врастала в стенки таза и на значительном протяжении врастала в мочевой пузырь. Четырем (23,5 %) пациентам была выполнена сфинктеросохраняющая операция – брюшно-анальная резекция прямой кишки.
В группе Б для 5 (7,8 %) пациентов операция закончилась эксплоративной лапаротомией из-за врастания опухоли в крестец (3 больных), в подвздошные сосуды (1), в крестец и мочевой пузырь (1). Сфинктеросохраняющие операции были выполнены 36 пациентам, что составило 61 % от числа больных, которым хирургическое лечение было проведено с удалением опухоли.
Патоморфологическое исследование
Операции в объеме R0 были выполнены всем пациентам с удаленной опухолью в обеих исследуемых группах: 11 (64,7 %) – группы А и 59 (92,2 %) – группы Б (p = 0,009).
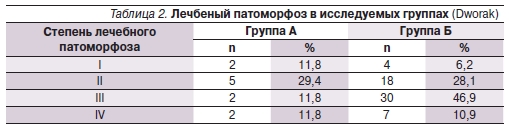
Частота лечебного патоморфоза III–IV степеней составила 23,6 (n = 4) и 57,8 % (n = 37) в группах А и Б соответственно (р = 0,015). Более подробные данные о лечебном патоморфозе в исследуемых группах приведены в табл. 2.
Поражение регионарных лимфатических узлов выявлено у 2 из 11 (18,2 %) прооперированных пациентов группы А и у 14 из 59 (23,7 %) – группы Б. Низкая частота выявления метастатического поражения регионарных лимфатических узлов пациентов с распространенными формами РПК может
объясняться большим числом пациентов с III–IV степенью лечебного патоморфоза.
Отдаленные результаты лечения
Медиана наблюдения в группе А составила 29,6 месяца. У одного из прооперированных пациентов через 12 месяцев выявлены метастазы в печени и у одного больного через 23 месяца – рецидив РПК в малом тазу. Шесть пациентов, которым не удалось выполнить удаление опухоли, погибли в сроки от 4 до 25 месяцев.
Медиана наблюдения в группе Б составила 24,9 месяца. У 8 (12,5 %) пациентов развился локорегионарный рецидив заболевания и у 10 (15,6 %) – отдаленные метастазы. У 6 больных отмечены метастазы в печень, у 1 – в печень и легкие, у 1 – только в легкие, у 1 – в забрюшинные лимфатические узлы и у 1 – в кости. Среднее время до развития метастазов варьировалось от 7,4 до 63,9 месяца (в среднем – 25,8 месяца). Среди 10 больных с метастазами трое погибли через 5, 7 и
11,0 месяцев. Остальные 7 пациентов наблюдались в течение 4–14 месяцев.
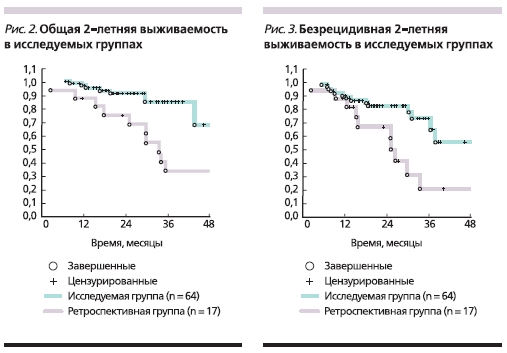
Двухлетняя общая выживаемость составила 68,4 % в группе А и 91,0 % в группе Б (р = 0,157; рис. 2), безрецидивная – 62 и 83 % соответственно (р = 0,064; рис. 3).
Обсуждение
Основные цели предоперационного лечения при местно-распространенном первично неоперабельном РПК:достижение максимального регресса опухоли, улучшение локального и системного контроля заболевания при сохранении умеренного токсического профиля таким образом, чтобы возможные побочные эффекты лечения не повлияли на основной этап лечения – хирургический.
При разработке новой схемы лечения мы ставили целью не только повышение ее эффективности, но и
безопасность, а также удобство для пациента. Основываясь на данных о сравнимой эффективности фтоурацила и капецитабина, мы отдали предпочтение последнему, исходя из удобно формы его применения (перорально), что позволило упростить проведение многокомпонентного лечения [3, 6].
Цисплатин был заменен на препарат платины нового поколения, уже показавший высокую эффективность в режимах адъювантного лечения и терапии диссеминированного колоректального рака [7–9]. Отсутствие необходимости использования водной нагрузки позволило дополнительно
упростить проведение лечения.
Режим лучевой терапии РОД 4 Гр и СОД 36 Гр хорошо переносился пациентами, что позволило нам увеличить СОД до 40 Гр с целью повышения канцероцидного воздействия.
Основываясь на данных о синергизме процессов радиосенсибилизации и гибели опухолевых клеток при одновременном использовании локальной гипертермии и метронидазола, мы добавили последний в разработанную программу комплексного лечения [10, 11].
Проведение работы в одном центре является одновременно и преимуществом, и недостатком этого исследования. Преимуществом – поскольку нет сомнений в использовании единой терминологии, единых критериев включения пациентов и единого качества хирургического лечения и сопроводительной терапии в обеих исследуемых группах; недостатком – поскольку в рамках одной клиники даже за большой временной период невозможно накопить достаточное для более показательных результатов количество наблюдений сравнительно редкой изучаемой формы РПК.
Частота выполнения операций в объеме R0 в проспективной группе нашего исследования – одна из наиболее высоких из опубликованных в литературе при аналогичных формах заболевания, что приводит к улучшению отдаленных результатов лечения [12–19]. В опубликованных исследованиях II–III фаз частота R0-резекций в аналогичных группах больных варьировалась от 57,7 до 88,0 % [20, 21]. Однако терминологические различия и особенности проводимого в различных клиниках хирургического лечения вносят значительный субъективный фактор в результаты этих исследований и не позволяют проводить корректные сравнения.
Несмотря на тенденцию к меньшему числу осложнений в группе А, в ней был отмечен случай летального исхода, связанного с неоадьювантным лечением. Некорректно делать выводы о большей безопасности этого режима лечения по сравнению с другими на основании только одной работы,
особенно с учетом отсутствия данных исследования DPD и ретроспективного характера анализа результатов в указанной группе. В целом уровни токсичности III–IV степеней в обеих группах: 11,8 % – в группе А и 20,3 % – в группе Б, умеренные.
Таким образом, использование нового метода комплексного лечения позволяет усиливать канцероцид-
ное воздействие на опухоль без увеличения его токсичности и улучшать отдаленные результаты лечения за счет повышения числа R0-резекций. На основании опыта работы нашего отделения эволюционное развитие разработанной ранее схемы лечения позволило увеличить показатели общей и безрецидивной выживаемости, число случаев R0-резекций и лечебного патоморфоза в этой группе
пациентов.



