Хроническая обструктивная болезнь легких (ХОБЛ) является одной из ведущих причин заболеваемости и смертности современного общества, летальность от ХОБЛ занимает 4-е место среди всех причин смерти в общей популяции [1]. Более того, летальность от ХОБЛ постоянно растет [2]. Согласно прогнозам экспертов ВОЗ, к 2020 г. ХОБЛ выйдет на третье место среди всех причин летальности и на первое – среди всех причин инвалидности у взрослых [2, 3].
Одной из непосредственных причин смерти больных ХОБЛ являются обострения заболевания [4]. По
данным международной статистики, внутригоспитальная летальность больных, госпитализированных по поводу обострения ХОБЛ, составляет 8 %, а через год после обострения – 23 % [5]. Развитие обострений является характерной чертой течения ХОБЛ, частота обострений прогрессивно растет с нарастанием тяжести заболевания [6]. Обострение ХОБЛ является одной из самых частых причин обращения больных за неотложной медицинской помощью. Согласно руководству GOLD (Global Initiative for chronic Obstructive Lung Disease, 2011): “Обострение ХОБЛ – острое состояние, которое характеризуется ухудшением респираторных симптомов у пациента, выходящее за пределы обычных суточных колебаний и требующее коррекции плановой медикаментозной терапии” [7].
Частые обострения у больных ХОБЛ приводят к более быстрому прогрессированию заболевания, значимому снижению качества жизни больных и сопряжены с существенными расходами на лечение [8]. Более того, респираторные инфекции у больных ХОБЛ приводят к декомпенсации сопутствующих хронических заболеваний [9], повышают риск развития острого инфаркта миокарда и инсульта [10].
Значение антибактериальных препаратов при обострении ХОБЛ
Традиционная терапия обострений ХОБЛ включает кислород и респираторную поддержку (при развитии острой дыхательной недостаточности), бронхорасширяющие препараты, глюкокортикостероиды (ГКС) и антибиотики [7].
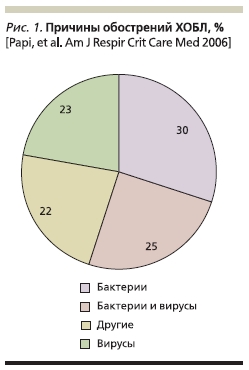
Наиболее частыми причинами обострений ХОБЛ являются бактериальные и вирусные респираторные
инфекции и атмосферные поллютанты [11, 12], однако причины примерно в 20–30 % случаев обострений установить не удается (рис. 1). Среди бактерий при обострении ХОБЛ наибольшую роль играют нетипируемые Haemophilus influenzae, Streptococcus pneumoniae и Moraxella catarrhalis [12]. Исследования, включившие больных ХОБЛ с тяжелыми обострениями, показали, что у таких больных могут чаще встречаться грамотрицательные энтеробактерии и Pseudomonas aeruginosa. Факторами
риска инфицирования P. aeruginosa являются недавняя госпитализация, частое применение антибиотиков (4 и более курсов за последний год), тяжелые обострения ХОБЛ и выделение P. aeruginosa в период предшествующего обострения или колонизация микроорганизмов в стабильную фазу заболевания [13].
Ведущая роль бактериального фактора в генезе развития обострения ХОБЛ является основанием для назначения антибактериальных препаратов. Рациональность использования антибиотиков при обострении ХОБЛ является предметом дискуссий и в наши дни. Основным аргументом противников антибактериальной терапии (АБТ) при обострении ХОБЛ является возможность спонтанного разрешения обострения: в процесс воспаления вовлекается только слизистая оболочка бронхов, поэтому часто наступает спонтанная ремиссия обострения даже без этиотропной терапии [14].
Однако получены убедительные доказательства необходимости применения АБТ при обострениях ХОБЛ, особенно при развитии тяжелых обострений. В одном из недавно выполненных мета-анализов, включившем 13 рандомизированных контролируемых исследований (РКИ), показано, что АБТ по сравнению с плацебо приводила к меньшему числу неудач терапии (отношение шансов [ОШ] = 0,25) и была ассоциирована с более низкой летальностью (ОШ = 0,20) в группе пациентов с тяжелым обострением ХОБЛ, требовавшим их госпитализации в стационар [15]. Однако АБТ не снижала число неудач терапии амбулаторных больных ХОБЛ с легкими и среднетяжелыми обострениями (ОШ = 1,09).
Показания к назначению антибактериальных препаратов при обострении ХОБЛ
Поскольку бактерии являются причиной далеко не всех обострений ХОБЛ (< 50 %), важно определить показания к назначению АБТ при развитии обострений. Современные руководства рекомендуют назначать антибиотики пациентам с наиболее тяжелыми обострениями ХОБЛ [7, 16, 17], например
с I типом обострений по классификации N.R. Anthonisen (т. е. при усилении одышки, увеличении объема и степени гнойности мокроты) или со II типом (наличием двух из трех перечисленных признаков) [18]. Для больных с подобными сценариями обострений ХОБЛ антибиотики обладают наибольшей эффективностью, т. к. причиной таких обострений является бактериальная инфекция. Также антибиотики рекомендовано назначать пациентам с тяжелым обострением ХОБЛ, нуждающимся в инвазивной или неинвазивной вентиляции легких [19].
Среди новых подходов к определению показаний к назначению АБТ необходимо отметить подходы на
основе фенотипирования обострений ХОБЛ и определения уровней биомаркеров бактериальных инфекций.
Фенотипы обострений ХОБЛ. Знание потенциальных фенотипов обострений заболевания позволяет использовать наиболее подходящий подход к лечению и ведению больных. Bafadhel и соавт. провели исследование, целью которого явилось изучение биологических фенотипов обострений и выявление биомаркеров, ассоциированных с клиническими фенотипами обострений [20]. В данное проспективное обсервационное исследование были включены 145 пациентов с ХОБЛ (средний возраст – 69 лет, стаж курения – 49 пачка/лет). За 12 месяцев наблюдения у 86 пациентов зафиксировано 182 обострения ХОБЛ. В ходе анализа определено 4 биологических кластера обострений ХОБЛ: “обострения, ассоциированные с бактериями” (35 %), “обострения, ассоциированные с эозинофилией мокроты” (24 %), “обострения, ассоциированные с вирусами” (30 %) и “маловоспалительные обострения” (11 %). Данные фенотипы обострений не различались по клинической картине, но отличались друг
от друга по этиологии и выраженности воспаления в нижних дыхательных путях (рис. 2).
Обострения, ассоциированные с бактериями, характеризовались увеличением числа нейтрофилов в мокроте и периферической крови, повышением уровня микробной нагрузки. Наиболее значимым биомаркером бактериальных обострений был интерлейкин-1β (ИЛ-1β) мокроты (площадь под ROC [receiver operating characteristic] кривой – 0,89), пороговое значение – 125 пг/мл (чувствительность – 90 %, специфичность – 80 %). Лучшим сывороточным биомаркером оказался С-реактивный белок (СРБ) (площадь под ROC-кривой – 0,65), пороговое значение – 10 мг/л (чувствительность – 60 %, специфичность – 70 %). Наиболее значимым биомаркером при обострениях, ассоциированных с вирусами, оказался хемокин CXCL10 сыворотки крови (площадь под ROC-кривой – 0,76), пороговое
значение – 56 пг/мл (чувствительность – 75 %, специфичность – 65 %). Наиболее чувствительным и специотрицательные энтеробактерии и Pseudomonas aeruginosa. Факторами риска инфицирования P. aeruginosa являются недавняя госпитализация, частое применение антибиотиков (4 и более курсов за последний год), тяже-лые обострения ХОБЛ и выделение P. aeruginosa в период предшествующего обострения или колонизация микроорганизмов в стабильную фазу заболевания [13].
Ведущая роль бактериального фактора в генезе развития обострения ХОБЛ является основанием для назначения антибактериальных препаратов. Рациональность использования антибиотиков при обострении ХОБЛ является предметом дискуссий и в наши дни. Основным аргументом противников антибактериальной терапии (АБТ) при обострении ХОБЛ является возможность спонтанного разреше-ния обострения: в процесс воспаления вовлекается только слизистая оболочка бронхов, поэтому часто наступает спонтанная ремиссия обострения даже без этиотропной терапии [14].
Однако получены убедительные доказательства необходимости применения АБТ при обострениях ХОБЛ, особенно при развитии тяжелых обострений. В одном из недавно выполненных мета-анализов, включившем 13 рандомизированных контролируемых исследований (РКИ), показано, что АБТ по сравнению с плацебо приводила к меньшему числу неудач терапии (отношение шансов [ОШ] = 0,25) и была ассоциирована с более низкой летальностью (ОШ = 0,20) в группе пациентов с тяжелым обострением ХОБЛ, требовавшим их госпитализации в стационар [15]. Однако АБТ не снижала число неудач терапии амбулаторных больных ХОБЛ с легкими и среднетяжелыми обострениями (ОШ = 1,09).
Показания к назначению антибактериальных препаратов
при обострении ХОБЛ
Поскольку бактерии являются причиной далеко не всех обострений ХОБЛ (< 50 %), важно определить показания к назначению АБТ при развитии обострений. Современные руководства рекомендуют назначать антибиотики пациентам с наиболее тяжелыми обострениями ХОБЛ [7, 16, 17], например
с I типом обострений по классификации N.R. Anthonisen (т. е. при усилении одышки, увеличении объема и степени гнойности мокроты) или со II типом (наличием двух из трех перечисленных признаков) [18]. Для больных с подобными сценариями обострений ХОБЛ антибиотики обладают наибольшей эффективностью, т. к. причиной таких обострений является бактериальная инфекция. Также антибиотики рекомендовано назначать пациентам с тяжелым обострением ХОБЛ, нуждающимся в инвазивной или неинвазивной вентиляции легких [19].
Среди новых подходов к определению показаний к назначению АБТ необходимо отметить подходы на
основе фенотипирования обострений ХОБЛ и определения уровней биомаркеров бактериальных инфекций.
Фенотипы обострений ХОБЛ. Знание потенциальных фенотипов обострений заболевания позволяет использовать наиболее подходящий подход к лечению и ведению больных. Bafadhel и соавт. провели исследование, целью которого явилось изучение биологических фенотипов обострений и выявление биомаркеров, ассоциированных с клиническими фенотипами обострений [20]. В данное проспективное обсервационное исследование были включены 145 пациентов с ХОБЛ (средний возраст – 69 лет, стаж курения – 49 пачка/лет). За 12 месяцев наблюдения у 86 пациентов зафиксировано 182 обострения ХОБЛ. В ходе анализа определено 4 биологических кластера обострений ХОБЛ: “обострения, ассоциированные с бактериями” (35 %), “обострения, ассоциированные с эозинофилией мокроты” (24 %), “обострения, ассоциированные с вирусами” (30 %) и “маловоспалительные обострения” (11 %). Данные фенотипы обострений не различались по клинической картине, но отличались друг от друга по этиологии и выраженности воспаления в нижних дыхательных путях (рис. 2).
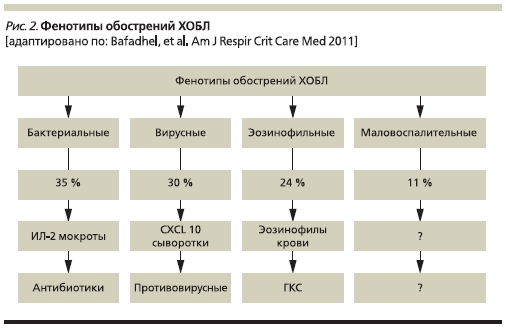
Обострения, ассоциированные с бактериями, характеризовались увеличением числа нейтрофилов в мокроте и периферической крови, повышением уровня микробной нагрузки. Наиболее значимым биомаркером бактериальных обострений был интерлейкин1β (ИЛ-1β) мокроты (площадь под
ROC [receiver operating characteristic]-кривой – 0,89), пороговое значение – 125 пг/мл (чувствительность – 90 %, специфичность – 80 %). Лучшим сывороточным биомаркером оказался С-реактивный белок (СРБ) (площадь под ROC-кривой – 0,65), пороговое значение – 10 мг/л (чувстви-
тельность – 60 %, специфичность – 70 %). Наиболее значимым биомаркером при обострениях, ассоциированных с вирусами, оказался хемокин CXCL10 сыворотки крови (площадь под ROC-кривой – 0,76), пороговое значение – 56 пг/мл (чувствительность – 75 %, специфичность – 65 %). Наиболее чувствительным и специфичным маркером для определения эозинофилии мокроты во время обо-
стрений была эозинофилия периферической крови (площадь под ROC-кривой – 0,85) с пороговым значением 2 % (чувствительность – 90 %, специфичность – 60 %).
Таким образом, в исследовании было определено четыре клинических фенотипа обострений ХОБЛ, неразличимых клинически, но дифференцируемых по ряду высокочувствительных и специфичных биомаркеров с целью выделения наиболее значимых фенотипов обострений. Назначение антибактериальных препаратов показано пациентам с обострениями, ассоциированными с бактериями и характеризующимися более высокими уровнями ИЛ-1β в мокроте и СРБ в сыворотке крови. Безусловно пока еще рано говорить о широком применении в повседневной клинической практике таких
биомаркеров, как CXCL10 и ИЛ-1β, но уже сегодня возможно рутинное определение эозинофилии крови и СРБ сыворотки.
Биомаркеры – предикторы бактериальных обострений ХОБЛ. Для проведения культурального анализа обычно требуется 24–48 часов, но данные сроки могут быть слишком длительными для принятия решения о терапии больных, находящихся в критическом состоянии, что, несмотря на 100 %-ную надежность результатов микробиологических анализов, снижает их привлекательность.
Опасения относительно недостаточной аккуратности существующих подходов к диагностике бактериальных инфекций и невозможность при использовании такой стратегии избежать чрезмерного
назначения антибактериальных препаратов привели к более широкому использованию биомаркеров, что может помочь улучшить диагностику и подходы к терапии обострений ХОБЛ. К числу таких наиболее доступных и надежных на сегодня биомаркеров можно отнести СРБ [21].
В исследовании D. Dev и соавт. показано, что уровень CРБ > 10 мг/л был у всех пациентов с доказанным инфекционным обострением ХОБЛ (средние значения – 103 ± 98 мг/л). Причем значительное повышение уровня CРБ было при обострении пневмококковой этиологии (156 мг/л). Сывороточный уровень CРБ коррелировал с лейкоцитозом периферической крови (r = 0,44; p < 0,01) и снижался на фоне лечения антибиотиками [22].
В проведенном нами исследовании приняли участие 123 пациента, госпитализированных в стационар с обострением ХОБЛ (среди них: 74 больных с продукцией гнойной мокроты, 26 – без продукции гнойной мокроты, 23 – с внебольничной пневмонией) [23]. Концентрация CРБ сыворотки крови у пациентов с обострением ХОБЛ и гнойной мокротой были достоверно выше по сравнению с пациентами, страдавшими обострением ХОБЛ с продукцией слизистой мокроты (34,5 ± 18,8 мг/л против 12,1 ± 7,0; p < 0,001). По данным ROC-анализа, сывороточный уровень CRP по сравнению с другими воспалительными маркерами (лейкоцитозом периферической крови, сывороточными концентрациями ИЛ-6 и фактор некроза опухоли-α) являлся наиболее ценным и достоверным признаком наличия бронхиальной инфекции и пневмонии у больных с обострением ХОБЛ. Пороговый уровень CРБ ≥ 16,5 мг/л при обострении ХОБЛ для диагностики бактериальной инфекции имел чувствительность 93 %,
специфичность 93 %.
Какие антибиотики назначать при обострении ХОБЛ?
Выбор наиболее подходящих антибиотиков для терапии обострения ХОБЛ зависит от многих факторов, таких как тяжесть ХОБЛ, факторы риска неблагоприятного исхода терапии (например, пожилой возраст, низкие значения объема форсированного выдоха за первую секунду [ОФВ1], частые обострения и сопутствующие заболевания) [24] и предшествующей антибактериальной терапии [7, 16, 19]. Современные руководства по ведению больных ХОБЛ приводят различные рекомендации по выбору антибактериальной терапии больных с обострением ХОБЛ. Одна из таких классификационных схем терапии обострений ХОБЛ представлена на рис. 3 [25].
Рисунок 3. Алгоритм применения антибиотиков при обострениях ХОБЛ.
При неосложненных обострениях ХОБЛ рекомендовано назначение современных макролидов (азитромицина, кларитромицина), цефалоспоринов (цефуроксима и др.) и доксициклина [25]. Однако необходимо отметить достаточно высокую резистентность S. pneumoniae к тетрациклинам, в т. ч. и к доксициклину [26]. По данным мета-анализа Siempos и соавт., основанного на 19 РКИ (7405 больных),
при обострении ХОБЛ бактериологическая эффективность макролидов оказалась достоверно ниже по сравнению с фторхинолонами (ОШ = 0,47; 95 % доверительный интервал [ДИ] – 0,31–0,69) [27].
В большинстве международных и национальных руководств приводятся рекомендации по выбору в качестве препаратов первой линии терапии больных с осложненными обострениями ХОБЛ либо амоксициллин/клавуланат (АМК), либо респираторные фторхинолоны (левофлоксацин или моксифлоксацин) [7, 17], однако строгих сравнительных исследований данных препаратов ранее не проводилось.
Респираторные фторхинолоны (левофлоксацин, моксифлоксацин, гемифлоксацин) обладают высо-
кой активностью по отношению к S. pneumoniae, включая и полирезистентные штаммы [28]. При этом респираторные фторхинолоны сохраняют высокую активность и по отношению к грамотрицательным микроорганизмам (H. influenzae и M. catarrhalis) и внутриклеточным патогенам [29]. Установлено, что левофлоксацин в дозе 750 мг/сут обладает достаточной активностью по отношению к синегнойной палочке [30]. Респираторные фторхинолоны обладают привлекательными фармакокинетическими свойствами: способностью к высокой концентрации в слизистой оболочке бронхов и мокроте, высокой
биодоступностью (70–95 %) [28, 29]. Длительный период полувыведения препаратов и постбиотиче-
ский эффект делают возможным их применение 1 раз в сутки. Наличие пероральной и парентеральной лекарственных форм у левофлоксацина и моксифлоксацина позволяет использовать их по ступенчатой схеме терапии. Высокая клиническая и микробиологическая эффективность новых фторхинолонов при обострении ХОБЛ была продемонстрирована в крупных РКИ [28, 29].

Во многих клинических рекомендациях по лечению обострений ХОБЛ АМК рассматривается как наиболее часто назначаемый препарат [31, 32]. Достоинствами АМК являются его высокая биодоступность при приеме внутрь, хорошее проникновение в различные ткани и жидкости организма, широкий спектр антибактериальной активности препарата по отношению к грамотрицательным возбудителям, способным к продукции β-лактамаз (H. influenzae, M. catarrhalis), некоторым энтеробактериям (Klebsiella pneumoniae и др.), метициллиночувствительным S. aureus и неспорообразующим анаэробам [33], а также доказанная эффективность АМК во многих хорошо спланированных РКИ [31, 32].
А. Canut и соавт. создали модель терапевтических исходов АБТ при обострении ХОБЛ (модель ТОМ –
Therapeutic Outcome Model), учитывавшую такие параметры, как пропорция больных с небактериальными причинами обострения ХОБЛ, вероятность спонтанного разрешения обострения, распространенность различных бактериальных патогенов при обострении ХОБЛ, антибактериальная эффективность различных антибиотиков (в соответствии с критериями фармакокинетики/фармакодинамики) [34]. Согласно данной модели, прогнозируемая клиническая эффективность АМК в дозе 875/125 мг 3 раза в сутки составила 92,2 % для S. pneumoniae, 96 % для H. influenzae и 100 % для M. catarrhalis. По данным фармакоэкономического обсервационного исследования C. Llor и соавт., применение АМК при обострениях ХОБЛ сопровождалось меньшими затратами по сравнению с использованием кларитромицина (ОШ = 0,21; 95 % ДИ – 0,1–0,4) [35].
Совсем недавно были опубликованы результаты исследования MAESTRAL, главной целью которого стало сравнение эффективности АМК в дозе 875/125 мг 2 раза в сутки в течение 7 дней и моксифлоксацина 400 мг 1 раз в сутки в течение 5 дней при амбулаторном лечении обострения ХОБЛ
у пациентов с высоким риском неэффективности антибактериальной терапии [36]. В исследование были включены 1372 амбулаторных больных с обострением ХОБЛ I типа по классификации N.R. Anthonisen. Средний возраст пациентов, включенных в исследование, составил 69 лет, средний ОФВ1 –
36 %, у подавляющего большинства больных имелись сопутствующие заболевания (> 80 %), 35 % всех пациентов ХОБЛ во время обострения получали системные ГКС [36]. Число клинических неудач в обеих группах терапии было практически одинаковым, в группе моксифлоксацина оно составило 20,6 %, в группе АМК – 22,0 % (рис. 4). Клинические неудачи терапии чаще наблюдались среди больных, получавших терапию системными ГКС (26,4 против 32,8 % в группах моксифлоксацина и АМК; p = 0,168), по сравнению с пациентами, их не получавшими (17,7 против 15,8 % в группах моксифлоксацина и АМК; p = 0,505). В целом среди пациентов с подтвержденной бактериальной инфекцией клиническое излечение на 8-й неделе после терапии чаще наблюдалось среди пациентов с бактериальной эрадикацией к концу курса антибактериальной терапии (79,7 против 54,7 %, р < 0,0001). Такие результаты были закономерны при терапии как моксифлоксацином (84,3 против 53,4 %; р < 0,0001), так и АМК (74,6 против 55,7 %, p = 0,0007).
Данные результаты подчеркивают важность бактериальной эрадикации для предотвращения рецидивов и являются подтверждением гипотезы о том, что продолжающееся воспаление дыхательных путей, вызванное персистирующей инфекцией, является основной причиной рецидивов и
частых обострений [25]. Среди факторов, ассоциированных с положительной бактериальной культурой перед началом антибактериальной терапии, отмечены следующие: возраст > 65 лет, ОФВ1 < 30 % и отсутствие предшествующей терапии антибиотиками.
Какова оптимальная продолжительность антибактериальной терапии при обострении ХОБЛ?
Возможность использования 5-дневных курсов АБТ была продемонстрирована в РКИ для таких препаратов, как АМК, цефдиторен, левофлоксацин, моксифлоксацин, гемифлоксацин [37, 38].
Короткие курсы АБТ (около 5 дней) по сравнению с “традиционными” продолжительными курсами гарантируют более высокую приверженность больных терапии, особенно в амбулаторных условиях [29]. Для пациентов, принимающих АБТ, пропуск приема препаратов или незапланированное прерывание курса терапии означает не только снижение эффективности терапии, но и повышение вероятности “селекции” резистентных микроорганизмов [29]. Многочисленные исследования показывают, что чем длиннее продолжительность лечения, тем меньше больных полностью заканчивают это лечение [39]. Однократный прием препарата в течение суток также значительно улучшает приверженность больных терапии [39].
В мета-анализе M.E. Falagas, основанном на 7 РКИ (3083 больных ХОБЛ), проводилось сравнение терапии одним и тем же антибиотиком в тех же дозах, но с различной продолжительностью терапии (5 дней против 7–10 дней) [38]. Мета-анализ не показал различий между сравниваемыми группами терапии в отношении достижения клинического успеха (ОШ = 0,99; 95 % ДИ – 0,95–1,03), однако короткие курсы АБТ оказались более безопасными, т. к. сопровождались достоверно меньшим числом нежелательных лекарственных реакций (ОШ = 0,84; 95 % ДИ – 0,72–0,97) [38].
Эти результаты следует с осторожностью экстраполировать на больных ХОБЛ с тяжелыми обострениями, госпитализированными в стационар. Точного ответа на вопрос о длительности АБТ при тяжелом обострении ХОБЛ сегодня пока нет. Определение продолжительности АБТ больных ХОБЛ с тяжелыми обострениями может быть основано на мониторинге уровней биомаркеров воспаления [40].



