Введение
В настоящее время активную дискуссию вызывает патогенез хронического панкреатита (ХП). По мнению ряда отечественных и зарубежных авторов, в основе хронизации воспалительного процесса в поджелудочной железе лежит дисбаланс между активностью про- и противовоспалительных цитокинов, отражающий наличие длительно существующего хронического системного воспаления (ХСВ) [1–3]. Известно, что цитокины образуют ворганизме универсальную биологи-ческую коммуникационную систему, инициирующую и регулирующую воспалительные, иммунные, пролиферативные процессы, а также формирование фиброза. У больных ХП, даже в период ремиссии, отмечается многократное повышение уровня провоспалительных цитокинов (интерлейкина-1 [ИЛ-1, ИЛ-6, ИЛ-8] и фактора некроза опухоли α – ФНО-α), потенцирующее некроз и апоптоз панкреатоцитов. Длительная цитокиновая агрессия сопровождается увеличением генерализованной сосудистой проницаемости, миграцией лейкоцитов, развитием функциональной недостаточности и повреждением панкреатоцитов [4].
Нарушения иммунного и цитокинового статуса пациента во многом определяют течение и исход заболевания, интенсивность репаративных процессов, сроки наступления и длительность ремиссии.
Особый интерес представляют данные различных авторов о широкой распространенности дисбиотических нарушений у больных ХП. В частности, у 65–100 % из них диагностируется дисбиоз кишечника и/или синдром избыточного бактериального роста [5–7]. С другой стороны, все больше
исследований свидетельствуют, что формирование, персистирование и выраженность ХСВ во многом определяются имеющимися дисбиотическими нарушениями кишечной микрофлоры [7, 8]. Установлена прямая связь между уменьшением количества патогенных и условно-патогенных бактерий в толстой кишке и снижением концентраций бактериального липополисахарида и провоспалительных цитокинов (ФНО-α и ИЛ-1β) в плазме крови [9]. Однако избирательная блокада отдельных специфичных медиаторов воспаления у больных ХП и полиорганной недостаточностью не сопровождалась улучшением исхода заболевания, что расценивалось как необходимость разработки новых терапевтических средств с широким антицитокиновым спектром. С другой стороны, связь концентрации эндотоксина в крови с клинической симптоматикой при заболеваниях панкреатобилиарной системы позволяет рассматривать вариант воздействия на микробно-тканевой комплекс кишечника как наиболее перспективный и безопасный [10]. Так, с помощью пребиотика, введенного через назоеюнальный зонд в составе энтеральной смеси, добивались уменьшения
сроков госпитализации, продолжительности энтерального питания и частоты возникновения осложне-
ний у больных острым панкреатитом [11]. В основе данного эффекта лежит подавление патогенной микрофлоры за счет стимуляции облигатной микрофлоры кишечника [11]. Таким образом, в настоящее время необходимо параллельно рассматривать два направления в лечении ХП: патогенетическую терапию и нормализацию функционального состояния микробно-тканевого комплекса кишечника.
В основе патогенетической терапии ХП лежит принцип создания “функционального покоя”, который
достигается использованием мощных современных секретолитических препаратов. Безусловным лидером в этой группе являются последние поколения ингибиторов протонной помпы. Снижая желудочную секрецию, ингибиторы протонной помпы влияют на секретиновый и гастриновый механизмы стимуляции гидрокинетической секреторной составляющей поджелудочной железы и таким
образом позволяют снижать внутрипротоковое давление, эффективно нивелируя болевые проявления. В т. ч. и с этой целью используются современные полиферментные препараты. Известно, что физиологическая регуляция выработки собственных ферментов поджелудочной железы осуществляется по механизму обратной связи. При поступлении ферментов (в частности, протеаз) в просвет 12-перстной кишки происходит их взаимодействие с холецистокининрилизинг-пептидом. При достаточно высоком уровне панкреатических ферментов в 12-перстной кишке происходят инактивация рилизингпептида, снижение синтеза холецистокинина и как следствие – снижение выработки ферментов поджелудочной железы. Итак, задачами полиферментной терапии являются как
заместительная терапия при развитии внешнесекреторной недостаточности, так и торможение секреторной активности поджелудочной железы по механизму “отрицательной обратной связи”.
Следующим неотъемлемым звеном в терапии ХП является использование спазмолитических препаратов с целью разрешения дисфункции сфинктера Одди и гипертензии главного панкреатического протока. В отсутствие эффекта от консервативной терапии дисфункции сфинктера Одди и наличия данных о его стенозе восстановление проходимости сфинктера Одди производят оперативным путем (сфинктеротомией) [12]. Следует заметить, что нормализация моторных и секреторных нарушений, лежащая в основе патогенетической терапии, является составляющим компонентом нормализации микрофлоры кишечника, а также нивелирования проявлений ХСВ [13].
Целью данного исследования была оценка клинической эффективности комплексной схемы лечения ХП
(секретолитическая, спазмолитическая, заместительная полиферментная терапия) с изучением ее влияния на выраженность ХСВ.
Материал и методы
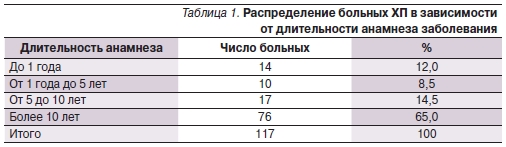
В состав анализируемой выборки были включены 117 пациентов с рецидивирующей формой ХП (РФХП), средний возраст которых составил 43,9 ± 11,6 года (40,9 ± 13,5 года у мужчин, 48,6 ± 11,7 года у женщин). Распределение больных РФХП в зависимости от длительности анамнеза представлено в табл. 1. Больные с РФХП были разделены на две группы в зависимости от проводимой терапии. Основная группа представлена 58 пациентами (РФХП1), в комплексной терапии которых использовались спазмолитические (мебеверин 200 мг 2 раза в сутки), секретолитические(эзомепразол 40 мг в сутки) и полиферментные (Креон в суточной дозировке 100 тыс. ЕД) препараты, длительность
терапии составила 6 недель.
В группе сравнения РФХП2 (59 пациентов) терапия была представлена теми же препаратами (спазмолитическими, секретолитическими и полиферментными) с уменьшением дозы полиферментного препарата до 30 тыс. ЕД в сутки и длительность терапии составляла до 4 недель. Соотношение лиц мужского и женского пола в обеих группах было сопоставимым: основная – 37 (63,8 %) мужчин и 21 (36,2 %) женщин, контрольная – 33 (55,9 %) и 26 (44,1 %) соответственно.
Все больные проходили стационарное обследование и лечение в клинике 2-й кафедры (терапии усовершенствования врачей) Военно-медицинской академии, Санкт-Петербург.
Всем больным в динамике проведено исследование следующих показателей:
• выраженность клинических проявлений болевого абдоминального и диспепсического синдромов
путем самонаблюдения с использованием балльного шкалирования (визуально-аналоговая шкала – ВАШ: 0 – отсутствие симптома, 5 – максимальная его выраженность);
• биохимические (аспартатамино-трансфераза, аланинаминотрансфераза, билирубин, щелочная фос-
фатаза, γ-глутамилтранспептидаза, амилаза, глюкоза, калий, гликированный гемоглобин, фруктозамин);
• фенотипирование липопротеинов сыворотки крови (общий холестерин, холестерин липопротеинов низкой плотности, холестерин липопротеинов высокой плотности, коэффициент атерогенности);
• гормональные (определение уровняинсулина);
• эхокардиограмма, электрокардиото-пограмма-60;
• ультразвуковое исследование органов брюшной полости;
• психологический статус;
• микробный пейзаж кала;
• оценка качества жизни по опроснику SF-36;
• трансэндоскопическая топическая экспресс-рН-метрия.
Были выделены следующие критерии исключения:
1. Наличие выраженной сопутствующей патологии: декомпенсация сахарного диабета, прогрессирующая стенокардия, хроническая обструктивная болезнь легких с проявлениями дыхательной недостаточности, хроническая почечная недостаточность, хронические гепатиты различной этиологии, хроническая печеночная недостаточность.
2. Наличие тяжелой сопутствующей гастроэнтерологической патологии или осложнений заболеваний
органов пищеварения, например осложнений язвенной болезни (признаки кровотечения из желудочно-кишечного тракта, перфорация или пенетрация, стеноз антрального отдела желудка или пилородуоденальной зоны, малигнизация), органических поражений кишечника (опухоли, дивертикулез), воспалительных заболеваний кишечника (болезнь Крона, неспецифический язвенный колит и пр.) на момент включения в исследование.
3. Длительное применение гепатотоксических препаратов, в т. ч. по жизненным показаниям.
4. Системные заболевания соединительной ткани.
5. Больные с сопутствующей другойпатологией различных систем и органов, получающие стероидные
гормоны.
6. Больные, имеющие аллергические реакции на компоненты препарата.
7. Беременность.
8. Наличие психических (эндогенных) расстройств (генерализованное тревожно-фобическое расстройство, рекуррентное депрессивное расстройство, биполярное расстройство, шизофрения).
Результаты
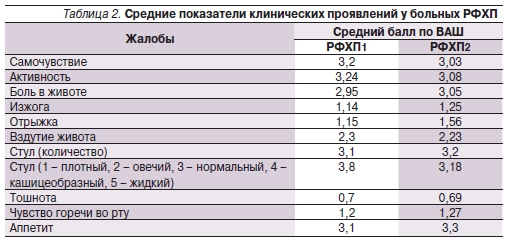
В клинической картине больных ХП превалировал болевой абдоминальный синдром (средний балл – 3,05 по ВАШ), среди диспепсических проявлений доминировали вздутие живот, послабление и учащение стула (средний балл по ВАШ – 2,3; 3,8; 3,1 соответственно). Выраженность таких симптомов, как чувство горечи во рту, тошнота, была незначительной (средние баллы по ВАШ – 1,27 и 0,69 соответственно). В табл. 2 представлена сравнительная характеристика клинических проявлений в обеих группах.
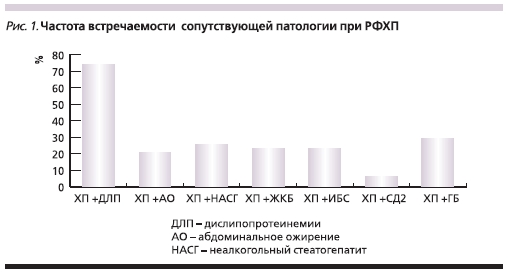
Частота встречаемости сопутствующей патологии, преимущественно патогенетически связанной с проявлениями метаболического синдрома, представлена на рис. 1.
Изучение липидного обмена у пациентов с РФХП1 и РФХП2 (табл. 3) демонстрирует значительные нарушения фактически всех показателей липидограммы. Так, содержание общего холестерина было выше референтных величин и составило у пациентов с РФХП1 5,6 ± 1,4 ммоль/л и 5,3 ± 1,8 ммоль/л – у
больных РФХП2. Коэффициент атерогенности отражал динамику изменений общего холестерина: 4,8 ± 1,2 – РФХП1 и 4,9 ± 1,0 – РФХП2. Уровень триглицеридов сыворотки крови был максимальным у пациентов с РФХП1 (2,7 ± 0,6 ммоль/л), в то время как у больных РФХП2 он достигал значений 2,2 ± 1,0
ммоль/л. Обращал на себя внимание факт прогрессирующего роста показателей липопротеинов низкой плотности, который у пациентов обеих групп значительно превосходил норму (6,6 ± 1,1 ммоль/л и 6,8 ± 1,2 ммоль/л соответственно).
Таблица 3. Динамика показателей липидограммы больных РФХП до и после терапии, М ± m.
Анализ динамики показателей, характеризующих липидный обмен (табл. 3), позволил выявить у боль-
ных обеих групп снижение уровня как общего холестерина, так и его атерогенных фракций. Однако у пациентов группы РФХП1 выявлены более значимое снижение уровня общего холестерина, а также тенденция к снижению уровня холестерина липопротеинов низкой плотности.
На фоне проведенного лечения отмечены изменения клинических проявлений (рис. 2, 3).
Рисунок 2. Динамика клинических проявлений в группе РФХП1 на фоне терапии.
Рисунок 3. Динамика клинических проявлений в группе РФХП2 на фоне терапии.
Регресс болевого абдоминального синдрома в группе больных ХП наступил уже к 3–4-м суткам терапии, а полное и стойкое купирование – на 6–8-е сутки лечения. Диспепсические жалобы нивелировались на 6-й день лечения.
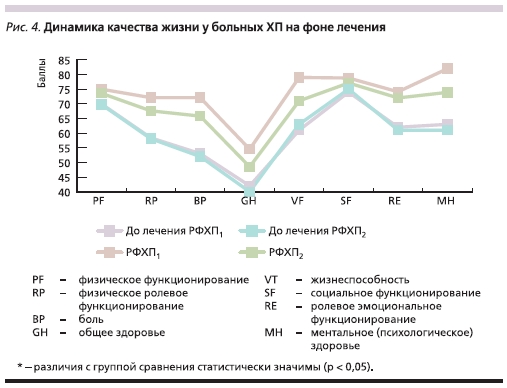
При оценке динамики показателей качества жизни, изначально сниженные практически у всех пациентов, отмечено статистически значимое улучшение как в первой, так и во второй группах таких характеристик, как ВР – “интенсивность боли”, GH – “общее состояние здоровья” . В 1-й
группе больных, кроме того, отмечено достоверное улучшение по показателю VT – “жизненная активность”, а во 2-й – по МН – “психическое здоровье” (рис. 4).
Положительная клиническая динамика, улучшение качества жизни отмечены на фоне метаболических
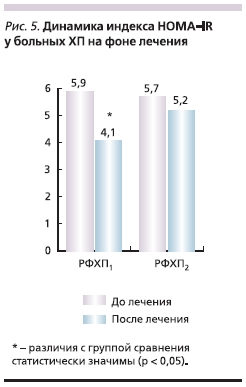
изменений. В исследовании произведен расчет показателя инсулинорезистентности HOMA-IR по формуле: (инсулин натощак, мЕД/мл) × (глюкоза натощак, ммоль/л)/22,5. На рис. 5 представлена динамика показателя HOMA-IR на фоне проведенного лечения. Имеет место значимое уменьшение данного показателя, что свидетельствует о снижении риска развития инсулинорезистентности.
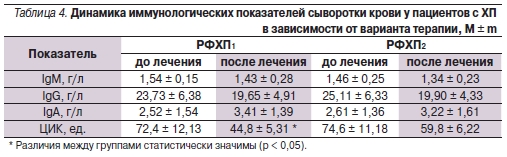
Особый интерес представляет динамика иммунологических показателей сыворотки крови в исследуемых группах (табл. 4). Она свидетельствует о повышении естественного защитного барьера слизистой оболочки, что проявляется в повышении уровня иммуноглобулинов класса A (IgA) на фоне
тенденции к уменьшению уровня иммуноглобулинов классов M (IgМ) и G (IgG), а также концентрации
циркулирующих иммунных комплексов (ЦИК). Изменение последнего показателя больных основной группы было статистически достоверным (р = 0,035).
В обеих группах отмечено статистически значимое уменьшение выраженности ХСВ, оцененной по уровню таких маркеров воспаления, как С-реактивный белок и провоспалительные цитокины, но у пациентов основной группы оно было достоверно более выраженным (табл. 5).
Таблица 5. Динамика иммунологических показателей сыворотки крови у пациентов с ХП в зависимости от проводимой терапии, М ± m.
Таблица 6. Динамика результатов микробиологического исследования содержимого толстой кишки (средняя концентрация микроорганизмов [lg КОЕ/г]) у пациентов с ХП в зависимости от проводимой терапии, М ± m.
Закономерным объяснением уменьшения выраженности ХСВ у пациентов с ХП в обеих терапевти-
ческих группах стало снижение концентрации патогенных и условнопатогенных микроорганизмов по
данным микробиологического исследования содержимого толстой кишки (табл. 6).
Через 21 день терапии высокими дозами полиферментных препаратов отмечено статистически значимое снижение (р < 0,05) концентрации патогенных и условно-патогенных микроорганизмов (лактозонегативные и гемолизирующие E. coli, стафилококки, дрожжеподобные грибы) и статистически значимое увеличение (р < 0,05) содержания представителей облигатной микрофлоры (бифидо-, лактобактерии, E. coli с нормальной ферментативной активностью) в обеих терапевтических группах, но у пациентов основной группы положительная динамика была достоверно более выраженной.
Четырехнедельная комплексная терапия привела к достоверному снижению уровня кортизола в группе
больных ХП. Известно, что уровень кортизола повышается при таких ситуациях, как боль, эмоциональный и психический стресс, поэтому снижение уровня кортизола на фоне положительной клинической динамики (прежде всего купирования болевого абдоминального синдрома) можно расценивать как физиологическую реакцию организма на устранение стрессирующих факторов (табл. 7).
Таблица 7. Динамика уровня кортизола на фоне терапии, М ± m.
Обсуждение
Теоретическое признание принципов системности, целостности и гомеостатической обусловленности
развития патологии все чаще вступает в противоречие с традиционными подходами, используемыми в лечении. При этом со стороны практических врачей зачастую преобладают эмпирические или схематические попытки повлиять на внешние признаки заболевания путем назначения симптоматической терапии, как правило, обладающей определенной нозоспецифичностью. Эти усилия, несмотря на ситуационную положительную эффективность, тем не менее, в большинстве случаев являются паллиативными, поскольку не обеспечивают нивелирования стойких нарушений гомеостаза, сопровождающих развитие практически любого патологического процесса. Между тем организм человека обладает огромным энергетическим и адаптационно-компенсаторным потенциалом, мобилизация которого является стержневым фактором в достижении положительного прогноза течения заболевания. Таким образом, формируется точка зрения о необходимости разработки новых методов лечения, имеющих метаболическую направленность и оказывающих позитивное влияние на ключевые метаболические процессы, участвующие в поддержании гомеостаза.
Оптимальным методом коррекции нарушений углеводного и липидного видов обмена у больных рецидивирующей формой ХП явилось восстановление функций микробно-тканевого комплекса кишечника на фоне компенсации моторных и секреторных расстройств.
Опыт использования комплексной метаболической терапии пациентов с ХП в клинике терапии усовершенствования врачей Военно-медицинской академии позволяет говорить как об адекватной коррекции состояния микробно-тканевого комплекса кишечника, улучшении функционального состояния гепатобилиарно-панкреатической зоны, так и об оптимизации липидного и углеводного видов обмена. Данный факт имеет огромное значение с учетом большой длительности терапии больных ХП, которая должна не только определяться нормализацией лабораторных показателей, но и продолжаться до полного восстановления функций микробно-тканевого комплекса кишечника.
Вывод
Таким образом, следует признать необходимость более широкого клинического взгляда на заболевания поджелудочной железы вообще и ХП в частности, обязательно с учетом потребности коррекции метаболических изменений, выявляемых у пациентов данной группы, прежде всего путем
восстановления адекватного функционирования микробно-тканевого комплекса кишечника.



