Cахарный диабет (СД) – самое распространенное эндокринное заболевание, которое во всем мире уже приняло характер неинфекционной эпидемии. Количество больных СД удваивается каждые 10–15
лет. Только за два года (с 2005 по 2007-й) число пациентов с СД в России увеличилось на 8,5 %, в США – на 13,5, в странах Среднего Востока – на 20,0, а в Океании – на 30,7 % [1]. К 1 января 2010 г. в России зарегистрированы 3,1 млн больных СД.
Более чем у 70 % пациентов с СД развиваются различные осложнения, в т. ч. синдром диабетической стопы (СДС) – сложный комплекс анатомо-функциональных изменений в тканях на фоне диабетической микро- и макроангиопатии, нейропатии и остеоартропатии. Почти у половины больных СДС осложняется развитием гнойно-некротических процессов на стопе, что в 50–75 % случаев приводит к ампутации на различном уровне. Частота ампутаций у больных СД, по различным источникам, в 17–45 раз выше, чем у лиц, не страдающих диабетом; до 30 % пациентов после первой
ампутации подвергаются ампутации второй конечности в течение ближайших 3 лет и до 50 % – в течение 5 лет. В среднем срок жизни составляет 5 лет после ампутации одной конечности и 1 год после ампутации двух конечностей. Несмотря на бурное развитие диабетологии с начала XXI в., появление массы международных и национальных рекомендаций по лечению СДС [2–5], а также внедрение в повседневную клиническую практику общепризнанных стандартов, проблема лечения данной категории больных не теряет своей актуальности и заставляет постоянно искать новые пути ее
решения.
Выявление при поступлении пациента с СД в стационар органной дисфункции (декомпенсация кардиальной патологии, нефропатии, наличие кетоацидоза или признаков сепсиса) служит показанием к госпитализации больного в профильное отделение реанимации, проведение в первую очередь интенсивной посиндромной терапии и детоксикации.
Тактика коррекции углеводного обмена определяется эндокринологом в соответствии с клиническими и лабораторными данными: при лечении гнойно-некротических форм СДС пациенты с СД любого типа могут быть переведены на терапию инсулином короткого действия не реже 4–6 раз в сутки до стабилизации уровня глюкозы крови в пределах 6–10 ммоль/л (гликемия натощак – 6–7 ммоль/л, через
2 часа после еды – 9–10 ммоль/л) или на схему введения пролонгированного инсулина утром и вечером и инсулина короткого действия в течение дня. Выбор рациональной эмпирической антибактериальной терапии основан на строгом обосновании показаний к ее проведению; локальном госпитальном микробном пейзаже и уровне резистентности; знании особенностей микрофлоры при конкретной
патологии; выраженности нефропатии; учете способности препарата проникать в мягкие ткани и кости; принципах деэскалации и ступенчатости.
С учетом полимикробного ассоциативного характера микрофлоры инфицированных очагов на стопе диабетика с участием нескольких аэробных и анаэробных возбудителей во всех случаях показана эмпирическая антибактериальная терапия антибиотиками широкого спектра действия. Длительность
антибактериальной терапии больных с обширными гнойно-некротическими процессами на фоне хирургического лечения может составлять до 10 недель, неадекватность выбора препарата, дозы и длительности лечения может приводить к развитию рецидива или суперинфекции.
На фоне СД помимо микробных ассоциаций раны, как правило, контаминированы и грибами, чаще дрожжами (различные виды Candida), поэтому необходима их верификация и назначение соответствующего антимикотика (флуконазол, вориконазол, каспофунгин и др).
Патогенетически обусловленная фармакотерапия основных осложнений СД (нейро- и ангиопатия, нарушение трофики тканей), по нашему мнению, должна включать (в отсутствие противопоказаний) следующие лекарственные средства:
• препараты α-липоевой кислоты (Берлитион, Тиогамма, Тиоктацид, Эспалипон) – улучшение трофики
нейронов, регулирование липидного и углеводного обмена, антиоксидантное, гепатопротекторное и
дезинтоксикационное действия;
• препараты витаминов группы В (Нейробион, Мильгамма, Нейромультивит), в которых ведущая роль принадлежит витамину В1 (бенфотиамину), подавляющему основные биохимические механизмы патогенеза индуцированного гипергликемией поражения сосудов [6];
• пентоксифиллин (Вазонит, Трентал, Агапурин), который улучшает реологические свойства крови и оказывает легкое фибринолитическое действие, обладает выраженными венотонизирующим и лимфодренирующим эффектами, а также предотвращает миграцию, адгезию и активацию лейкоцитов – важного звена патогенеза трофических расстройств;
• простагландин Е1 (Вазапростан, ВАП 20, Алпростан) расширяет артерии малого калибра, усиливает
кровоток в капиллярах, повышает фибринолитическую активность крови, подавляет агрегацию и адгезию тромбоцитов и лейкоцитов;
• активатор клеточного метаболизма депротеинизированный дериват (Актовегин) увеличивает захват и утилизацию кислорода и глюкозы, повышает клеточный энергетический статус и устойчивость к гипоксии. Инсулиноподобный механизм действия Актовегина отличается от такового непосредственно инсулина, т.к. липогенез, липолиз и транспорт глюкозы не ингибируются при использовании антиинсулиновых антител; более того, Актовегин не оказывает влияния на фосфорилирование инсулиновых рецепторов или на зависимость инсулина от его рецепторов. Препарат улучшает трофику нейронов, снижает выраженность нейропатии, что приводит к сокращению сроков эпителизации имеющихся раневых и язвенных дефектов и повышает эффективность профилактики аналогичных осложнений. Эффективность и безопасность Актовегина были подтверждены в многоцентровом рандомизированном двойном слепом плацебо контролируемом исследовании у 567 больных СД 2 типа и диабетической полиневропатией. Оценивались общие симптомы по шкале TSS, вибрационная чувствительность, сенсорные функции и качество жизни по опроснику SF-36. При первичном анализе показатель TSS был значительно ниже в группе больных, получавших лечение Актовегином, по сравнению с плацебо (р = 0,0003). Повышение порога вибрационной чувствительности по сравнению с исходным уровнем чаще отмечалось после назначения Актовегина, чем в группе плацебо (p = 0,017). Из вторичных конечных точек оценки сенсорных функций показатели NISLL, так же, как и качество жизни, значительно улучшались у больных, получавших Актовегин, по сравнению с плацебо. Различий в частоте побочных эффектов между группами выявлено не было, что подтверждает благоприятный профиль безопасности препарата [7]. Сведений о нежелательных эффектах лекарственных взаимодействий Актовегина с другими препаратами не обнаружено; препарат совместим и с любыми дополнительными методами лечения;
• лечебный алгоритм может включать сулодексид (Вессел Дуэ Ф) и низкомолекулярные гепарины
(Фраксипарин, Клексан, Фрагмин). Снижение плантарного давления у пациентов с нейропатической и нейроостеоартропатической, а также нейроишемической формами СДС требует полной разгрузки пораженной конечности. Иммобилизация достигается назначением постельного режима либо применением ортопедических средств – разгрузочный полубашмак, индивидуальная иммобилизирующая разгрузочная повязка Total Contact Cast (ТСС) в съемном или несъемном вариантах.
По мнению некоторых специалистов, фактором, ограничивающим использование или снижающим
эффективность несъемного ТСС (являющегося наиболее эффективным методом разгрузки [8]), может быть отек конечности.
Кроме того, известна необходимость “тренировочной ходьбы” (т. е. работы мышц голени) при поражении артериальных сосудов нижних конечностей – микро- и макроангиопатиях, которые практически всегда присутствуют у пациентов с СДС.
Описана роль стимуляции мышц голени электрическим импульсом в усилении венозного оттока и профилактике тромбоэмболических осложнений, однако эта процедура не находила до поры широкого применения в связи с интенсивными болевыми ощущениями у пациентов во время мышечного сокращения. Ситуация изменилась с появлением портативного аппарата Veinoplus. Меняющаяся конфигурация электрического импульса делает процедуру безболезненной и исключает появление тетанических мышечных сокращений; при проведении сеанса электроимпульсной миостимуляции
(ЭИМС) данным аппаратом объемная скорость кровотока увеличивается в 12, а пиковая линейная скорость кровотока – в 10 раз, при этом объем циркулирующей крови в конечности увеличивается в 7 раз [9, 10].
Veinoplus уже нашел широкое клиническое применение, показал свою эффективность и безопасность в лечении хронической венозной недостаточности и при посттромбофлебитическом синдроме, профилактике и лечении флебопатий у беременных; описана комплексная реабилитация пациенток после мастэктомии с применением технологии Veinoplus с целью уменьшения отека и болевого синдрома [9, 11, 12, 13]. Между тем данные по эффективности применения технологии Veinoplus в лечении пациентов с СДС на сегодняшний день отсутствуют, что и стало поводом к проведению клинического исследования.
Проанализированы результаты лечения 24 пациентов с различными формами СДС, находившихся на лечении в отделении гнойной хирургии ГКБ № 13 в 2010–2011 гг. Все пациенты имели идиопатический отек пораженной конечности или отек вследствие развития воспалительных изменений в мягких тканях и костях. Средний возраст больных от 42 до 75 лет составил 56,1 года; мужчин было 6, женщин – 18. СД 1 типа страдали 3 больных, СД 2 типа – 21 пациент (из них 20 человек – инсулинопотребным СД 2 типа). Распределение пациентов по степени СДС представлено в табл. 1.
Таблица 1. Распределение пациентов в группах по степени СДС.
Всем больным проведены коррекция гликемии, антибактериальная и метаболическая терапия, лечение нейро- и ангиопатии; использованы интерактивные перевязочные средства и дополнительные методы лечения. Всем пациентам применяли иммобилизацию или разгрузку пораженной конечности (постельный режим или ТСС). При этом в исследуемой группе (14 человек) также была использована ЭИМС пораженной конечности аппаратом Veinoplus: при максимальном отключении конечности от осевых нагрузок проведены курсы “тренировочной ходьбы” в постели. Абсолютными противопоказаниями к ЭИМС могут служить наличие кардиостимулятора, острые эмболоопасные тромбозы, выраженная артериальная недостаточность с признаками критической ишемии конечности, несанированный очаг в стопе, обширные влажные некрозы.
Сеанс ЭИМС длительностью 20 минут с индивидуальным подбором силы тока проводился от 2 до 5 раз
в сутки. Оценка результатов (степень уменьшения отека голени и стопы) проводилась на 1-е, 3 и 5-е сутки, затем каждые 7 суток; общий срок наблюдения составил 4 недели. Отмечено, что в исследуемой группе на 1-е сутки в среднем отек уменьшался на 45 %, на 3-и – еще на 40 %, а на 5-е сутки отеки
были купированы практически полностью. У 2 пациентов отмечен рецидив отека в связи с прогрессированием заболевания (14 %), у 12 пациентов рецидивов отеков не отмечено. В группе сравнения на 1-е сутки отек сокращался на 10 %, на 3-и – на 30 %, на 5-е сутки – еще на 20 %, а в дальнейшем практически не уменьшался. Быстрое купирование отека на фоне ЭИМС, улучшение гемодинамики в области трофических расстройств и оксигенации тканей в конечном итоге повлияли
на общие результаты лечения и привели к сокращению сроков пребывания пациентов в стационаре.
Местное лечение раневого дефекта заключается в очищении, промывании раны и наложении раневого покрытия.
Очищение раны достигается либо хирургическими, либо химическими (мы используем и рекомендуем
отечественный препарат Диотевин – дpeниpующий copбeнт c aнтиceптикoм диоксидином и пpoтeoлитичecким фepмeнтoм террилитином), либо физическими.
Из числа последних мы используем воздействие воздушно-плазменными потоками и экзогенным оксидом азота (NO-терапия) посредством отечественного аппарата “Плазон” (бесконтактное “выпаривание” некротизированных тканей, тотальный бактерицидный эффект, усиление утилизации кислорода в тканях, эндотелийпротективное действие, стимуляция роста соединительной ткани). Эффективна также ультразвуковая кавитация раны (атравматичное бесконтактное очищение и санация раны; аппарат “Sonoca”) и гидрохирургическая обработка (аппарат “VersaJet”). При промывании ран мы используем принцип “пульсирующей струи”, применяем охлажденный озонированный физиологический раствор или гипербарически оксигенизированные растворы антисептиков. Кроме того, проводим аэрацию пораженной конечности озон-кислородной газовой смесью в специальном изоляторе. Озонотерапия сопровождается рядом эффектов: антимикробным, фунгицидным и противовирусным; противовоспалительным и иммуномоделирующим действиями; усилением микроциркуляции; улучшением реологических свойств крови; нормализацией процессов перикисного окисления липидов и антиоксидантной защиты; увеличением оксигенации крови и снижением тканевой гипоксии. При промывании охлажденным раствором местная гипотермия сопровождается обезболивающим и противоотечным эффектами. В своей работе мы используем отечественный аппарат УОТА 60-01.
Раневой диализ гипербарически оксигенизированными растворами приводит к активному удалению
некротоксинов, стабилизации тканевого дыхания и стимуляции процессов пролиферации.
В качестве раневых покрытий мы используем интерактивные повязки в соответствии с принципом заживления ран во влажной среде (Moist Wound Healing, G.D. Winter, 1962) по системе TIME (Международный Консультативный Совет по лечению ран, 2003): T (Tissue) – удаление нежизнеспособных, в т. ч. некротизированных, тканей; I (Infection) – подавление инфекции; M (Moisture) – контроль уровня влажности (раневой экссудации); E (Edge) – стимуляция репаративных процессов и/или эпителизации.
Отдельно следует остановиться на биопокрытиях и биологических препаратах, которые мы используем в III фазе раневого процесса.
Богатая тромбоцитами плазма (БТП) – это плазма, концентрация тромбоцитов в которой превышает
нормальную (150000–350000/мкл): в БТП концентрация тромбоцитов около 1000000/мкл. Использование БТП для ускорения роста кости и мягких тканей стало настоящим прорывом в стоматологии, травматологии, спортивной медицине, косметологии и хирургии. Это одно из направлений тканевой инженерии и клеточной терапии [14–18, 20–29].
БТП является аутогенным источником факторов роста, которые получают в результате разделения цельной крови по градиенту плотности. Факторы роста – полученный из тромбоцитов фактор роста (PDGF), полученный из тромбоцитов фактор ангиогенеза (PDAF), трансформирующий фактор роста β (TGFb), инсулиноподобный фактор роста (IGF), фактор роста эндотелиальных клеток (PD-ECGF) – обладают локальной активностью и привлекают недифференцированные клетки в область повреждения, запуская процесс митоза этих клеток. Чем больше фактоов роста будет доставлено в область раны, тем больше потенциал заживления [17]. Кроме того, в процессе дегрануляции тромбоциты высвобождают большое количество веществ, обеспечивающих первичный гемостаз: серотонин, катехоламины, аденозиндифосфат; фибриноген, фибронектин, аденозинтрифосфат, фактор V, фактор 8 (фон Виллебранда), тромбоксан А2, кальций [14–16, 18].
В препарате тромбоциты оказываются захваченными фибриновой сетью, высвобождают свое содержимое, стабилизируют сгусток благодаря фибрину, коллагену и клейким гликопротеинам. Формируется фибриновая матрица, представленная естественным фибриновым сгустком, способствующим нормальной клеточной инфильтрации фибробластов и других клеток, играющих важную роль в заживлении ран.
Методики получения БТП, описанные в литературе, разнятся (с двойным и одинарным центрифугированием), однако общий для всех алгоритм получения БТП делится на два этапа: центрифугирование крови для отделения клеточной фракции от плазмы; активация тромбоцитарных факторов [19]. Нами используется технология получения обогащенной тромбоцитами плазмы испанского Института биоехнологий (BTI), при которой на 1-м этапе осуществляется центрифугирование крови в вакуумной пробирке, смешанной с цитратом натрия 3,8 % со скоростью 4600 об/мин в течение 8 минут, а на этапе активирования используется лишь 10 %-ный раствор хлорида кальция. Объем забранной крови определяется с учетом размера раневого дефекта. Время приготовления сгустка от момента забора крови до перевязки – 20–30 минут.
Коллагенсодержащие препараты также используются в различных областях медицины как самостоятельный фактор стимуляции регенерации тканей. Коллаген 1-го типа, полученный из кожи крупного рогатого скота, по своему составу и структуре максимально приближен к человеческому коллагену и является наиболее безопасным и высокобиосовместимым материалом [30, 31]. Мы применяем отечественное коллагеновое биодеградирующее раневое покрытие Коллост, представляющее собой коллаген 1-го типа, полученный из кожи теленка. Основное преимущество и отличие данного препарата от других аналогов в том, что в нем используется нативный нереконструированный коллаген; он имеет более высокие показатели стабильности и является матрицей для направленной тканевой регенерации. Это позволяет использовать Коллост не только как обычный микроимплантат, но и с целью активизации синтеза собственного коллагена [32]. Описан опыт применения препарата Коллост в хирургической коррекции мочевых свищей, лечении длительно
незаживающих ран, для профилактики несостоятельности при формировании кишечных анастомозов
[33–35].
За последние два года мы использовали описанные биопрепараты в лечении 47 пациентов с хроническими ранами различной этиологии, в т. ч. и при СДС: из них 29 больным местное лечение проведено с использованием только БТП, 5 – в лечении использовался только препарат Коллост, к 13
пациентам применялась комбинация БТП с Коллостом. Перевязки производились с использованием современных интерактивных перевязочных средств: суперпоглотители Tender Wet active caviti, создающие влажную среду для мембраны Коллост; сетчатые повязки Atrauman Ag, Hydrotul Branolind, позволяющие атравматично покрывать мембрану из БТП. Хорошие результаты получены и при совместном применении коллагенсодержащего препарата Коллост с гелем Актовегин – создание необходимой влажной среды и синергизм действия в стимуляции репаративных процессов; однако количество клинических наблюдений пока невелико (4 больных).
Клинический пример. В стационаре на лечении находилась больная С. 54 лет с клинической картиной
хронической длительно незаживающей раной 1 пальца левой стопы на фоне инсулинопотребного СД 2 типа тяжелого течения, СДС (нейропатическая форма, стадия 3 по Wagner). Произведены перевязки с использованием БТП с интервалом 7–8 суток. Период наблюдения – 34 дня. Произведено 5 перевязок с использованием БТП. При последнем визите отмечено значительное уменьшение раневого дефекта (на 70–75 %), глубина раны сократилась втрое.
Из дополнительных методов лечения нами также используется гипербарическая оксигенация в барокамере, приводящая к нарушению процессов жизнедеятельности микроорганизмов (особенно анаэробов) и снижению их резистентности к антибиотикам, а также к нормализации свертывающей
системы крови; квантовая терапия посредством отечественных аппаратов “Рикта” и “Рикта-Эсмил-2” –
сочетание эффектов лазерного, магнитного и инфракрасного излучений (противовоспалительный, сосудорасширяющий, противоотечный, спазмолитический, обезболивающий и биостимулирующий).
Особое место в лечении ран занимает использование местного воздействия отрицательного давления
(Topical negative pressure – TNP) или VAC-терапия (Vacuum-assisted closure – вакуум-ассистированные
повязки) или лечение ран отрицательным давлением (Negative Pressure Wound Treatment – NPWT). Метод широко используется в разных странах, последние годы – и в России [8, 36–39]. Наш опыт основан на результатах лечения более чем 500 больных с различными видами хирургических инфекций (в т. ч. и пациентов с СДС) с применением метода NPWT в течение 4 лет с использованием немецкого оборудования, расходных материалов “Vivano” и аналогов (например, вакуум-аспиратор В40А, Беларусь).
Целесообразность и эффективность применения метода основаны на его прямых и опосредованных эффектах: активное удаление избыточного раневого отделяемого; сохранение баланса влажной раневой среды; стимуляция неоангиогенеза; ускорение деконтаминации тканей раны; устранение
местного интерстициального отека;усиление локального кровообращения; деформация раневого ложа, стимуляция пролиферации; уменьшение площади и объема раневого дефекта; усиление оксигенации тканей; профилактика госпитальных раневых инфекций; усиление эффекта общего
медикаментозного лечения; сокращение затрат и сроков лечения больных.
Заключение
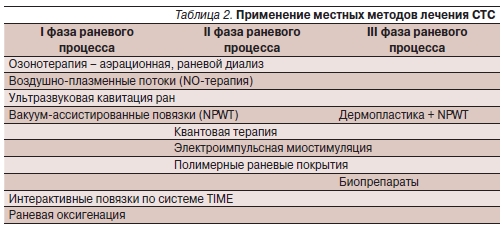
Разработка и внедрение новых методик лечения больных с различными ормами СДС, стандартизация тактики, с одной стороны, богатство выбора препаратов и методов, с другой, позволяют значительно улучшить результаты лечения и качество жизни пролеченных больных. Алгоритм использования местных методов лечения больных с СДС по фазам раневого процесса представлен в табл. 2.



