В большинстве стран мира, по данным отчетов ВОЗ, отмечается рост заболеваемости и смертности от первичных злокачественных опухолей печени, из них гепатоцеллюлярная карцинома (ГЦК) диагностируется среди 85 % пациентов. В структуре онкологической заболеваемости в мире ГЦК
занимает пятое место, а в структуре онкологической смертности – третье. Ежегодно в мире регистрируется более 600 тыс. новых случаев ГЦК и погибают от этой болезни до 1 млн человек [1]. В 2008 г. в России было выявлено 6473 случая первичного рака печени, а смертность составила 8319 случаев [2]. Соотношение числа умерших больных к вновь регистрируемым составляет 0,92, что характеризует ситуацию как крайне неблагоприятную. Наиболее изученными факторами риска развития ГЦК являются хронические гепатиты: вирусной (HBV и HСV), токсической (алкоголь, афлотоксин), метаболической (сахарный диабет, неалкогольная жировая болезнь печени, наследственный гемохроматоз) и аутоиммунной (первичный билиарный цирроз, аутоиммунные гепатиты) этиологии. Основными этиологическими факторами являются вирусные гепатиты, которые диагностируются у 50–85 % больных ГЦК. В последние годы в России отмечается рост заболеваемости вирусными гепатитами и циррозом печени (ЦП), что в будущем может сопровождаться увеличением показателей заболеваемости ГЦК.
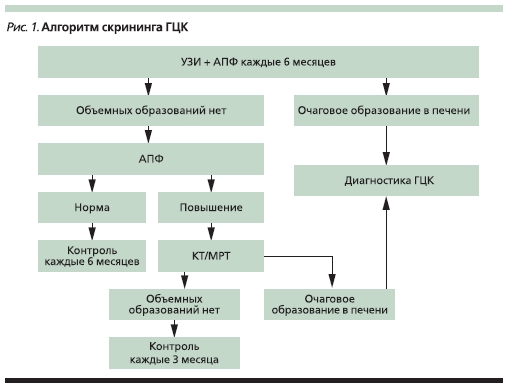
Успех при лечении ГЦК может быть достигнут только в случае диагностики заболевания на ранней (бессимптомной) стадии, поэтому всем больным групп риска следует проводить скрининговое обследование для выявления ГЦК. Около 4–12 месяцев требуется для развития опухоли от невыявляемых поражений до размера 2 см, а двукратное увеличение объема опухоли происходит в течение 2–4 месяцев [3]. Поэтому с учетом времени удвоения опухоли целесообразно проведение скрининга 2 раза в год. В плане скрининга ГЦК используют определение α1-фетопротеина (АФП)
и ультразвуковое исследование (УЗИ) печени. Алгоритм скрининга представлен на рис. 1. При выявлении объемного образования в печени либо повышения АФП диагностический алгоритм должен быть выполнен в полном объеме.
Методы диагностики ГЦК
Серологическая диагностика В настоящее время наиболее изученным опухолевым маркером является
АФП – чувствительность которого составляет 25–65 %, а специфичность –76–94 %. Специфичность теста ограничена ввиду повышения концентрации маркера у беременных женщин, детей первого года жизни (практически при любом заболевании), больных гепатитом и ЦП, эмбриональными, герминогенными опухолями. В настоящее время вместо АФП предложен набор других маркеров, таких как дез-γ-карбоксипротромбин, лециинреактивная фракция АФП, глипикан. Однако все опухолевые маркеры имеют недостатки и ни один из них не может сравниться с инструментальными методами по диагностической достоверности.
Инструментальная диагностика
УЗИ – если очаг более 1 см, чувствительность метода составляет 65–80 %, а специфичность > 90 %. Метод высокоинформативен в определении пораженных доли и сегментов печени, позволяет судить о состоянии ворот печени, инвазии опухоли в прилежащие к печени органы, обнаруживает увеличенные регионарные лимфатические узлы, асцит. Информативность метода возрастает, если применяется цветное допплеровское картирование (ЦДК), позволяющее выявлять опухолевую инфильтрацию сосудов, наличие тромбов. Эффективность оценки ухудшается при ЦП. Для решения этой задачи помимо ЦДК применяется УЗИ с контрастированием сосудов, что дает возможность уточнять вопрос о васкуляризации опухоли, взаимоотношении опухоли с афферентными и эфферентными сосудами печени. Определенную роль в УЗИ-диагностике ГЦК играет разработанная ультразвуковая семиотика ЦП (узловатость печени, замедление кровотока в ветвях воротной вены и печеночных венах, наличие и распределение варикозно расширенных вен, изменение формы пульсовой волны в печеночных венах). Интраоперационное УЗИ позволяет выявлять внутрипеченочные непальпируемые метастазы рака печени и опухолевые тромбы, идентифицировать опухолевые узлы менее 1 см при ЦП, уточнять внутрипеченочную сосудистую архитектуру. С учетом относительной безвредности и невысокой стоимости УЗИ метод является базовым в инструментальной диагностике ГЦК.
Рентгеновская компьютерная томография с контрастированием (РКТ) – чувствительность 100 % для очагов размером более 2 см, 93 % – 1–2 см, 60 % – менее 1 см; специфичность – 96 %. РКТ по сравнению с УЗИ обладает большими чувствительностью и специфичностью, особенно при диагностике опухолей диаметром менее 1 см. Особую ценность РКТ имеет для определения степени распространенности опухоли, ее четких анатомических границ и возможностей резекции. С помощью
внутривенного контрастирования РКТ позволяет дифференцировать первичный рак печени от гемангиом, узлов регенераторной гиперплазии, метастазов опухолей внепеченочных локализаций. Используется для точной диагностики тромбоза воротной вены и ее ветвей, печеночных вен. При этом можно получить трехмерное изображение и оценить взаимосвязь сосудов с опухолью печени.
Магниторезонансная томография с контрастированием (МРТ) – чувствительность 95 % для очагов размером более 1 см. При применении гепатоспецифичных контрастных препаратов специфичность МРТ достигает 100 %. Предпочтение МРТ отдается при наличии сопутствующего ЦП. МРТ информативна в обнаружении внутрипеченочных отсевов опухоли, распространении опухоли, дифференциальной диагностике ГЦК, метастатического рака и доброкачественных образований
печени (узловая гиперплазия, аденома, гемангиома).
Пункционная биопсия – метод морфологической диагностики опухолей печени, чувствительность 80 %, специфичность и прогнозирующая ценность – 90–100 %. Осуществляется под контролем УЗИ, РКТ, лапароскопии. Может выполняться неоднократно, возможна в амбулаторных условиях. Осложнениями практически не сопровождается (0,006–0,3 %). Значение пункции возрастает при нерезектабельности процесса.
Очень важной является оценка внепеченочной распространенности опухолевого процесса, т. е. диагностика отдаленных метастазов. Для этого всем больным следует проводить обзорную рентгенографию или компьютерную томографию органов грудной клетки, по показаниям – компьютерную томографию головного мозга, сцинтиграфию костей.
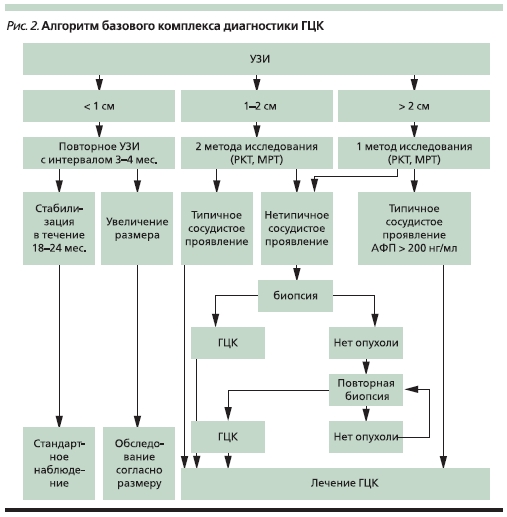
Выполнение базового диагностического комплекса (рис. 2), включающего методы неинвазивной визуализации, исследование крови на маркеры и пункционную биопсию, почти всегда позволяет достоверно судить о характере опухоли, ее размерах, долевой и сегментарной локализации, наличии
асцита, распространенности на ворота печени, отсевах внутри печени, наличии опухолевых тромбов в ветвях воротной вены или печеночных венах, поражении регионарных лимфатических узлов, распространении опухоли на прилежащие к печени органы или отдаленных метастазах.
По данным литературы, сопутствующий ЦП диагностируется среди 30–80 % пациентов с ГЦК, поэтому для решения вопроса о тактике лечения следует оценивать сохранность печеночно-клеточной функции [4].
К методам диагностики сопутствующего ЦП относятся:
1. Клинико-лабораторная оценка по шкале Child–Pugh.
2. Комплексные биохимические тесты.
3. Эластография и эластометрия печени.
4. Биопсия печени с гистологическим исследованием.
Лечение ГЦК
Методы лечения ГЦК:
1. Радикальные:
• резекция печени;
• трансплантация печени;
• радиочастотная термоаблация (РЧТА).
2. Паллиативные методы:
• трансартериальная химиоэмболизация (ТАХЭ);
• системная химиотерапия.
Хирургическое лечение
В настоящее время резекция печени остается основным методом лечения ГЦК, позволяющим
надеяться на удовлетворительные отдаленные результаты. По литературным данным, послеоперационная летальность варьируется от 0 до 13,5 %, а 5-летняя выживаемость – от 32 до 78 % [5–7]. Основными факторами, влияющими на решение вопроса о хирургическом лечении, являются размер и количество опухолей в печени, их локализация, врастание в магистральные сосуды, метастатическое поражение регионарных лимфатических узлов. При опухолях менее 5 см или 3 опухолях менее 3 см без сосудистой инвазии и внепеченочной распространенности опухолевого процесса (Миланские критерии) получены наилучшие результаты лечения. Так, по данным Poon и соавт., при соблюдении Миланских критериев оперативная летальность составила 4 %, а 1- и 5-летняя выживаемость – 90 и 70 % соответственно [8]. В исследовании Zhou и соавт. также показаны хорошие результаты хирургического лечения данной категории больных ГЦК: 5-летняя выживаемость – 64,8 %
[9]. Nathan и соавт. у тщательно отобранных пациентов отметили 5-летнюю выживаемость 78 % [10].
Однако среди большинства больных ГЦК диагностируется на более поздних стадиях, поэтому в последнее время во многих клиниках показания к хирургическому лечению ГЦК расширились. В 2009 г. на международной конференции Азиатско-Тихоокеанской ассоциации по изучению печени (APASL) была предложена стратегия лечения ГЦК, при которой для больных без отдаленных метастазов на первом этапе рекомендуется оценить возможность резекции печени (рис. 3).
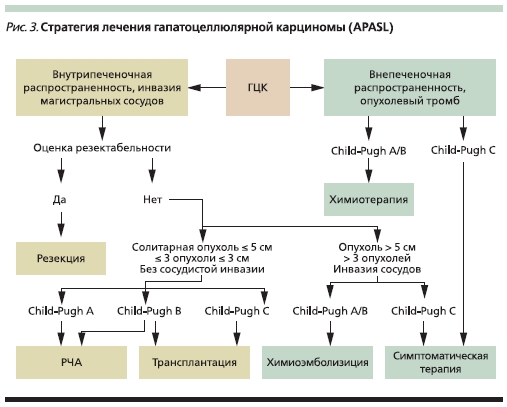
Критерии резектабельности:
1. Солитарная опухоль любого размера.
2. Множественные опухоли.
3. Инвазия магистральных сосудов, не вовлекающая все основные печеночные вены одновременно.
4. Сохранные функциональные резервы печени (без ЦП или ЦП Child–Pugh A).
5. Достаточный объем остающейся паренхимы печени (30 % в отсутствие ЦП и 5 % при ЦП Child–
Pugh A).
6. Отсутствие отдаленных метастазов.
7. При недостаточном объеме остающейся паренхимы печени возможна предоперационная эмболизация ветви воротной вены.
Основным фактом целесообразности расширения показаний к хирургическому лечению ГЦК является
оценка выживаемости пациентов. В литературе изложено много работ специализированных клиник, в которых ретроспективно оценены отдаленные результаты резекций печени у больных с большими, множественными очагами ГЦК, истинным опухолевым врастанием в крупные вены и даже тромбозом портальной вены [11–16]. Так, 5-летняя выживаемость пациентов с ГЦК размером более 10 см
варьируется от 20 до 38 %, по нашим данным, 5-летний рубеж пережили 31 % пациентов. При множественных очагах в печени (более 3 узлов) 5-летняя выживаемость составила от 25 до 58 % (на основании анализа нашего материала – 41 %). Инвазия магистральных сосудов также является
неблагоприятным прогностическим фактором, но 12,0–40,8 % пациентов, по данным литературы, переживают 5-летний рубеж после хирургического лечения (по нашим данным – 38 %).
Проанализировав данные литературы и наш опыт лечения пациентов с местнораспространенной ГЦК, мы считаем, что при технически возможной резекции печени без ущерба радикальности (R0) ее следует выполнять.
В настоящее время не определена и тактика лечения больных с метастазами в регионарные лимфатические узлы. Однако в последние годы появились публикации, демонстрирующие приемлемые отдаленные результаты хирургического лечения: 5-летняя выживаемость – от 21 до 26 % [17–19]. По нашим данным, 5 лет прожили 16 % таких пациентов, причем наилучшие результаты получены при поражении одного лимфатического узла гепатодуоденальной связки: 5-летняя выживаемость составила 40 %, а медиана выживаемости – 58 месяцев. Аналогичные результаты получены в
работе Kobayashi и соавт., в которой были проанализированы отдаленные результаты лечения пациентов после резекции печени с диссекцией регионарных лимфатических узлов в зависимости от количества метастазов в них: 5-летняя выживаемость при одиночном метастазе в лимфатическом узле
составила 27,8 %, медиана выживаемости – 52,3 месяца [19].
Другим важным вопросом, касающимся возможности хирургического лечения, является сохранность функции печени. По мнению большинства специалистов, на непосредственные результаты лечения ГЦК влияют сопутствующие вирусные гепатиты и ЦП [20–22]. Это происходит вследствие того, что у пациентов с сопутствующими патологическими процессами в печени функциональный резерв органа снижен и зачастую имеется многоочаговое поражение органа.
"Золотым стандартом" лечения ГЦК остаются резекция и ортотопическая трансплантация печени (ОТП). Некоторыми авторами ОТП рассматривается как основной метод лечения больных ГЦК с сопутствующим ЦП [23]. Это обусловлено тем, что ОТП обеспечивает лечение как опухолевого процесса, так и сопутствующего ЦП одновременно. Однако хорошие результаты после ОТП получены только при соблюдении Миланских критериев и результаты 5-летней выживаемости варьируются от 23,8 до 85 % [24, 25]. Это и многие другие проблемы, связанные с ОТП (нехватка донорских органов, длительность ожидания, высокая стоимость, необходимость пожизненной иммуносупрессивной терапии и др.), способствуют развитию показаний к резекции печени при ГЦК на фоне сопутствующего ЦП [26]. Кроме того, летальность после резекций печени (0–16 %), даже выполненных на фоне сопутствующего ЦП, сопоставима с таковой при ОТП (1,7– 18,3 %) [27, 28]. Важно осознавать, что
ЦП, как любое заболевание, подразделятся в зависимости от тяжести и поэтому всех пациентов нельзя объединять в одну группу. Проведя сравнительную оценку частоты послеоперационных осложнений у пациентов без ЦП, с ЦП Child–Pugh А и Child–Pugh В, мы выявили достоверное увеличение этого показателя для пациентов с ЦП Child–Pugh В по сравнению с ЦП Child–Pugh А (82,4 против 40,8 %;
р = 0,002). Уровень летальности при ЦП Child–Pugh В также был более чем в 2 раза выше (23,5 против 8,8 %; р = 0,15). Сходные результаты представлены Capussotti и соавт.: частота послеоперационных осложнений при ЦП Child–Pugh А и Child–Pugh В – 31,4 и 63,8 % соответственно (р = 0,0001), летальность – 4,7 и 21,3 % (р = 0,0003) [29]. Также мы обнаружили зависимость результатов лечения
от тяжести ЦП. В частности, 5-летняя выживаемость пациентов с ЦП Child–Pugh А была близкой к таковой больных без ЦП: 66,7 и 51,5 % соответственно (р = 0,1). В то же время при сопутствующем ЦП Child–Pugh В нами прослеживалась только 3-летняя выживаемость (21,8 %), которая была достоверно ниже, чем в остальных группах. В исследовании Capussoti и соавт. отмечено существенное различие в выживаемости пациентов с ЦП Child–Pugh А и Child–Pugh В: 5 лет прожили 42,9 и 10,6 % больных соот-
ветственно (р = 0,0001) [29].
В последние годы появились исследования, демонстрирующие сопоставимые результаты лечения больных ГЦК с компенсированным ЦП после резекций печени и ОТП [15, 30, 31]. Так, Margariti и соавт. провели сравнительную оценку результатов лечения больных моложе 70 лет с солитарным узлом ГЦК на фоне ЦП Child–Pugh А. Послеоперационная летальность и длительность пребывания в стационаре были выше после ОТП. Отдаленные результаты лечения были одинаковы ми в обеих группах. Однако частота рецидива была выше в группе резекций печени: 59 против 11 %. Авторами был сделан вывод, что на первом этапе целесообразно выполнять резекцию печени, а при выявлении прогрессирования опухолевого процесса – решать вопрос о возможной ОТП [31].
Таким образом, резекция печени остается основным методом лечения больных ГЦР. При выявлении сопутствующего ЦП важно провести на дооперационном этапе исследование функции печени. При диагностике ЦП Child–Pugh А целесообразно проведение резекций печени, но при планировании обширных резекций рекомендуется проводить тщательный отбор пациентов. Больным с ЦП Child–Pugh
В резекция печени противопоказана, и если соблюдены Миланские критерии, возможна ОТП. В остальных случаях показаны РЧТА, ТАХЭ, системная химиотерапия.
Радиочастотная термоабляция
Разрушение опухоли может достигаться различными методами. В частности, путем инстилляции в опухоль химических веществ – этанола или уксусной кислоты, изменения температуры в опухолевых очагах с использованием РЧТА и криоабляции.
РЧТА – один из методов выбора лечения больных с начальными стадиями ГЦК при невозможности выполнения резекций печени или наличии противопоказаний к ОТП, обусловленных сопутствующими заболеваниями.
Наилучшие клинические результаты при использовании абляции были получены у больных с единичными опухолевыми узлами ГЦК диаметром менее 2 см при нормальной функции печени, особенно при достижении полного некроза опухоли. Мета-анализ эффективности РЧТА и инстилляции этанола подтвердил преимущество РЧТА в выживаемости при опухолях до 2 см (5-летняя выживаемость может достигать 70 %).
Трансартериальная химиоэмболизация
В качестве метода локорегиональной лекарственной терапии рассматривается и ТАХЭ, применяемая при опухолях более крупного размера, чем подлежащих РЧТА, но связанная с большим риском осложнений, в особенности при сопутствующем хроническом гепатите В и ЦП. Сам по себе факт
эмболизации блокирует или по меньшей мере ограничивает кровоснабжение опухолевых масс. Дополнение эмболизации воздействием цитостатика в виде суспензии в жировом рентгенконтрастном веществе создает условия для длительного цитостатического действия на опухоль – теоретически без системных токсических эффектов. Противопоказанием к ТАХЭ следует считать поражение печени, превышающее 50 % объема орга-на, значительное повышение уровня трансаминаз, наличие энцефалопатии и билиарной обструкции. Даже при нормальном уровне билирубина расширение внутрипеченочных желчных протоков служит противопоказанием к ТАХЭ, которая может закончиться
некрозом сегмента печени. Наиболее серьезные осложнения – печеночная недостаточность, инфаркты, абсцессы печени и билиарный некроз – наблюдаются только в 3–4 % случаев.
Сводная статистика, касающаяся 800 больных ГЦК, которым в США, Европе и Азии была проведена ТАХЭ, свидетельствует, что общий ответ в виде сокращения объема опухоли со снижением содержания АФП в крови наблюдается среди 60–83 % больных с 1-летней выживаемостью от 54 до 88 %, 2-летней – в пределах 33–64 % и 3-летней – 18–51 %. Основываясь на практических рекомендациях EASL–EORTC, опубликованных в 2012 г, при отсутствии эффекта после двух курсов лечения ТАХЭ целесообразен перевод пациента на терапию сорафенибом [32].
Системная химиотерапия
В настоящее время проведено много исследований, касающихся фармакотерапии ГЦК, однако четких рекомендаций в отношении медикаментозного лечения этой опухоли не выработано. Трудности лекарственной терапии связаны с тем, что ГЦК чаще всего развивается на фоне хронических заболеваний печени, а это принципиально ограничивает применение химиотерапии необходимой интенсивности вследствие риска повышения токсичности. Кроме того, они объясняются низкой чувствительностью к химиотерапии, что обусловлено гиперэкспрессией гена множественной лекарственной устойчивости в гепатоцитах. Системная химиотерапия с включением антрациклинов при нормальном уровне билирубина и функции печени обеспечивает 10 %-ный объективный эффект без продления жизни больных. Комбинации на основе цисплатина улучшают объективный эффект, но также без продления жизни по сравнению с симптоматическим лечением. Комбинация цисплатина, интерферона альфа, доксорубицина и инфузий фторурацила характеризуется значительной токсичностью. Антрациклин-цисплатиновые комбинации устаревают по мере все более широкого внедрения в клиническую практику таргетных препаратов. Именно с ними связаны наибольшие надежды на успешное лечение распространенной ГЦК, т. к. это высоковаскуляризированная опухоль с богатой экспрессией васкулярного эндотелиального фактора роста (VEGF), что делает ее потенциально чувствительной к действию антиангиогенных препаратов. В современные стандарты лечения ГЦК из числа таргетных препаратов вошел только сорафениб. Это новый мультитаргетный препарат, целями воздействия которого служат как пролиферация, так и ангиогенез. Ингибирование
под его влиянием Raf/MEK/ERK-пути усиливает апоптоз в опухоли, снижает пролиферативную активность, блокирует ангиогенез.
В практических рекомендациях EASL–EORTC (2012) при распространенном ГЦК на фоне сохранной
функции печени проведение системной химиотерапии, применение тамоксифена, иммунотерапии признано не целесообразным, а стандартом терапии первой линии является сорафениб. В настоящее время не существует второй линии терапии ГЦК, поэтому если у пациентов отмечаются выраженные побочные реакции или прогрессирование опухолевого процесса на фоне лечения сорафенибом, то таких пациентов следует включать в клинические исследования [32].



