Введение
Рак легкого (РЛ) – одно из самых распространенных и трудноизлечимых злокачественных новообразований, самая частая злокачественная опухоль (20,4 %; Россия, 2008) и самая частая причина смерти от рака среди мужчин (27,8 %; Россия, 2008). В 2008 г. в России выявлено 56 767 новых случаев этого заболевания, скончались от него 51 364 человека, 80 % случаев РЛ составил немелкоклеточный рак (НМРЛ) [1, 2]. Прогноз заболевания независимо от стадии остается неблагоприятным: 5-летняя выживаемость больных РЛ составляет 15 %. В первую очередь это связано с поздней диагностикой, преимущественно на стадиях III (5-летняя выживаемость 9 %) и IV (2 %).
Основным является хирургический метод лечения РЛ; при неоперабельных и метастатических опухолях применяется комбинированная химиотерапия (ХТ), направленная на увеличение продолжительности жизни пациентов и улучшение ее качества [3, 5, 13, 15]. Одной из наиболее часто применяемых схем в первой линии лечения НМРЛ является комбинация паклитаксела и карбоплатина [3, 9, 15, 19]. Паклитаксел обеспечивает общую частоту ответа от 20 до 42 % у ранее нелеченных больных распространенным НМРЛ при годичной выживаемости, составившей приблизительно 40 % [4, 6, 14, 17]. При использовании комбинации паклитаксел + карбоплатин частота ответа варьируется от 27 до 62 %, медиана общей выживаемости – от 10 до 12 месяцев, а годичная выживаемость – от 22 до 54 % в отсутствие серьезных токсических эффектов [7, 9, 11–13]. С учетом высокой стоимости этих лекарственных средств представляется актуальной разработка более доступных отечественных химиопрепаратов, терапевтически эквивалентных оригинальным импортным медикаментам.
Таксакад® (паклитаксел) и Карбоплатин (ЗАО “БИОКАД”, Россия) изготавливают из субстанций собственного производства на современном заводе, соответствующем стандартам надлежащей производственной практики (GMP). Таксакад® и Карбоплатин фармацевтически эквивалентны оригинальным препаратам. В 2009–2011 гг. проведено открытое клиническое исследование эффективности, безопасности и переносимости препаратов Таксакад® и Карбоплатин среди пациентов с распространенным НМРЛ. В данной работе представлены итоговые результаты этого исследования.
Материал и методы
Исследование было выполнено на базе 10 ведущих медицинских учреждений Российской Федерации. Скрининговый отбор в исследование прошли 100 пациентов с диагнозом распространенного НМРЛ III–IV стадий.
Для включения в исследование пациент должен был соответствовать следующим критериям:
- возраст не менее 18 лет;
- подтвержденный диагноз НМРЛ III–IV стадий;
- наличие измеряемых очагов поражения;
- значение индекса по шкале Карновского в модификации ECOG (Eastern Cooperative Oncology Group) 0–1 балл включительно;
- ожидаемая продолжительность жизни более 20 недель.
Пациент не мог участвовать в исследовании в случае проведения цитостатической терапии до включения в исследование, при нейтропении, тромбоцитопении, периферической невропатии II и большей степени, метастатическом поражении головного мозга, наличии заболеваний, которые могли повлиять на оценку выраженности симптомов основного заболевания. К критериям исключения относилось и наличие других злокачественных заболеваний за последние 5 лет.
На протяжении исследования было запланировано проведение 6 курсов ХТ препаратами Таксакад® и Карбоплатин с интервалом в 21 день; оценка эффективности в период последующего наблюдения производилась через 6, 9 и 12 месяцев после начала лечения. Перед каждым введением препарата Таксакад® осуществлялась премедикация дексаметазоном, дифенгидрамином, ранитидином или циметидином с целью профилактики аллергических реакций. В первый день каждого цикла после премедикации больные, включенные в исследование, получали Таксакад® в дозе 175 мг/м2 в виде 3-часовой внутривенной инфузии, затем проводилась 30-минутная внутривенная инфузия Карбоплатина в дозе, соответствующей AUC (Area Under Curve) = 6.
Перед каждым курсом ХТ пациентам выполняли физикальное обследование, проводили оценку неврологического и соматического статусов по шкале Карновского в модификации ECOG, а также выполняли общий и биохимический анализы крови. Кроме того, на каждом визите оценивали наличие нежелательных явлений (НЯ) и серьезных НЯ (СНЯ).
При развитии нейтропении III–IV степеней и/или фебрильной нейтропении после проведения ХТ назначали курс ежедневных подкожных введений препарата гранулоцитарного колониестимулирующего фактора (Г-КСФ) Лейкостим® (филграстим; ЗАО “БИОКАД”, Россия) в дозе 5 мкг/ кг/сут до достижения числа нейтрофилов > 2 × 109/л.
Оценку противоопухолевого эффекта проводили на основании результатов компьютерной томографии (КТ) грудной клетки по критериям RECIST (Response Evaluation Criteria in Solid Tumours) 1.0 после 3 и 6 курсов химиотерапии, а также через 6, 9 и 12 месяцев после начала лечения. Полным ответом считалось исчезновение всех очагов поражения на срок не менее 4 недель, частичным – уменьшение измеряемых очагов на 30 % или более, прогрессированием – увеличение на 20 % наименьшей суммы очагов поражения, зарегистрированной за время наблюдения, или появление новых очагов. В ряде случаев в отсутствие по той или иной причине данных КТ заключение о прогрессировании заболевания делалось на основании данных клинической картины, например четко указывающих на появление новых метастазов и т. д.
Основными оцениваемыми показателями в данном исследовании были все случаи НЯ и СНЯ, связанные, по мнению исследователей, с применением исследуемого препарата, все случаи досрочного прекращения исследования из-за развития НЯ/СНЯ, частота получения клинического ответа после 6 циклов ХТ и время до прогрессирования.
Статистическую обработку полученных результатов проводили с помощью программы Statistiсa 8.0. При нормальном распределении значений и равной дисперсии признаков использовали критерий Стьюдента. При непараметрическом распределении данных использовали критерии Манна–Уитни и Вилкоксона, а также точный критерий Фишера. Для сравнения нескольких групп данных по одному признаку использовался метод ANOVA. Расчет среднего показателя времени до прогрессирования производили с помощью метода Каплана–Майера.
Результаты
В исследовании скрининговый отбор прошли 100 пациентов. Двенадцать больных были исключены из анализа по следующим причинам: отзыв согласия до введения исследуемых препаратов (1 человек), несоответствие критериям включения (10) и развитие острого инфаркта миокарда до введения исследуемого препарата (1). Таким образом, в анализ безопасности были включены 88 пациентов, которые соответствовали всем критериям включения в исследование и получили по меньшей мере одно введение препаратов Таксакад® и Карбоплатин.
При анализе эффективности применения комбинации препаратов были учтены данные 78 пациентов в связи с невозможностью оценить по данным КТ или клинической картине динамику состояния 10 пациентов, выбывших из исследования до проведения промежуточной оценки эффективности после проведения 1–3-го курсов ХТ в связи с отзывом согласия (3), развитием НЯ (2), летальным исходом (1), недостаточной приверженностью лечению (1), выходом из-под наблюдения (1), назначением терапии, не совместимой с протоколом (1), ухудшением общего состояния, согласно шкале Карновского в модификации ECOG (1).
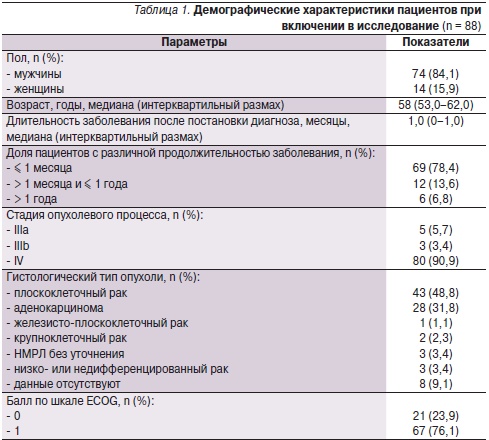
Демографические и исходные клинические характеристики пациентов в анализируемой группе (n = 88) представлены в табл. 1. Мужчины составили 84,1 % (74 человека), женщины – 15,9 % (14). Средний возраст (медиана и интерквартильный размах) соответствовал 58 (53,0–62,0) годам, минимальный – 34, максимальный – 72 годам. Медиана продолжительности заболевания с момента постановки диагноза составила один месяц. У 5 (5,7 %) пациентов была диагностирована IIIа стадия, у 3 (3,4 %) – IIIb и у 80 (90,9 %) – IV стадия НМРЛ. По результатам гистологического анализа у 43 (48,8 %) пациентов был выявлен плоскоклеточный рак различной степени дифференцировки (высоко- или низкодифференцированный), у 28 (31,8 %) – аденокарцинома (также с разной степенью дифференцировки), у 2 (2,3 %) – крупноклеточный, у 1 (1,1 %) – железисто-плоскоклеточный рак, у 3 (3,4 %) – НМРЛ без дополнительных уточнений и у 3 (3,4 %) – низко- или недифференцированный рак. У 8 (9,1 %) пациентов данные гистологического исследования отсутствовали, диагноз был подтвержден цитологически. Оценка по шкале ECOG у 23,9 % пациентов соответствовала 0, а у 76,1 % – 1 баллу.
В рамках исследования пациентам планировалось проведение 6 курсов ХТ, однако 8 пациентам по предложению исследователей на базе ГУЗ “Пермский краевой онкологический диспансер” с разрешения ЗАО “БИОКАД” были проведены дополнительные (до 9) курсы ХТ. Медиана числа курсов ХТ, проведенных в рамках исследования, составила 6,0 (3,0–,0).
Оценка безопасности и переносимости
Данные по безопасности и переносимости ХТ препаратами Таксакад® и Карбоплатин были проанализированы у всех больных, получивших хотя бы одну дозу исследуемой комбинации (n = 88). Данные о гематологической и негематологической токсичности представлены в табл. 2.
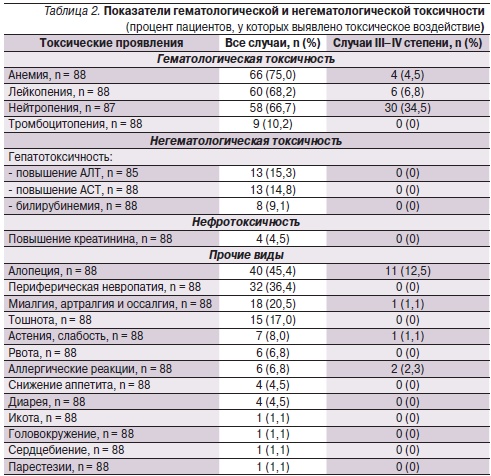
Следует отметить, что на скрининге у ряда пациентов отмечены отклонения от нормы по результатам общего и биохимического анализов крови. Так, среди 15,9 % наблюдалась анемия I степени, а среди 4,5 % – анемия II степени; у 22,7 % – тромбоцитоз, а у 2,3 % – тромбоцитопения I степени; у 48,9 % – лейкоцитоз, у 1,2 % – нейтропения I степени. Уровни билирубина и креатинина были выше нормы у 8,1 и 2,3 % пациентов соответственно, аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) – у 4,6 и 2,4 % соответственно.
На фоне проведенного лечения наблюдалась тенденция к снижению уровней гемоглобина, тромбоцитов, лейкоцитов и нейтрофилов. Следует отметить, что наименьшие уровни гемоглобина и тромбоцитов выявлены через неделю после введения химиопрепаратов, а содержание лейкоцитов и нейтрофилов было минимальным за неделю до проведения очередного курса ХТ, т. е. через 2 недели после курса ХТ.
К наиболее распространенным видам токсичности относились анемия (75,0 %), лейкопения (68,2 %), нейтропения (66,7 %) и тромбоцитопения (10,2 %). Нейтропения тяжелой степений (III–IV) была зарегистрирована среди 34,5 % пациентов и потребовала введения Г-КСФ 15 пациентам (48,4 % от общего числа больных нейтропенией).
На протяжении всего исследования каких-либо четких тенденций изменения показателей биохимического анализа крови, включая уровни билирубина, АСТ, АЛТ и креатинина, не наблюдалось. Повышение уровней билирубина, АСТ и АЛТ, а также креатинина было зарегистрировано среди незначительного числа пациентов (табл. 2). С учетом наличия у больных отклонений по данным показателям на скрининге можно считать маловероятным, что проведение 1–9 курсов ХТ препаратами Таксакад® и Карбоплатин по указанной схеме оказывает токсическое воздействие на почки и печень. Среди аллергических реакций следует выделить выраженную эозинофилию до 30 % (17,4 × 109/л) и повышение уровня иммуноглобулина Е тяжелой степени у одного пациента, отек Квинке на фоне первого введения препарата Таксакад® у одного пациента, что привело к выбытию их из исследования. На протяжении всего исследования в общей сложности было зарегистрировано 13 СНЯ, 2 (2,3 %) из которых были связаны, по мнению исследователей, с комбинированной терапией препаратами Таксакад® и Карбоплатин. Один из данных случаев СНЯ был связан с развитием слабости тяжелой степени: у пациента отмечена выраженная слабость, приведшая к госпитализации и задержке введения препаратов на 11 дней. Другой случай СНЯ, повлекший летальный исход, был связан с пароксизмом мерцательной аритмии и острой сердечно-сосудистой недостаточностью через несколько дней после введения исследуемых препаратов у соматически тяжелого пациента, страдавшего раком верхней доли левого легкого IV стадии с прорастанием в средостение и аортальное окно, наличием множественных отдаленных метастазов.
Семь из 13 зарегистрированных СНЯ закончились летально, все они были связаны с прогрессированием основного заболевания.
При оценке общесоматического статуса по шкале Карновского в модификации ECOG у пациентов, получивших хотя бы одну дозу исследуемого препарата (n = 88), индекс соответствовал 0 баллов у 14 (15,9 %) пациентов, 1 – у 61 (69,3 %), 2 – у 9 (10,2 %) и 3 – у 4 (4,6 %). Ухудшение данного показателя по сравнению с уровнем на скрининге было связано преимущественно с прогрессированием основного заболевания или сопутствующей патологией.
Оценка эффективности
При анализе эффективности комбинированной ХТ были учтены данные 78 пациентов в связи с невозможностью оценить динамику состояния 10 пациентов по данным КТ или клинической картине. При анализе во внимание принимался наилучший ответ на терапию, подтвержденный через месяц.
Среди пациентов, получивших от 1 до 9 курсов ХТ, частичный ответ был зарегистрирован у 20 (25,6 %) пациентов, стабилизация – у 35 (44,9 %) и прогрессирование – у 23 (29,5 %). В целом контроль роста опухоли наблюдался в 70,5 % случаев (табл. 3).
Таблица 3. Анализ эффективности химиотерапии по критериям RECIST 1.0.
При анализе эффективности в зависимости от гистологической формы опухоли частота частичных ответов и стабилизации была выше среди пациентов с плоскоклеточным раком по сравнению с больными аденокарциномой (табл. 4). Из 40 пациентов с плоскоклеточным раком частичный ответ был достигнут 11 (27,5 %) больными, стабилизация – 20 (50,0 %). Из 24 пациентов с аденокарциномой частичный ответ был зарегистрирован у 5 (20,8 %) больных, стабилизация – у 10 (41,7 %). В свою очередь прогрессирование чаще наблюдалось среди пациентов с аденокарциномой (37,5 %) по сравнению с больными плоскоклеточным раком (22,5 %).
Таблица 4. Эффективность при различных гистологических типах рака.
С помощью метода Каплана–Майера было рассчитано среднее время до прогрессирования (рис. 1), медиана которого составила 18 (9,0–39,0) недель, т. е. 4,2 месяца.

Обсуждение
Согласно определениям FDA (Food and Drug Administration), терапевтическая эквивалентность воспроизведенного и оригинального препаратов устанавливается исключительно в ходе исследований фармацевтической эквивалентности и биоэквивалентности. Несколько иначе терапевтическую эквивалентность определяет Всемирная организация здравоохранения: оригинальный препарат и генерик считаются эквивалентными в том случае, если они фармацевтически эквивалентны и после введения в одинаковой молярной дозе их показатели эффективности и безопасности совершенно одинаковы при одинаковом способе применения и при одних и тех же показаниях. Это можно продемонстрировать с помощью фармакокинетических и фармакодинамических или клинических исследований.
В соответствии с Федеральным законом Российской Федерации № 61-ФЗ от 12.04.2010 “Об обращении лекарственных средств” для оценки терапевтической эквивалентности должна быть представлена информация, полученная при проведении клинических исследований лекарственных препаратов и опубликованная в специализированных печатных изданиях, а также документы, содержащие результаты исследования биоэквивалентности и/ или терапевтической эквивалентности. Исследование терапевтической эквивалентности лекарств подразумевает проведение клинических исследований с их использованием, направленных на выявление одинаковых свойств изучаемых препаратов определенной лекарственной формы, а также на наличие одинаковых показателей их безопасности и эффективности.
С учетом достаточной изученности применения комбинации паклитаксела и карбоплатина при НМРЛ объем клинического изучения воспроизведенных препаратов может быть ограниченным. Так, при проведении клинического исследования генериков по протоколам, дизайн которых повторяет ранее проведенные международные многоцентровые исследования, возможно сравнение с ретроспективными данными, а объем выборки может быть значительно сокращен.
С целью проведения сравнительного анализа было выбрано три крупных клинических исследования эффективности и безопасности использования паклитаксела и карбоплатина при распространенном НМРЛ, имеющих аналогичный дизайн с проведенным ЗАО “БИОКАД” открытым клиническим исследованием эффективности и безопасности применения препаратов Таксакад® и Карбоплатин [10, 12, 16].
В многоцентровом рандомизированном сравнительном клиническом исследовании R. Rossel (2002) III фазы при использовании схемы паклитаксела в дозе 200 мг/м2 в виде 3-часовойвнутривенной инфузии и карбоплатина в дозе, соответствующей AUC = 6, с интервалом 21 день, 306 пациентов получили от 1 до 10 курсов ХТ (медиана – 4 курса) [16].
В сравнительном рандомизированном клиническом исследовании P. Кosmidis (2002) III фазы паклитаксел в дозе 200 мг/м2 в виде 3-часовой внутривенной инфузии и карбоплатин в дозе, соответствующей AUC = 6, вводили с интервалом 21 день в группе из 252 человек, пациенты получили от 1 до 6 курсов ХТ [10].
В проспективном рандомизированном клиническом исследовании P. Kosmidis (2000) III фазы паклитаксел в дозе 175 мг/м2 в виде 3-часовой внутривенной инфузии и карбоплатин в дозе, соответствующей AUC = 6, вводили с интервалом 21 день в группе из 99 пациентов, всего пациенты получили от 1 до 8 курсов ХТ (медиана – 5 курсов) [12]. Сравнительные данные анализа безопасности и переносимости представлены в табл. 5 и 6.
Таблица 5. Профиль гематологической токсичности комбинации паклитаксела и карбоплатина по результатам зарубежныхклинических исследований и данные, полученные в ходе исследования, проведенного ЗАО “БИОКАД”.
Таблица 6. Профиль негематологической токсичности комбинации паклитаксела и карбоплатина по результатам зарубежныхклинических исследований и данные, полученные в ходе исследования, проведенного ЗАО “БИОКАД”.
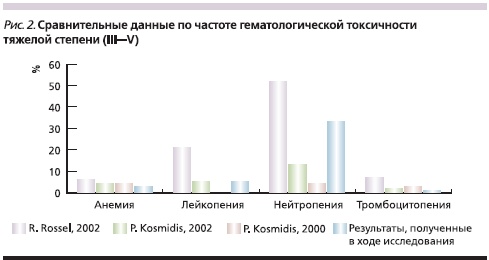
Сравнение частоты основных НЯ, особенно тяжелой степени (III–IV), в данном исследовании и международных клинических исследованиях (рис. 2 и 3) показало, что использование препаратов Таксакад® и Карбоплатин пациентами с распространенным НМРЛ по профилю безопасности соответствует оригинальным препаратам. Так, частота анемии, лейкопении и тромбоцитопении III–IV степеней была ниже или соответствовала данным международных исследований. В отношении нейтропении III–IV степеней следует отметить, что между результатами международных исследований были выраженные различия: по данным R. Rossel (2002), этот показатель составил 54 %, а по данным P. Kosmidis (2002) – 15 %, несмотря на использование одинаковой схемы терапии. Согласно данным P. Kosmidis (2000), тяжелая нейтропения наблюдалась среди 5,0 % пациентов. В проведенном ЗАО “БИОКАД” исследовании нейтропения III–IV степеней встречалась у 34,7 % пациентов.
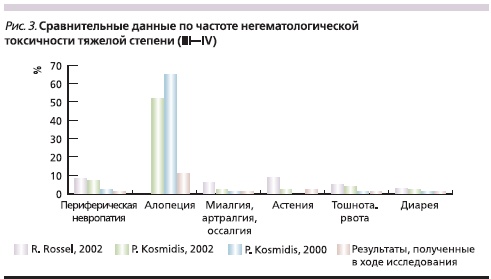
Прочие НЯ, такие как периферическая невропатия, алопеция, тошнота и рвота, артралгия/миалгия/оссалгия, астения и диарея, в целом встречались реже, чем у пациентов, принимавших участие в исследованиях оригинального препарата. Это особенно относится к НЯ, связанным с негематологической токсичностью тяжелой степени (рис. 3).
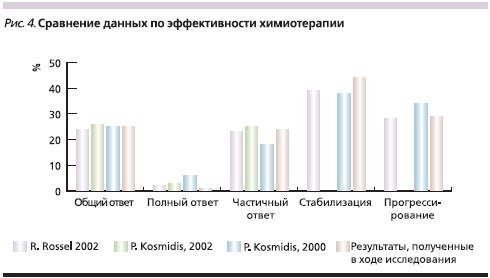
Полученные результаты оценки эффективности также согласуются с литературными данными (табл. 7). По данным R. Rosell (2002), среди 309 пациентов, получивших от 1 до 10 курсов паклитаксела в дозе 200 мг/м2 и карбоплатина в дозе, соответствующей AUC = 6, ответ на терапию был зарегистрирован у 25,1 % пациентов (полный ответ – 1,4 %, частичный – 23,7 %, стабилизация – 40,1 %), прогрессирование – у 28,7 % и ранний летальный исход– у 6,1 %. По данным P. Kosmidis (2002), в исследовании, проведенном с участием 252 пациентов, получивших 1–6 циклов ХТ паклитакселом и карбоплатином в тех же дозах, общий ответ получен среди 28 % больных (у 2 % – полный и у 26 % – частичный ответ), а медиана времени до прогрессирования составила 4 месяца. В исследовании P. Kosmidis (2000) использование паклитаксела в дозе 175 мг/м2 и карбоплатина в дозе, соответствующей AUC = 6, каждые 3 недели позволило достичь пациентами, получившими 1–8 курсов ХТ, ответа в 25,6 % случаев, при этом полный ответ был зарегистрирован в 6,7 % случаев, частичный – в 18,9 %, стабилизация – в 38,9 % и прогрессирование – в 35,6 %.
Таблица 7. Эффективность применения комбинации паклитаксела и карбоплатина по результатам зарубежных клиническихисследований и данные, полученные в ходе исследования, проведенного ЗАО ”БИОКАД”.
На рис. 4 видно, что частота объективного эффекта при проведении 1–9 курсов ХТ комбинацией препаратов Таксакад® в дозе 175 мг/м2 и Карбоплатина в дозе, соответствующей AUC = 6, не уступала данным международных исследований оригинального препарата. В проведенном ЗАО “БИОКАД” исследовании полных ответов зарегистрировано не было, однако частота частичных ответов и стабилизации была аналогичной показателям, полученным при использовании более высокой дозы оригинального препарата паклитаксела, а частота прогрессирования была несколько ниже, чем в исследовании P. Kosmidis (2000), в котором применялась аналогичная дозировка паклитаксела (175 мг/м2), и соответствовала результатам исследования R. Rosell (2002), в котором применялась более высокая доза данного препарата (200 мг/м2).
Медиана времени до прогрессирования по результатам проведенного исследования (4,2 месяца) полностью соответствовала данным литературы (4,2 месяца, по данным R.Rosell, 2002, и 4 месяца, по данным P. Kosmidis, 2002).
Таким образом, результаты проведенного исследования позволяют говорить о том, что препараты Таксакад® и Карбоплатин имеют характерные для данного класса лекарственных средств показатели безопасности, удовлетворительно переносятся пациентами и крайне редко вызывают СНЯ. Сопоставление полученных результатов с литературными данными по проведенным международным клиническим исследованиям продемонстрировало, что безопасность и эффективность комбинированной ХТ на основе препаратов Таксакад® и Карбоплатин не имеют существенных различий по сравнению с безопасностью и эффективностью комбинации оригинальных препаратов паклитаксела и карбоплатина, примененной по аналогичной схеме.
Информация об авторах:
Горбунова Вера Андреевна – доктор медицинских наук, профессор, руководитель отделения химиотерапии, Российская
Академия медицинских наук, Российский онкологический научный центр им. Н.Н. Блохина. Тел. 8 (495) 324-94-79;
Маренич Александр Федорович – кандидат медицинских наук, старший научный сотрудник, Российская Академия
медицинских наук, Российский онкологический научный центр им. Н.Н. Блохина. Тел. 8 (495) 324-94-79;
Реутова Елена Валерьевна – кандидат медицинских наук, Российская Академия медицинских наук, Российский
онкологический научный центр им. Н.Н. Блохина. Тел. 8 (495) 324-94-79;
Шевелева Людмила Петровна – заведующая химиотерапевтическим отделением
Волгоградский областной клинический онкологический диспансер № 1. Тел. 8 (8442) 355-159;
Карасева Нина Алексеевна – кандидат медицинских наук, доцент кафедры онкологии факультета последипломного
образования, заведующая онкологическим отделением № 6, Санкт-Петербургское государственное учреждение
здравоохранения “Городской клинический онкологический диспансер” Тел. 8 (812) 756-99-23;
Богданова Наталья Викторовна – кандидат медицинских наук, заведующая поликлиническим отделением,
Федеральное государственное учреждение “Московский научно-исследовательский онкологический
институт им. П.А. Герцена Росмедтехнологий”. Тел. 8 (495) 945-94-74;
Усков Дмитрий Альбертович – кандидат медицинских наук, ГУЗ “Московский областной онкологический диспансер”. Тел. 8 (495) 521-58-38,
Хасанов Рустем Шамильевич – доктор медицинских наук, профессор, главный врач, ГАУЗ “Республиканский клинический
онкологический диспансер Министерства здравоохранения Республики Татарстан”. Тел. 8 (843) 51-26-00;
Мухаметшина Гузель Зинуровна – кандидат медицинских наук, заведующая отделением химиотерапии № 1, ГАУЗ “Республиканский
клинический онкологический диспансер Министерства здравоохранения Республики Татарстан”. Тел. 8 (843) 519-27-20;
Тузиков Сергей Александрович – доктор медицинских наук, заведующий торакоабдоминальным отделением,
“Научно-исследовательский институт онкологии Томского научного центра СО РАМН”. Тел. 8 (3522) 418-056;
Хоринко Андрей Витальевич – заведующий химиотерапевтическим отделением № 1,
Пермский краевой онкологический диспансер. Тел. 8 (342) 228-00-96;
Прокопенко Татьяна Ивановна – Пермский краевой онкологический диспансер. Тел. 8 (342) 228-00-96;
Сакаева Дина Дамировна – доктор медицинских наук, заместитель главного врача ГУЗ “Башкирский
республиканский клинический онкологический диспансер МЗ РБ”. Тел. 8 (347) 248-51-50;
Борисов Василий Иванович – доктор медицинских наук, профессор, заместитель главного врача ГУЗ
“Московский городской клинический онкологический диспансер № 1”. Тел. 8 (495) 361-39-17;
Гуров Сергей Николаевич – кандидат медицинских наук, заведующий химиотерапевтическим отделением ГУЗ
“Московский городской клинический онкологический диспансер № 1”. Тел. 8 (495) 361-39-17;
Иванов Роман Алексеевич – вице-президент по разработкам и исследованиям ЗАО “БИОКАД”. Тел. 8 (495) 992-66-28;
Салафет Ольга Владимировна – медицинский эксперт ЗАО “БИОКАД”. Тел. 8 (495) 992-66-28



