Кишечные инфекционные заболевания являются актуальной проблемой здравоохранения и занимают одно из ведущих мест в структуре инфекционной патологии [1]. Патогенетически значимые токсины возбудителей острых кишечных инфекций (ОКИ) активно изучаются в последнее время как с целью создания новых методов диагностики, так и для возможного использования их уникальных свойств при создании новых лекарств и вакцин [2–5].
Образование циркулирующих иммунных комплексов (ЦИК) – это физиологический механизм защиты организма, приводящий к быстрому удалению эндогенных и экзогенных антигенов, токсинов, вирусов и бактерий ретикулоэндотелиальной системой. В норме иммунные комплексы, образовавшиеся в кровотоке из антигена, антител и компонентов комплемента, фагоцитируются и разрушаются. Количество ЦИК повышается при инфекциях, воспалении, аутоиммунных заболеваниях. Патологические реакции на иммунные комплексы могут быть обусловлены превышением скорости их образования над скоростью элиминации, дефицитом одного или нескольких компонентов комплемента, функциональными дефектами фагоцитарной системы. При увеличении размера (избыток антигена, присутствие в их структуре IgM, компонента комплемента C1q) комплексы могут откладываться в периваскулярном пространстве и корковом слое почек, вызывая активацию комплемента и воспалительных процессов.
Последние литературные данные свидетельствуют о том, что формирование антитоксических иммунных комплексов может приводить к неоднозначным последствиям. В экспериментальных исследованиях показано, что небольшие количества иммунных комплексов, включающих Shigella flexneri и секреторные IgA, селективно траспортировались в Пейеровы бляшки и интернализировались субэпителиальными дендритными клетками. Распознавание антигена секреторными IgA инициировало структурные изменения, которые придавали им усиленные свойства связывания с рецепторами. При этом регистрировалось локальное воспаление, небольшое повышение экспрессии провоспалительных субстанций, включая фактор некроза опухоли α (ФНОα), интерлейкин-6, циклооксигеназу-2 и интерферон γ, но морфология ткани не изменялась. В то же время при воздействии только бактерий S. flexneri отмечена высокая экспрессия тех же медиаторов. Это свидетельствовало о том, что в форме иммунных комплексов секреторный IgA обеспечивает иммунную элиминацию и нейтрализацию транслоцированных бактерий, предотвращает воспаление, сохраняет целостность кишечного барьера [6, 7].
Иммунные комплексы токсинов А и В Clostridium difficile с отдельными фракциями специфических моноклональных антител (в основном субизотипа антител IgG2a) оказывали более мощное инактивирующее воздействие на Rho-GTP-азу, сильнее разрушали цитоскелет и инициировали более активную продукцию ФНО-α, оказывая в итоге более сильный киллерный эффект на макрофаги и моноциты человека, чем просто токсины [8].
Определение маркеров токсинов в составе ЦИК может способствовать улучшению диагностики ОКИ, свидетельствовать об уровне гуморального антитоксического иммунитета, применяться для оценки проводимого лечения, разработки вакцин и установления их иммунологической эффективности.
Цель данного исследования – выявление маркеров токсинов кишечных бактерий в составе ЦИК сыворотки крови у больных ОКИ с целью диагностики и оценки гуморального иммунитета.
Материал и методы
Клинико-лабораторное обследование проведено среди 165 больных ОКИ различной этиологии, средней тяжести течения, поступивших с направляющим диагнозом “бактериальное пищевое отравление неустановленной этиологии (БПОНЭ)”. Бактериологическое подтверждение диагноза получено всего у 14,5 % больных. Обследование больных проводилось в разгар заболевания и в период реконвалесценции.
В качестве дополнительного метода расшифровки этиологии ОКИ мы применили наборы диагностикумов на основе натуральных или рекомбинантных антител. В реакции коагглютинации (РКА) на стекле в качестве маркеров возбудителей выявлены О-антигены (О-Аг) Shigella sonnei, S. flexneri1–6, Shigelladysenteriae1, SalmonellaВ, С1, С2, D, E серогрупп, YersiniapseudotuberculosisІ и ІІІ, YersiniaenterocoliticaО3, О7,8, О9, О4,33, О6,30, Campylobacter(C. jejuni, C. coli, C. lari), Vibrioсholerae01, а в РКА на планшете – маркеры Шига и шигаподобных токсинов (ШТ), токсинов А и В C. difficile (Диф. А и Диф. В), энтеротоксина типа А Clostridium perfringens (ЭТП), холероподобного энтеротоксина (ХЭТ). Диагностикумы были изготовлены и любезно предоставлены НИИЭМ им. Н.Ф. Гамалеи. Уровни среднемолекулярных ЦИК, осажденных из сыворотки крови с использованием 5 %-ного полиэтиленгликоля 6000, выявление в них и в составе копрофильтратов маркеров токсинов проведены в соответствии с ранее описанными методиками [9–12].
С целью оценки основных объективных симптомов интоксикации и диарейного синдрома учитывали максимальную высоту и длительность лихорадки, наибольшую частоту стула в день и общую длительность диареи, а также число лейкоцитов и лейкоцитарный индекс интоксикации (ЛИИ) [13] в разгар болезни.
В качестве контроля исследованы ЦИК сыворотки крови, полученные от здоровых доноров крови (25 человек).
Статистическая обработка данных выполнена по программам Microsoft Excel и Statistica 6.0, “Biostat” для IBM PC. Использованы параметрические и непараметрические критерии-χ2, Стьюдента.
Результаты и обсуждение
Этиологическая структура ОКИ (n = 165) была подтверждена (бактериологически, по выявлению О-Аг и маркеров токсинов возбудителей) всего у 95 % больных: у 6,0 % пациентов выявлен О-Аг одного возбудителя либо маркер одного токсина (клостридии), т. е. диагностирована моноинфекция, у 89 % установлено смешанное инфицирование (микст-Аг); у остальных пациентов (5,0 %) этиология заболевания не была установлена.
В сыворотке крови обследованных больных ОКИ маркеры токсинов в титре 1 : 8 (условно принятый диагностический титр) и выше были найдены с различной частотой (табл. 1).
Таблица 1.Частота выявления маркеров токсинов возбудителей инфекций у больных ОКИ в ЦИК сыворотки крови.
Как следует из данных табл. 1, в разгар заболевания с наибольшей частотой были выявлены токсин АC. difficile, затем (в порядке убывания) ШТ, токсин В C. difficile, ЭТП и ХЭТ. В динамике заболевания частота выявления маркеров Шига токсина и энтеротоксина C. perfringens достоверно увеличивалaсь (р ≤ 0,05), токсинов А и В C. difficile уменьшалась (р ≤ 0,05). У практически здоровых лиц титры маркеров токсинов в составе ЦИК не превышали титра 1 : 2 и встречались в среднем с частотой 11,2 % (р ≤ 0,05).
Уровни маркеров токсинов в ЦИК различались в зависимости от вида токсина и периода обследования (табл. 2).
Таблица 2.Средние уровни маркеров токсинов в ЦИК у больных ОКИ.
В разгар заболевания наиболее высоким был уровень маркера Диф. А, немного ниже – Диф. В, затем (в порядке убывания) уровни Шига токсина, ЭТП и ХЭТ. В динамике заболевания отмечены сочетанные колебания уровней маркеров токсинов Диф. А и Диф. В (снижение к периоду реконвалесценции), а также Шига токсина и ЭТП (нарастание; р ≤ 0,05).
Таким образом, у больных ОКИ отмечено активное формирование антитоксических ЦИК; с первых дней заболевания в составе ЦИК сыворотки крови определяются маркеры Шига токсина, Диф. А и Диф. В, ЭТП, однако динамика выявления маркеров токсинов отличается. Нарастание выявления маркеров Шига токсина и ЭТП в составе ЦИК может быть связано с ростом продукции специфических антитоксических антител.
Как полагают некоторые исследователи, применение эффективного антибактериального препарата, способствующего быстрому снижению в организме концентрации возбудителя, может вызывать снижение уровня антительного иммунного ответа и количества антитоксических иммунных комплексов.
В связи с этим мы проанализировали выявляемые в составе ЦИК уровни маркеров изучаемых токсинов в группах больных, получавших фторхинолоновые препараты (ципрофлоксацин) (1-я группа), в сравнении с группой больных, не получавших антибактериальных препаратов (2-я группа), а также с небольшой группой пациентов, получавших бактерийные препараты (колибактерин и бифидобактерин; 3-я группа; табл. 3). Для анализа во всех группах были взяты результаты выявления маркеров токсинов в ЦИК в период ранней реконвалесценции.
Таблица 3.Средние уровни маркеров токсинов в ЦИК в группах больных ОКИ в зависимости от проводимого лечения.
Как следует из табл. 3, общий уровень среднемолекулярных ЦИК в сыворотке крови в изученных группах больных практически не различался, также не было отличий от группы контроля.
Уровни маркеров во всех группах в сравнении с контролем достоверно различались, за исключением уровня ХЭТ 1-й и 2-й групп. Средний уровень маркера Шига токсина был наиболее высоким, но не различался по группам. Уровни маркеров остальных токсинов в группах 1 и 2 были достоверно ниже, чем Шига токсина. В группе 3 в сравнении с группой 1 отмечены достоверно более высокие уровни токсинов Диф. А, В и ХЭТ.
Анализ клинико-лабораторных показателей в этих группах больных показал, что средний уровень лейкоцитов и средний уровень ЛИИ во всех трех группах не различался, как и средние показатели максимально выраженной температурной реакции. В то же время в группе больных ОКИ, леченных фторхинолонами (1-я группа), выраженность и длительность лихорадки и диареи были достоверно выше, чем во 2-й группе. Наименьшая выраженность интоксикационного и диарейного синдромов отмечены в 3-й группе больных (табл. 4).
Таблица 4.Клинико-лабораторные показатели в группах больных ОКИ при различном лечении.
Динамика уровней маркеров токсинов в составе ЦИК сыворотки крови была изучена нами в 1-й и 2-й группах (см. рисунок). На фоне лечения фторхинолоновыми препаратами уровни маркеров токсинов в составе ЦИК отличались выраженными колебаниями, при этом динамика во 2-й группе была более плавной.
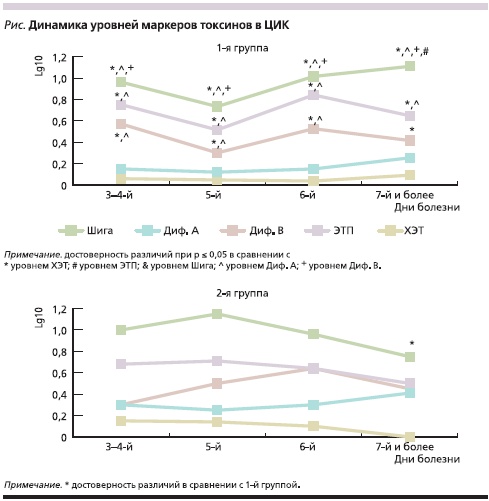
С учетом разницы в выраженности симптомов интоксикации и диареи, указанной выше, можно заключить, что, вероятно, более высокие уровни маркеров Диф. А и Диф. В, а также стабильно высокий уровень маркера ЭПТ в сроки до 4-го дня от начала заболевания в составе ЦИК отражают более высокий уровень интоксикациив 1-й группе больных, потребовавшей назначения фторхинолоновых препаратов. Затем в динамике заболевания в 1-й группе в ЦИК отмечается рост уровня маркера Шига токсина на фоне его снижения в 2-й группе, в последней также наблюдается плавное снижение уровней маркеров ЭТП и ХЭТ, что находит свое отражение в меньшей длительности лихорадки и диареи.
С учетом ранее опубликованных нами данных о динамике выявления маркеров токсинов в составе ЦИК в зависимости от токсигенной нагрузки в копрофильтратах [5] полученные в данном исследовании результаты свидетельствуют, что при ОКИ в сыворотке крови больных происходит формирование антитоксических ЦИК, включающих маркеры нескольких токсинов возбудителей кишечных инфекций, причем динамика выявления отдельных токсинов в ЦИК отличается по амплитуде и направленности.
В целом выявленные частоты и уровни маркеров токсинов в ЦИК коррелируют с выраженностью синдрома интоксикации, в частности с лихорадкой и диареей, отражая как их интенсивность, так и длительность.
Динамика выявления маркеров токсинов в составе ЦИК в случае назначения ципрофлоксацина отличается от таковой в группе больных, не получавших данный препарат. Особенно настораживает тенденция к росту уровня маркера Шига токсина. С одной стороны, это может быть связано с активной продукцией антишигатоксических антител и усиленным формированием соответствующих иммунных комплексов с преобладанием токсина над антителами в их составе. С другой стороны, это может свидетельствовать о постоянном источнике токсина (в кишечнике) за счет его активной продукции, несмотря на антибактериальное лечение [14]. Для уточнения характера этих процессов требуются дополнительные исследования.
Выводы
- Маркеры токсинов возбудителей ОКИ (Шига токсина, токсинов А и В C. difficile и энтеротоксина А C. perfringens) выявлены в составе ЦИК сыворотки крови с высокой частотой (58–34 %), холероподобный токсин выявлялся редко.
- Уровни маркеров токсинов в ЦИК подвержены значительным колебаниям в зависимости от вида маркера, периода заболевания и проводимого лечения.
- Частоты и уровни выявления маркеров токсинов в ЦИК коррелируют с выраженностью синдрома интоксикации, в частности лихорадкой и диареей.
- Лечение ципрофлоксацином приводит к росту уровня маркера Шига токсина в ЦИК, в то время как без приема данного препарата уровни маркера снижаются.
Информация об авторах:
Андрекайте Наталья Алексеевна – аспирант кафедры инфекционных болезней МПФ
ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ.
E-mail: natalie_sunny@mail.ru;
Белая Ольга Федоровна – профессор, доктор медицинских наук, профессор кафедры инфекционных
болезней ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ,
заведующая лабораторией по изучению токсических и септических состояний.
E-mail: ofbelaya@mail.ru;
Юдина Юлия Владимировна – кандидат медицинских наук, старший научный сотрудник лаборатории
по изучению токсических и септических состояний при кафедре инфекционных болезней
ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ.
Тел. 8 (495) 365-02-28, e-mail: jul175@mail.ru;
Белая Ю.А. – профессор, доктор медицинских наук, руководитель группы энтеральных инфекций
НИИЭМ им. Н.Ф. Гамалеи ФГБУ Росздрава.
Тел. 8 (499) 151-48-68;
Беликов Д.В. – кандидат медицинских наук, младший научный сотрудник лаборатории по изучению
токсических и септических состояний при кафедре инфекционных болезней ГОУ ВПО
“Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ


