Несмотря на достигнутые успехи в диагностике и лечении, острые кишечные инфекции (ОКИ) до настоящего времени представляют реальную угрозу здоровью и жизни людей, особенно в детском возрасте [1]. Инфекционные диареи занимают пятое место среди причин смерти детей до 5 лет [2]. Ежегодно регистрируется около 500 тыс. случаев заболеваемости ОКИ среди детского населения в России, при этом не только нет снижения заболеваемости, но и имеются тенденции к повышению показателей по отдельным ОКИ уточненной вирусной и бактериальной природы [3]. Официальная статистика не отражает истинной картины заболеваемости, т.к. зачастую регистрируются только среднетяжелые и тяжелые формы. Легкие формы лечатся амбулаторно, нередко без врачебного контроля, могут протекать под маской респираторных инфекций с незначительным диарейным синдромом, поэтому официально не регистрируются в этой группе. Такие пациенты могут контактировать с другими лицами с катарально-респираторным синдромом в отделениях больниц и являться источником нозокомиальных инфекций [4].
Изучение ОКИ актуально до сих пор по ряду факторов: высокая частота формирования неблагоприятных исходов ОКИ у детей различных возрастных групп, в т.ч. длительное реконвалесцентное вирусо- и бактериальное носительство, рост хронической гастроэнтерологической и аллергической патологии, нестойкость и незрелость иммунитета, особенно для групп детей раннего возраста [5–9]. Исследования российских ученых последних лет, проведенные на молекулярно-генетическом уровне, посвященные изучению причин летальных исходов у детей младшего возраста на фоне течения ОКИ, позволили выявить различные фоновые и сопутствующие состояния, связанные с последующим летальным исходом для этих детей. Детей с болезнью Дауна, пороками развития сердечно-сосудистой системы, сахарным диабетом, нарушениями питания, сопутствующей респираторной патологией отнесли к группе риска с развитием тяжелого и осложненного течения ОКИ [10]. С момента поступления они требуют индивидуального подхода, начиная с организационных мероприятий.
Этиология ОКИ в большинстве случаев представлена вирусными, бактериальными патогенами и простейшими. В многочисленных исследованиях установлено, что в структуре ОКИ на сегодняшний день превалируют вирусные диареи (50–80%) [11, 12]. Наиболее часто этиологическим фактором водянистой диареи среди вирусных агентов являются ротавирусы, именно ротавирусные гастроэнтериты протекают наиболее тяжело с быстрым развитием синдромов дегидратации различной степени тяжести и достаточно выраженными симптомами интоксикации, реже регистрируются норовирусные (генотип 2а), аденовирусные и астравирусные гастроэнтериты [12–14].
Ротавирусная инфекция – наиболее частая причина летальных исходов у детей младшего возраста при диарейных заболеваниях [2, 14, 15]. Вирусные инфекции все чаще протекают в форме микст-инфекций, это обусловлено, с одной стороны, несовершенностью иммуногенеза в детском возрасте, с другой стороны, применением высокоточных методов диагностики вирусных и бактериальных инфекций [14, 16]. Вирусно-бактериальные и вирусно-вирусные ассоциации взаимно отягощают течение друг друга, приводят к более глубоким структурным повреждениям кишечной стенки, а следовательно, имеют более длительный острый период и реконвалесценцию. Вирусно-бактериальные ОКИ протекают с активацией патогенной или (чаще) условно-патогенной микрофлоры (УПМ). Предпосылки для активации бактериальной флоры понятны: при вирусных ОКИ вследствие повреждения апикальных ворсинок кишечника скапливается большое количество нерасщепленных сахаров, что способствует активному росту отдельных представителей кишечной микрофлоры, развитию синдрома избыточного бактериального роста.
Вопрос о бактериальных кишечных инфекциях, несмотря на относительно небольшой удельный вес в структуре заболеваемости ОКИ, также остается актуальным, особенно в южных регионах России [17]. За последние 40 лет произошла смена наиболее частых возбудителей сальмонеллезов: на смену Salmonella typhimurium пришла Salmonella enteritidis. В последние годы отмечается рост сальмонеллеза группы С. Особенностями течения сальмонеллезов на современном этапе считаются частое (до 1/3) сочетанное течение болезни с ротавирусной инфекцией, длительное бактериовыделение [18]. Отмечается отчетливая тенденция к снижению частоты регистрации шигеллезов [3, 4, 16]. Не теряет своей значимости проблема эшерихиозов, энтеропатогенные штаммы Escherichia сoli являются причиной значительного числа летальных исходов в группе детей до 5 лет (1–3, 15).Достаточно высок (до 10,3%) удельный вес диареегенных эшерихий в детском возрасте при микст-инфекциях [15]. Кампилобактериоз у детей регистрируется редко (не более 5%), еще реже встречается иерсиниоз [3, 4].
До настоящего времени существует ряд нерешенных проблем в лечении бактериальных диарей. С одной стороны, это проблема диагностики, т.к. «золотой» стандарт (бактериологическое исследование) не может удовлетворять практическое здравоохранение ввиду его относительно низкой чувствительности, длительности исполнения и необходимости проведения до начала антибактериальной терапии. Высокочувствительные и «быстрые» методики (латекс-агглютинация, иммунохроматографические тесты) широко не внедрены в практику. С другой стороны, есть проблема терапевтическая – постоянная изменчивость возбудителей к антибактериальным препаратам, которые излишне широко используются в лечении ОКИ, и рост антибиотикорезистентных штаммов возбудителей [3, 4, 6, 9, 17, 18, 21].
Лечение ОКИ у детей сегодня – проблема достаточно сложная, требующая персонифицированного подхода к пациенту с учетом возможных предполагаемых этиологических агентов, обязательного учета совокупности отягощающих преморбидных факторов, возрастных особенностей, стадии и тяжести болезни.
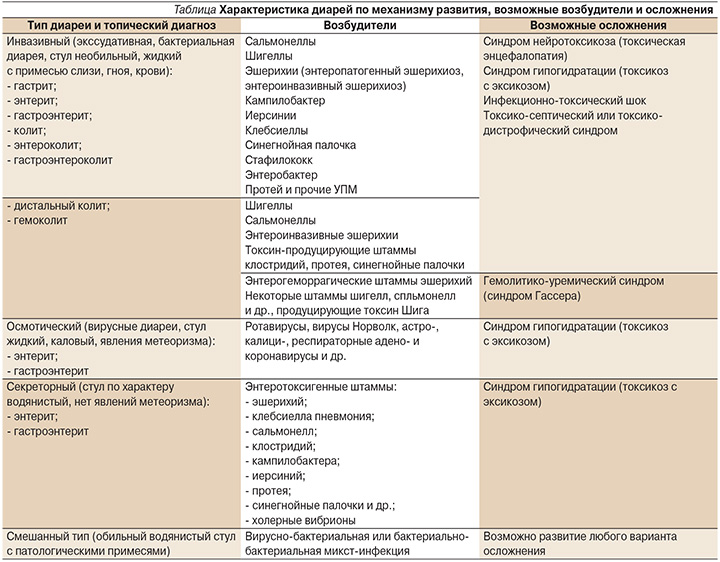
Первоначально необходимо определиться с типом диареи (см. таблицу), установить уровень поражения (топический диагноз), чтобы предположить этиологию заболевания, возможные осложнения и определиться с тактикой лечения ОКИ [9, 20, 23].
В ходе развития заболевания тип диареи может меняться, присоединяться осмотический или инвазивный компонент, что требует своевременной коррекции лечения, поэтому так важно в процессе лечения динамическое наблюдение за изменением характера стула, его визуальная оценка. Вопрос о целесообразности назначения противомикробного препарата решается именно по характеру стула (наличие патологических примесей), а не по этиологическому диагнозу. Исключение может составлять только иерсиниоз, который может протекать без диарейного синдрома и яркой клинической картины заболевания [9].
Лечение ОКИ всегда комплексное, но независимо от типа диареи всегда начинается с базисной стартовой терапии. Базисная стартовая терапия ОКИ у детей включает пероральную регидратацию, сорбционную и диетотерапию [9, 20, 23]. Пероральную регидратацию целесообразно проводить гипоосмолярными (менее 245 мОсм) солевыми растворами (рекомендация ВОЗ, 2008). Цель пероральной регидратации – восполнение дефицита жидкости и коррекция электролитных нарушений, наиболее выраженных при осмотическом и секреторном типах диареи. Правильно организованная и своевременно начатая пероральная регидратация позволяют избегать развития тяжелой гипогидратации и проведения парентеральной регидратации. Одной из насущных задач практического здравоохранения является обучение технике проведения пероральной регидратации родителей и лиц, ухаживающих за больным ребенком на дому.
Пероральная регидратация, стартовый момент при гипогидратации 1–2-й степеней, проводится в два этапа. Первичной задачей первого этапа является восполнение патологических текущих потерь жидкости и электролитов, возникших вследствие эксикоза. Его ориентировочная продолжительность – 6 часов, при этом ежечасный объем жидкости равен дефициту массы тела и рассчитывается по формуле:
мл/ч=M (кг)×P×10/6,
где: мл/ч – объем жидкости, вводимый больному за 1 час;
М – фактическая масса тела ребенка в кг;
Р – процент острой потери массы тела за счет эксикоза;
10 – коэффициент пропорциональности.
При ориентировочной оценке достаточности темпов регидратации удобно необходимый объем жидкости за час разделить на 12 или 20: так мы узнаем объем жидкости, который необходимо давать больному каждые 5 или 3 минуты.
Второй этап – поддерживающий, проводится в зависимости от продолжающихся потерь жидкости и солей с рвотой и испражнениями. Объем раствора для поддерживающей терапии в последующие 18 часов первых суток пероральной регидратации равен 80–100 мл/кг массы тела в сутки. Регидратация продолжается до ликвидации диарейного синдрома. Объем вводимой жидкости ориентировочно равен объему физиологической потребности ребенка данного возраста+объем патологических потерь с рвотой и стулом, который ориентировочно составляет 10 мл/кг на каждое испражнение.
Если во время проведения регидратации возникла рвота, нужно сделать небольшой перерыв (5–10 минут), затем продолжить ее. При необходимости приема пищи также необходимо сделать перерыв 10–15 минут до и после кормления, затем продолжить регидратацию [9, 20, 23].
Второй важной составляющей базисной терапии ОКИ является энтеросорбция [9, 20, 23]. Сорбируя на поверхности вирусы, токсины бактериальных патогенов, желчные кислоты, энтеросорбенты остаются единственным эффективным этиопатогенетическим методом лечения ОКИ с высоким уровнем доказательной базы [4, 28]. Кроме того, энтеросорбенты защищают эпителий пищеварительного тракта от повторного повреждения, создавая защитный слой на поверхности. Активно применяются природные, углеродные сорбенты, сорбенты химического происхождения, кремнийсодержащие сорбенты.
Диетотерапия – третье важное направление базисной терапии ОКИ. В настоящее время концепции лечебного питания при ОКИ значительно пересмотрены. Соблюдение голодных или водно-чайных пауз не приветствуется, т.к. доказано, что они усиливают процессы катаболизма, удлиняют процессы репарации и регенерации слизистой оболочки желудочно-кишечного тракта. Современным считается ступенчатый подход, предложенный в 2014 г. А.А. Плоскиревой. Данный метод базируется на организации питания в зависимости от тяжести состояния и стадии заболевания [4, 25]. Предлагается использование молочных адаптированных продуктов с пробиотическими добавками при легкой форме тяжести болезни или на этапе реконвалесценции и высокогидролизных продуктов функционального питания при тяжелых кишечных инфекциях в острый период болезни. Детей на грудном вскармливании также не рекомендуется переводить на искусственное питание при легких и среднетяжелых формах. В таких случаях необходимо уменьшить объем кормления на 30–50% (в зависимости от тяжести) и увеличить кратность приема. В случаях, когда имеются выраженные признаки мальабсорбции лактозы, к лечению добавляют препараты лактазы [7]. При водянистой диарее детей на искусственном вскармливании переводят на низко- или безлактозные смеси на острый период болезни [26]. При улучшении состояния важен обратный переход к лактозосодержащим продуктам, т.к. это способствует скорейшей нормализации микрофлоры кишечника.
Детям старшего возраста рекомендуется в острый период ОКИ диета № 4 с принципами механического и химического щажения. Исключаются продукты, способствующие брожению и усиливающие моторную и секреторную функции желудка. При тяжелых формах ОКИ детям старше года также показаны продукты лечебного (клинического) энтерального питания, способствующие уменьшению болевого, диарейного синдромов, скорейшему восстановлению микробиоценоза кишечника [27].
Терапию пробиотиками в последнее время также ставят в один ряд с другими компонентами базисной терапии (пероральной регидратацией, энтеросорбцией, диетотерапией). Доказано, что использование пробиотических препаратов в острый период болезни уменьшает длительность основных симптомов, улучшает санацию от возбудителя, способствует быстрейшему восстановлению микробиоценоза кишечника, улучшает метаболическую активность микрофлоры [4, 6,–9, 14, 18, 20, 24–26]. Эффект пробиотического препарата определяется штаммовым составом входящих в него бактерий [22]. ESPGHAN (The European Society for Paediatric Gastroenterolog) в 2014 г. в результате проведенных многочисленных исследований для лечения ОКИ рекомендовала использование следующих пробиотических штаммов бактерий: Lactobacillus rhamnosus GG, Saccharomyces boulardii, Lactobacillus reuteri [4]. Во многих исследованиях отмечены положительные аспекты применения пробиотиков продолжительными курсами не менее 4–6 недель [5–8].
Антибактериальная терапия ОКИ относится к виду этиотропной терапии при бактериальных кишечных инфекциях. Однако существующие проблемы в отношении антибактериальных препаратов в лечении ОКИ у детей ограничивают показания к их назначению только при среднетяжелых и тяжелых формах инвазивных диарей. Антибиотики не показаны при вирусных диареях, т.к. ухудшают состояние микробиоценоза кишечника и удлиняют сроки реконвалесценции, не способствуя улучшению санации от возбудителя [6, 9]. Однако использование антибиотиков и при ивазивной диарее далеко не всегда оправданно. Отмечено, что использование антибактериальных препаратов при лечении эшерихиозов, вызванных как E. coli О157: Н7, так и E. coli O104:H4, приводит к массивному высвобождению шигаподобного токсина, что в свою очередь увеличивает риск развития гемолитико-уремического синдрома (ГУС) [29].
Поэтому антимикробная терапия при ОКИ должна иметь ограниченное применение, особенно в педиатрической практике. По рекомендациям ВОЗ, к абсолютным показаниям к назначению антибактериальных препаратов при ОКИ относятся брюшной тиф, холера, амебиаз, шигеллез. Российские эксперты расширили показания к антибактериальной терапии для пациентов следующих категорий [4]:
- детям с тяжелыми формами ОКИ (в ряде случаев среднетяжелые);
- сочетанные вирусно-бактериальные и бактериально-бактериальные инфекции;
- осложненное течение болезни и наличие сопутствующих очагов;
- отягощенный преморбидный фон ребенка.
Включение в терапию фторхинолонов и триметоприм/сульфаметоксазола сопровождается высоким риском развития ГУС, а наиболее безопасным и эффективным считается использование карбапенемов, макролидов и рифаксимина [19, 21, 32]. Затяжное реконвалесцентное бактериовыделение сальмонелл формируется у значительного числа пациентов, которые получали антибиотики в острый период болезни, по сравнению с группой пациентов, не получавших антибиотик в этот период [4, 18, 21]. Наболее часто санации от сальмонелл не удавалось достигать пациентам, получавшим системную антибактериальную терапию [4, 18, 21]. Схожие результаты получены при комбинированной терапии шигеллезов: происходило угнетение гуморального звена иммунитета и фагоцитоза [4]. Нельзя забывать о том, что большинство антимикробных препаратов может способствовать развитию аллергических реакций, вплоть до анафилактического шока. В последнее время отмечается рост антибиотикассоциированой диареи, в т.ч. тяжелых антибиотикассоциированных колитов, обусловленных токсинообразующими штаммами Clostridium difficile [4].
Противомикробные препараты для лечения ОКИ делятся на невсасывающиеся, не оказывающие системного действия, т.н. кишечные антисептики, и противомикробные препараты системного действия. Кишечные антисептики создают высокие терапевтические концентрации в просвете желудочно-кишечного тракта, но практически не проникают в системный кровоток, поэтому не могут использоваться как монотерапия при генерализации процесса. Их цель – деконтаминация кишечника, что в большинстве случаев и необходимо при инвазивной ОКИ. Антибактериальные препараты системного действия отличаются низкой биодоступностью в просвете кишечника, основное их действие, максимальная концентрация отмечаются в системном кровотоке. Эти препараты работают в глубоких слоях кишечной стенки, лимфоузлах, паренхиматозных органах, поэтому могут рекомендоваться при генерализации или угрозе генерализации инфекционного процесса.
Типичным представителем невсасывающегося антимикробного препарата является препарат нитрофуранового ряда нифуроксазид. Его антибактериальная активность обусловлена продукцией нитроанионов. В результате взаимодействия нитрофурана с бактериальными агентами нарушаются процессы роста и деления бактериальных клеток. Нифуроксазид в среднетерапевтических дозах оказывает бактериостатическое, а в высоких – бактерицидное действие [16, 21]. Спектр чувствительности к нифуроксазиду достаточно широк, это представители семейств Enterobacteriaceae, Vibrionaceae, Campylobacteriaceae (E. coli, Shigella spp., Salmonella spp., Proteus spp., Klebsiella spp., Aerobacter faecalis, Aerobacter aerogenes, Vibrio cholerae, Campylobacter spp., Haemophillus spp.); грамположительные кокки (Staphylococcus spp., Streptococcus spp., Corynebacterium spp.); патогенные и условно-патогенные грибы (Candida albicans, Microsporum spp., Trichophyton spp.); некоторые простейшие (Trichomonas vaginalis, Lamblia intestinalis, Entamaeba hystolytica). Накоплен достаточно большой опыт применения нифураксозида [16, 21, 30, 31].
Более чем десятилетний положительный опыт применения нифураксозида в терапии сальмонеллезов, шигеллезов, эшерихиозов и инфекций, вызванных УПМ, позволяет рекомендовать терапию нифураксозидом в тех случаях, когда имеется необходимость назначения антибактериального препарата как стартового антимикробного средства [16, 21, 30, 31].
Ферментотерапия с заместительной целью проводится части пациентов, у которых имеются клинические и лабораторные признаки внешнесекреторной недостаточности поджелудочной железы. В этих случаях препараты назначают по стиханию острого периода, при расширении диеты в средних терапевтических дозировках длительностью 7–10 дней.
Иммунотерапия также имеет большое значение в комплексном лечении ОКИ. Многочисленные исследования российских и зарубежных ученых отмечают положительные аспекты в лечении тяжелых ОКИ различной этиологии, длительном бактериовыделении сальмонеллеза, вирусовыделении [6]. Применяются различные виды иммунобиологических препаратов, направленных на восстановление клеточного и гуморальных звеньев иммунитета [6, 18, 20].
Таким образом, лечение ОКИ у детей в современных условиях – достаточно сложная задача, требующая от специалиста знаний по этиологической структуре ОКИ, умения прогнозировать развитие ситуации у конкретного больного с учетом особенностей состояния его здоровья. Тем не менее постоянный мониторинг состояния пациента, соблюдение всех основ базисной терапии ОКИ, своевременность и точность выполнения разработанных подходов к лечению, диетотерапии, своевременность и адекватность назначения антимикробной терапии служат залогом успеха в лечении ОКИ любого возраста.



