Синдром внешнесекреторной недостаточности поджелудочной железы (ПЖ) обусловлен уменьшением массы функционирующей экзокринной паренхимы ПЖ в результате ее атрофии, фиброза, неоплазии либо нарушением оттока панкреатического секрета в двенадцатиперстную кишку (ДПК) в силу блока выводных протоков железы конкрементом, опухолью, густым и вязким секретом. Кроме того, выделяют т. н. вторичную панкреатическую недостаточность, когда панкреатические ферменты (ПФ) не активируются либо инактивируются в кишечнике. Наиболее частой причиной синдрома экзокринной панкреатической недостаточности является хронический панкреатит (ХП), при этом тяжесть синдрома со временем прогрессирует [1]. Недостаточность экскреторной функции ПЖ закономерно приводит к синдрому мальабсорбции и трофологической недостаточности.
На первый взгляд лечение синдрома мальабсорбции, возникающего у больных ХП с внешнесекреторной недостаточностью ПЖ, кажется довольно простым. Действительно, банальный пероральный прием экзогенных ПФ с заместительной целью должен быть весьма эффективным. Однако полная коррекция клинических проявлений панкреатической недостаточности достигается не так часто, что связано с множеством различных причин. Одним из важнейших факторов, влияющих на эффективность заместительной ферментной терапии, является правильный выбор препарата, его суточной и разовой дозы, кратности и времени приема [2].
В настоящее время фармакологический рынок чрезвычайно насыщен различными по составу, особенностям фармакокинетики и фармакодинамики, клиническим эффектам полиферментными препаратами, хотя их основным компонентом является экстракт ПЖ – панкреатин, содержащий протеазы, липазу и амилазу. Именно препараты “чистого” панкреатина и являются наиболее универсальными средствами, нормализующими пищеварение при синдромах мальдигестии и мальабсорбции, т. к. они обеспечивают достаточный спектр пищеварительной активности, способствуют купированию метеоризма, диареи и стеатореи, не оказывая влияния на функцию желудка, печени, моторику билиарной системы и кишечника.
Основная цель заместительной терапии ПФ заключается в обеспечении достаточной активности липазы в ДПК. Известно, что воздействие соляной кислоты на ПФ приводит к разрушению до 90 % их количества, что послужило обоснованием создания полиферментных препаратов в кислотоустойчивой оболочке. Использование препарата, имеющего такую оболочку, увеличивает всасывание жиров в среднем на 20 % по сравнению с сопоставимой дозой панкреатина без оболочки [3].
Важнейшим фактором, затрудняющим проведение эффективной заместительной ферментной терапии, является асинхронный гастродуоденальный транспорт ферментных препаратов и пищевого комка, что наблюдается при нарушениях пассажа (сахарный диабет, стеноз привратника, состояние после ваготомии, автономные нейропатии и т. д.), а также при применении ферментных препаратов сравнительно большого размера. Размер большинства таблеток или драже панкреатина составляет 5 мм и более. Тем не менее известно, что из желудка одновременно с пищей могут эвакуироваться твердые частицы, диаметр которых составляет не более 2 мм при оптимальном размере 1,4 мм [4]. Более крупные частицы, в частности ферментные препараты в таблетках или драже, эвакуируются в межпищеварительный период, когда пищевой химус в ДПК отсутствует. В результате препараты не смешиваются с пищей и недостаточно активно участвуют в процессах пищеварения. Если таблетка или драже длительное время находится в желудке, энтеросолюбильная оболочка разрушается, а находящиеся внутри ферменты инактивируются [5].
Поскольку максимальное физиологическое постпрандиальное поступление панкреатической липазы составляет приблизительно 140000 ЕД/ч в течение 4 часов после еды [6], а мальабсорбция не развивается, если в ДПК попадает более 5 % от нормальной максимальной продукции фермента, то для коррекции стеатореи необходимо обеспечить поступление не менее 28000 ЕД липазы в течение 4 часов постпрандиального периода (без учета дополнительных факторов – ацидификации ДПК, синдрома избыточного бактериального роста и др.). Соответственно, для коррекции стеатореи необходимо использовать только препараты с высоким содержанием липазы [7]. Однако на практике наиболее часто применяются коммерчески доступные препараты с содержанием липазы в одной таблетке (драже) в пределах 3500–6000 ЕД. Соответственно, минимально эффективной разовой дозой для коррекции стеатореи будет прием по крайней мере 5–8 драже или таблеток. Однако данные расчеты, несмотря на свою показательность, не учитывают тот факт, что большая часть применяемой липазы может быть инактивированной либо неактивированной ввиду затрудненного гастродуоденального транспорта (из-за размера таблеток). В этом случае следует говорить не о 5–8 таблетках, а минимум о 20–30 на прием пищи, что невозможно по психологическим причинам. Таким образом, становится понятно, почему традиционно используемое меньшее количество экзогенно принимаемых ферментов уменьшает стеаторею, но не ликвидирует ее.
Поэтому неоспоримым является мнение, что применение энтеросолюбильного таблетированного панкреатина (ТП), особенно в традиционных дозах, для лечения экзокринной недостаточности ПЖ практически бесполезно [1, 8].
Для обеспечения быстрого и гомогенного смешивания ПФ с пищевым химусом, предотвращения внутрижелудочной инактивации и адекватного пассажа из желудка в ДПК были созданы ферментные препараты панкреатина нового поколения в виде микротаблеток и мини-микросфер, диаметр которых не превышает 2 мм. Препараты покрыты энтеросолюбильными оболочками и заключены в желатиновые капсулы. При попадании в желудок желатиновые капсулы быстро растворяются, мини-микросферы или микротаблетки смешиваются с пищей и постепенно поступают в ДПК. При рН дуоденального содержимого выше 5,5 оболочки растворяются и ПФ начинают действовать на большой поверхности. При этом практически воспроизводятся физиологические процессы пищеварения, когда панкреатический сок выделяется порциями в ответ на периодическое поступление пищи из желудка [1].
Таким образом, именно мини-микросферические и микротаблетированные препараты можно отнести к самым современным полиферментным препаратам для заместительной ферментной терапии, в т. ч. отвечающим современным требованиям к данным препаратам, сформулированным на основании экспериментальных, теоретических, биохимических и клинических данных, представленных выше.
Поскольку ферментные препараты при ХП с внешнесекреторной недостаточностью в большинстве случаев назначают пожизненно, немаловажными становятся вопросы безопасности и стоимости лечения. Если в отношении безопасности ситуация уже много лет является прозрачной, поскольку препараты панкреатина – одни из наиболее безопасных среди применяемых в гастроэнтерологии [1, 9], то в отношении стоимости – вопрос пока однозначно не решен. Действительно, одним из наиболее проблемных аспектов применения новых мини-микросферических препаратов панкреатина является их более высокая стоимость за упаковку по сравнению с ТП. Но, как известно, стоимость лечения складывается не только из цены на применяемое лекарство, а из широкого спектра прямых, косвенных и нематериальных затрат на лечение, только комплексная оценка которых позволяет реально оценить стоимость терапии [10].
Нам не удалось найти в англоязычной литературе фармакоэкономических исследований, посвященных изучению эффективности и стоимости терапии препаратами панкреатина. Отчасти это понятно, т. к. по крайней мере уже более десятилетия в странах Западной Европы и США среди лекарственных форм панкреатина существуют только препараты IV поколения (минимикросферы и микротаблетки). Они характеризуются сопоставимой фармакокинетикой и динамикой с некоторым преимуществом у мини-микросфер за счет в 2 раза большей площади соприкосновения с химусом, обусловленным меньшим диаметром частиц. При этом в России было выполнено фармакоэкономическое исследование ТП [11], в котором показано, что панкреатин в таблетках в эквивалентных дозах по липазе эффективнее Креона в контроле болевого синдрома, проявлений экзокринной панкреатической недостаточности и, что самое главное, использование ТП в 1,5 раза дешевле [11]. Данные результаты настолько неожиданны, что ряд отечественных ученых в различного рода публикациях позволяют себе утверждать, что полученные данные на примере различных препаратов панкреатина дают повод говорить о неэкономичности применения современных лекарственных средств [12]. И все это происходит в то время, когда весь цивилизованный мир использует только галенические препараты IV поколения (Креон® и аналоги). В то же время существует отечественное исследование, демонстрирующее серьезные фармакоэкономические преимущества применения Креона у детей с муковисцидозом [13], при этом масштаб и длительность наблюдений весьма существенны, что безусловно повышает доверие к результатам этой работы.
Необходимо разобраться в особенностях “фармакоэкономических преимуществ” ТП [11]. Во-первых, авторами было показано, что применение ТП в 1,5 раза дешевле. Однако собственно стоимость ТП дешевле таковой Креона более чем в 3 раза. Если фармакоэкономический анализ был проведен правильно, возникает вопрос: за счет чего уменьшилась разница? Вероятно, не у всех больных, принимавших ТП, было все так оптимистично – ввиду низкой эффективности потребовалось применение других лекарственных средств, дополнительных обследований и т. п. Во-вторых, серия наблюдений крайне мала – по 15 больных ХП в двух группах (о какой достоверной статистике вообще идет речь, когда разница по эффективности составляет 20 %, а сумма погрешностей в обеих группах при сравнении превышает 22 %?). В-третьих, включались больные исключительно с легкой и умеренной, а не тяжелой панкреатической недостаточностью, у которых вряд ли можно ожидать выраженного снижения продукции панкреатических бикарбонатов и ацидификации ДПК. Следовательно, результаты исследований, представленные в указанной выше статье, требуют по меньшей мере уточнения, объяснения и безусловно обследования большего числа пациентов для получения действительно статистически достоверных данных. Лишь после этого можно будет реально оценить фармакоэкономические преимущества двух сравниваемых препаратов.
Исходя из изложенного выше, было решено провести данное исследование, целью которого являлся сравнительный ретроспективный анализ клинической и фармакоэкономической эффективности заместительной ферментной терапии у больных ХП с внешнесекреторной недостаточностью ПЖ различными препаратами панкреатина (минимикросферический – Креон® или ТП в эквивалентных дозах по липазе).
Материал и методы
Проведено ретроспективное сравнительное исследование на модели законченного стационарного страхового случая по диагнозу “хронический панкреатит” (код –К 86,1 по МКБ 10). Согласно критериям включения и исключения, представленным ниже, был проведен анализ 795 архивных историй болезни больных, пролеченных в гастроэнтерологическом отделении ЦКБ № 2 им. Н.А. Семашко ОАО РЖД (директор –проф. Калинин М.Р.) и выписанных из стационара с основным диагнозом ХП с внешнесекреторной недостаточностью за период с 2007 по 2010 г. Сравнивалось применение двух различных ферментных препаратов панкреатина в эквивалентных дозах по липазе (Креон® и Мезим форте 10000).
Критерии включения в исследование:
- Код выписного диагноза К86,1 по МКБ 10-го пересмотра.
- Возраст – 20–55 лет. Больные старшего возраста не включались в исследование для минимизации вероятности ассоциации с сопутствующими заболеваниями, требующими дополнительного приема препаратов, способных повлиять на течение основного заболевания, и тем самым для уменьшения полипрагмазии.
- Отмеченные в первичной медицинской документации на момент обращения клинические проявления экзокринной недостаточности ПЖ (нарушения стула, стеаторея, вздутие живота).
- Анамнестические данные, позволяющие предполагать диагноз ХП (регулярное употребление алкоголя и/или табакокурение, и/или доказанная патология билиарного тракта, документированный острый панкреатит в анамнезе).
- Данные лучевых методов диагностики (ультразвуковое исследование и/ или компьютерная томография), демонстрирующие типичные признаки ХП (изменение размеров ПЖ, дилатация панкреатического протока, неровность контуров и неоднородность паренхимы ПЖ, конкременты или кальцификация паренхимы ПЖ, повышение эхогенности стенок главного панкреатического протока).
- Лечение препаратами Креон® или Мезим форте 10000 в дозах не менее 100000 ЕД липолитической активности в сутки. Допускалось варьирование дозы от 10 до 30–40 тыс. ЕД во время еды в зависимости об объема принимаемой пищи (больше – в основные приемы пищи; меньше – в промежуточные).
- Стабильная терапия ферментными препаратами не менее двух недель (использование неизменной дозы). В исследование включались пациенты, имеющие все семь критериев.
Критерии исключения из исследовния:
- Клинико-инструментальные признаки острого панкреатита.
- Наличие гепатита, цирроза печени любой этиологии.
- Гастроэзофагеальная рефлюксная болезнь в форме эрозивного рефлюкс-эзофагита и/или пищевод Барретта в момент госпитализации, а также неэрозивная рефлюксная болезнь, требующая применения ингибиторов протонной помпы в любом режиме.
- Обострение язвенной болезни желудка и/или ДПК.
- Острые эрозии гастродуоденальной зоны любой этиологии.
- Синдром Золлингера–Эллисона.
- Состояние после резекции желудка или гастрэктомии.
- Синдром мезентериальной ишемии.
- Любые другие причины хронической диареи (глютеновая энтеропатия, лактазная недостаточность, воспалительные заболевания кишечника и др.).
- Сопутствующий прием препаратов, влияющих на тонус сфинктера Одди: антагонистов кальциевых каналов, нитратов и/или препаратов, прямо влияющих на экзокринную панкреатическую секрецию (октреотид).
- Любые сопутствующие заболевания в стадии декомпенсации (сердечнососудистая, почечная недостаточность, сахарный диабет и др.).
- Любые опухолевые (злокачественные) заболевания органов пищеварения и других локализаций, химиотерапия и лучевая терапия в анамнезе.
В исследование не включались пациенты, отвечающие любому из вышеприведенных критериев.
Как видно из рисунка, по мере реализации критериев отбора из исследования постепенно исключались некоторые истории болезни. Так, из исходно отобранных 795 пациентов по возрастному критерию и диагнозу после оценки по критериям исключения остались только 585. На следующем этапе было оценено наличие исходных жалоб на момент поступления (в направлении из поликлиники, в листе осмотра врачом-терапевтом приемного отделения и в карте первичного осмотра лечащим врачом в отделении). Как следует из рисунка, интересующие нас жалобы были не у всех больных, и количество участвующих в исследовании историй болезни сократилось до 521. Далее во всех оставшихся историях проверено соответствие диагнозу ХП с помощью анамнестических и инструментальных данных. При этом оказалось, что диагноз ХП был убедительно доказан только в 415 случаях из 521. В дальнейшем мы оценили наличие ряда обязательных исследований – копрологического исследования, тотальной колоноскопии для убедительного подтверждения отсутствия указаний на критерии исключения. При последующем анализе листов назначений мы отметили, что т. н. высокодозовую заместительную терапию получали только 215 больных и только у 187 из них дозы ферментных препаратов были стабильными (не менялись) в течение минимум двух недель.
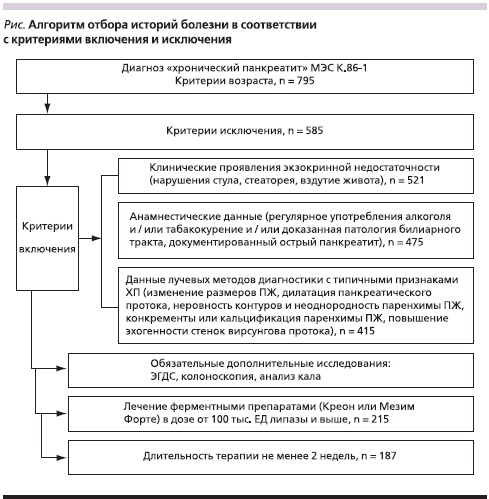
Вошедшие в исследование пациенты (n = 187) были разделены на две группы в зависимости от назначаемого препарата. Первая группа – 151 пациент, в качестве заместительной терапии получавший капсулы Креона, вторая группа – 36 пациентов, которым был назначен ТП в эквивалентных дозах по липазе.
Считалось допустимым включать в исследование истории болезни пациентов, принимавших следующие лекарственные средства с потенциальным влиянием на основные изучаемые клинические явления (боль, метеоризм, диарея), если они использовались в регламентируемых инструкциями к этим препаратам дозах:
- с целью повышения эффективности лечения синдрома внешнесекреторной недостаточности – ингибиторы протонной помпы или Н2-блокаторы;
- с целью купирования болевого абдоминального синдрома – парацетамол в таблетированной форме или метамизол натрия в инъекционной форме; парентеральный (платифиллин, дротаверин) или пероральный прием миотропных спазмолитиков (мебеверин, пинаверия бромид);
- прием антидиарейных средств (диосмектин, лоперамид) и рифаксимина.
Оценку эффективности проводимой терапии проводили по темпам и факту редукции клинических признаков ХП (боль, диарея, метеоризм, стеаторея), частоте использования анальгетиков и других препаратов для симптоматического контроля основных симптомов заболевания, по данным динамического копрологического исследования, анализу фармакоэкономических показателей. Для проведения фармакоэкономического анализа были использованы счета-фактуры по системе ДМС по факту проведенного лечения.
Фармакоэкономические показатели
- Анализ стоимости болезни – учет всех затрат, понесенных медицинским учреждением при диагностике и/или лечении ХП с экзокринной недостаточностью ПЖ с учетом результатов оказанной медицинской помощи: COI = DC + IC, где COI – показатель стоимости болезни, DC – прямые затраты, IC – косвенные затраты.
- Оценка альтернативных медицинских технологий – анализ “затраты– эффективность” с определением критериев эффективности (% больных без абдоминальной боли и маркеров экзокринной недостаточности), расчетом затрат на лечение и проведением окончательного расчета: CEA = (DC1 + IC1) – (DC2 + IC2) / Ef1 – Ef2, где СЕА – коэффициент, DC – прямые затраты на лечение, IC – косвенные (непрямые) затраты, Ef – эффективность.
К прямым затратам на оказание медицинской помощи мы отнесли:
- Число койко-дней, проведенных больными в стационаре.
- Средняя стоимость 1 койко-дня в стационаре.
- Стоимость ферментных препаратов на курс лечения.
- Стоимость обязательных методов обследования (необходимых для установления диагноза ХП и контроля проводимой терапии).
- Стоимость дополнительных методов обследования. Учитывались любые виды инструментальных исследований, произведенных во время курса лечения (например, дополнительные ультразвуковые исследования органов брюшной полости на фоне сохраняющегося болевого синдрома).
- Стоимость использованных препаратов для сопутствующей ферментным препаратам симптоматической (лоперамид, спазмолитики, анальгетики) и патогенетической (антисекреторные средства, рифаксимин) терапии.
Учитывая дизайн исследования (ретроспективное, сравнительное), невозможность по анализу первичной документации определить косвенные затраты, мы позволили себе их не приводить. Расчет стоимости среднего койко-дня производился следующим образом: суммировалась стоимость всех койко-дней всех включенных в анализ историй болезни за весь период времени с последующим делением на общее число койко-дней. Именно средний койко-день и включался в зачет общей стоимости прямых затрат путем умножения на число дней в стационаре в каждом конкретном случае. Это было выполнено для повышения объективности учета прямых затрат в связи с тем, что за период наблюдения стоимость койко-дня в стационаре варьировалась (выросла примерно на 20 % за 3 года), имелись различия стоимости в зависимости от категории палаты (общая, двух- или одноместная).
Результаты
В среднем в группе больных с Креоном терапия продолжалась 15 дней, а в группе больных, принимавших ТП, – 22 дня. Средняя стоимость 1 койко-дня в стационаре составила 1497 руб.
Показатели стоимости болезни (COI) в обеих группах приведены в табл. 1. Все расчеты производились в рублях (как уже ранее отмечалось, косвенные затраты не учтены).
Таблица 1. Показатели стоимости болезни (в руб.).
Как следует из табличных данных, всего лишь замена одного препарата панкреатина на другой позволяет сэкономить более 11 тыс. руб. на каждого пациента в стационаре, т. е. снизить на треть затраты на стационарное лечение.
При анализе “затраты–эффективность” с определением критериев эффективности (% больных без абдоминальной боли и маркеров экзокринной недостаточности), расчетах затрат на лечение и проведении окончательного расчета использовались данные, представленные в табл. 2.
Таблица 2. Критерии эффективности терапии (% больных без абдоминальной боли и маркеров экзокринной недостаточности).
Таким образом, критерии эффективности были выше у больных 1-й группы (Креон®), чем 2-й (ТП).
При окончательном расчете затрат на лечение было установлено, что коэффициент затрат на купирование боли (CEA) составил (32 011,12–43 397, 56/92–71) – 542,21 руб. То есть для купирования болевого синдрома у одного больного, получавшего ТП, потрачено на 542 руб. больше, чем на купирование боли у пациента, получавшего Креон®.
При расчете коэффициента затрат на купирование диареи также было показано, что на одного больного, получавшего ТП, потрачено на 355,82 руб. больше, чем на больного, получавшего Креон® (32 011,12–43 397, 56/97–65).
Обсуждение
Кроме основной цели (фармакоэкономический анализ) мы изначально ставили своей задачей ретроспективно оценить частоту и выраженность побочных эффектов полиферментной терапии. В отобранных для исследования историях болезни (n = 187) не было зарегистрировано ни одного побочного эффекта ферментных препаратов, требующего их отмены. Это подтверждает имеющиеся данные о нечастом возникновении побочных явлений на фоне полиферментной терапии. Так, в исследовании Friess H. и соавт., применявших у здоровых добровольцев в течение 4 недель панкреатин в суточной дозе 360000(!) ЕД, по липолитической активности не было отмечено существенных побочных эффектов [9], что лишний раз характеризует препараты панкреатина как достаточно безопасные. Необходимо также отметить, что на последнем этапе отбора историй болезни, число пациентов, включенных в исследование, составляло 187 человек, при этом основная часть из них (n = 151) принимала Креон®. Данное обстоятельство может быть связано с имеющимися предпочтениями практикующих врачей стационара относительно терапии более современными препаратами и обусловлено выбором самих пациентов, в т. ч. нежеланием принимать большее число таблеток панкреатина в сутки и на прием.
Полученные нами результаты в очередной раз демонстрируют преимущества современных ферментных препаратов над препаратами ТП. С позиций фармакокинетики и фармакодинамики мини-микросферы Креона, каждая из которых покрыта энтеросолюбильной оболочкой, защищающей содержащийся внутри панкреатин от разрушения желудочным соком, характеризуются лучшим смешиванием ферментов и их взаимодействием с их субстратами. Это безусловно значительно повышает качество заместительной терапии при панкреатической недостаточности, что сопровождается, по нашим данным, снижением общей стоимости лечения. Зачастую выбор врача направлен на применение более дешевого препарата, но, как известно, “скупой платит дважды”. Применение таблетированных полиферментных препаратов, покрытых оболочкой, с экономической точки зрения является нерентабельным, несмотря на кажущуюся разницу в стоимости за упаковку.
Нельзя не отметить и ряд прочих факторов помимо диаметра таблеток, безусловно влияющих на эффективность лечения. В первую очередь следует вспомнить о содержании протеаз в исследуемых средствах, которые по принципу отрицательной обратной связи за счет разрушения релизингпептидов холецистокинина и секретина способны контролировать болевой абдоминальный синдром при ХП. Так, активность протеаз в таблетке Мезим форте 10000 значительно ниже (375 ЕД F.I.P.), чем в капсуле Креона 10000 (600 ЕД F.I.P.). Если мы рассматриваем основной прием пищи, при котором требуется минимум вдвое большая доза панкреатина, то в таблетках Мезим форте 10000 активность протеаз все равно будет меньше (750 ЕД F.I.P.) по сравнению с Креоном 25000 (1000 ЕД F.I.P.). Следует помнить, что протеазы необратимо инактивируются при значениях рН ниже 3. Поэтому очень сложно комментировать результаты недавних исследований лаборатории фармацевтического анализа ГФЦ МЗ Украины, свидетельствующие, что проверенный образец препарата Мезим форте не соответствовал требованиям Европейской фармакопеи к таблеткам, покрытым кишечно-растворимой оболочкой, поскольку попросту таковой не имеет [14]. Из интернет-источников не совсем понятно, относится ли это и к препарату Мезим форте 10000, эффективность которого оценивалась в нашей работе. Если опираться на данный факт, то неспособность длительное время из-за размера таблетки покинуть желудок в сочетании с отсутствием эффективной энтеросолюбильной оболочки и низким содержанием протеаз приводит к инактивации до 80 % активности препарата [1, 15]. Это является веским дополнительным аргументом в пользу применения Креона и важным фактом, объясняющим значительно меньшую эффективность ТП в коррекции экзокринной недостаточности ПЖ.
Заключение
В результате проведения фармакоэкономического анализа с помощью методов “показатель стоимости болезни” и “затраты/эффективность” было доказано, что, несмотря на более высокую стоимость Креона по сравнению с ТП, заместительная терапия Креоном у пациентов, страдающих ХП с внешнесекреторной недостаточностью, в конечном счете оказывается более выгодной. Следует обратить внимание на то, что проведенный расчет является ориентировочным, поскольку в нем использованы усредненные показатели, учтены только доступные на период проведения исследования сведения, не приведены косвенные расходы. Окончательный ответ на этот вопрос должны дать крупные проспективные фармакоэкономические исследования, хотя и на данном этапе с учетом всех приведенных фактов ситуация достаточно прогнозируема.
Безусловно каждый пациент требует индивидуального подхода и каждому больному требуется своя схема дозирования ферментных препаратов для лечения экзокринной панкреатической недостаточности, а также болевого абдоминального синдрома. Но для проведения эффективного лечения практикующему врачу необходимо не только знать несомненные и доказанные преимущества полиферментных препаратов последних поколений (минимикросферы панкреатина, энтеросолюбильная оболочка, достоверное и дозозависимое уменьшение стеатореи), но и учитывать фармакоэкономическую выгоду при использовании таких лекарственных средств.
Данная работа выполнена в рамках гранта НШ-3832.2010.7 по государственной поддержке ведущих научных школ.
Информация об авторах:
Маев Игорь Вениаминович – доктор медицинских наук, профессор, заведующий кафедрой пропедевтики
внутренних болезней и гастроэнтерологии ГОУ ВПО МГМСУ Росздрава;
Кучерявый Юрий Александрович – кандидат медицинских наук, доцент кафедры пропедевтики внутренних
болезней и гастроэнтерологии ГОУ ВПО МГМСУ Росздрава.
Тел. 8 (499) 187-09-72, e-mail: proped@mail.ru;
Оганесян Татьяна Сергеевна – кандидат медицинских наук, ассистент кафедры пропедевтики
внутренних болезней и гастроэнтерологии ГОУ ВПО МГМСУ Росздрава;
Свиридова Анна Владимировна – старший лаборант кафедры пропедевтики внутренних болезней
и гастроэнтерологии ГОУ ВПО МГМСУ Росздрава;
Трошина Инна Владимировна – аспирант кафедры пропедевтики внутренних болезней
и гастроэнтерологии ГОУ ВПО МГМСУ Росздрава;
Устинова Наталья Николаевна – врач-гастроэнтеролог НУЗ “Центральная поликлиника ОАО РЖД”;
Москалева Анна Борисовна – врач-гастроэнтеролог отделения гастроэнтерологии НУЗ ЦКБ № 2
им. Н.А. Семашко ОАО РЖД



