Последнее десятилетие ознаменовалось значительными успехами в снижении заболеваемости острым гепатитом В, что стало возможным благодаря успешной реализации программ массовой вакцинопрофилактики. Однако проблема гепатита В и сегодня продолжает сохранять свою актуальность в России и мире. Это связано с огромным числом лиц, хронически инфицированных вирусом гепатита В (ВГВ), и сохраняющейся высокой заболеваемостью хроническими формами этой инфекции. Заболеваемость хроническим гепатитом В (ХГВ) с 2000 г. и по настоящее время не имеет тенденции к снижению и составляет от 14 до 16 случаев на 100 тыс. населения. За тот же период времени наблюдалось некоторое снижение частоты регистрации носительства ВГВ (в 2,6 раза), однако абсолютные цифры остаются высокими: в 2008 г. в России выявлено 51 635 новых случаев носительства. Если принять во внимание отсутствие четких критериев дифференциального диагноза ХГВ и носительства вируса, вероятность активации инфекции в любой момент времени, а также неблагоприятные исходы болезни – цирроз и рак печени, значимость проблемы становится еще более очевидной.
Несмотря на появление новых противовирусных препаратов (ПВП) для лечения ХГВ, полное его излечение с эрадикацией вируса остается труднодостижимой целью. Имеющиеся данные о течении ХГВ и эффективности продолжительных курсов лечения ПВП позволяют понять важность длительного и глубокого подавления вирусной репликации. Современные ПВП на основе аналогов нуклеозидов и нуклеотидов дают возможность достичь такого эффекта, однако, как показывает практика, длительные курсы лечения связаны с риском развития резистентности вируса к этим препаратам. Развитие резистентности значительно ухудшает результаты лечения и исходы болезни. В настоящем обзоре рассмотрены причины и механизмы развития устойчивости вируса к ПВП, типы мутаций и вероятность их возникновения при лечении современными аналогами нуклеозидов и нуклеотидов. Кроме того, обсуждаются современные методы обнаружения мутаций, представлены рекомендации, позволяющие снизить риск возникновения устойчивости, и подходы к лечению пациентов с ХГВ в случае, если устой-чивость все же возникла.
Репликация ВГВ и механизмы развития устойчивости
ВГВ относится к семейству Hepadnaviridae и является ДНК-содержащим вирусом, геном которого состоит из 3,2 тыс. пар нуклеотидов, представляя собой кольцевую молекулу ДНК с незавершенной двуцепочечной структурой. Геном ВГВ содержит четыре участка, кодирующих вирусные белки (открытые рамки считывания), названных по соответствующим, частично перекрывающимся генам: S, C, P и Х. После проникновения ВГВ в гепатоцит вирусная ДНК попадает в ядро клетки, где происходит ее преобразование в кольцевую ковалентно замкнутую ДНК, после чего начинается транскрипция вирусных матричных РНК, включая самую длинную, называемую прегеномной. Прегеномная РНК является промежуточной стадией в цикле репликации ДНК ВГВ, матрицей для синтеза геномной ДНК с помощью обратной транскриптазы – фермента, кодируемого одним из генов вируса.
В процессе вирусной репликации мутации в геноме ВГВ происходят постоянно. Это связано с особенностями обратной транскриптазы, не обладающей т. н. редактирующей активностью, т. е. не исправляет внесенные ею ошибки встраивания нуклеотидов в процессе обратной транскрипции. Оценочная скорость спонтанных мутаций для ВГВ равна 1,4–3,2 × 10-5 нуклеотидных замен на сайт в одном цикле репликации [1, 2]. С учетом очень высокой скорости репликации ВГВ, составляющей более 1011 вирусных частиц в день, минимум 1010 точечных мутаций возникают в геноме ВГВ ежедневно [3]. Далеко не все мутации эволюционно закрепляются в вирусной популяции. Большинство спонтанно возникших мутаций приводит к тому, что новые варианты вируса оказываются менее репликативно активными или вовсе не способными к размножению и вытесняются т. н. диким вариантом вируса, т. е. вариантом без
мутаций. Однако при некоторых условиях, например в присутствии ПВП, когда репликация “дикого” варианта вируса подавлена, мутантные варианты, обладающие способностью к репликации в присутствии препарата, начинают доминировать в популяции вируса. Данные варианты вируса называются устойчивыми к противовирусному лечению, а мутации в геноме, обусловливающие такие их свойства, – мутациями устойчивости.
Механизм возникновения устойчивости вируса к ПВП, как правило, связан с тем, что возникшая мутация нарушает пространственное взаимодействие молекулы препарата с молекулой обратной транскриптазы вируса, несколько изменяя ее конформацию, что неоднократно было продемонстрировано в исследованиях с помощью трехмерного моделирования [4].
Устойчивость к противовирусным препаратам: терминология
На протяжении последних нескольких лет, когда накопился достаточный опыт использования ПВП в лечении ХГВ, рядом авторов были предприняты попытки стандартизации понятий, используемых при описании явлений, связанных с эффективностью лечения и развитием устойчивости к ПВП [5–10]. Наиболее важными являются понятия ответа на лечение, резистентности или устойчивости к лечению, рецидива на фоне лечения.
Поскольку при ХГВ полная эрадикация вируса практически невозможна, целью лечения является снижение риска развития неблагоприятных исходов заболевания (цирроза и рака печени), что может быть достигнуто при стойком подавлении репликации вируса [8, 9]. Именно поэтому измерение концентрации ДНК ВГВ в крови, которая отражает активность вирусной репликации, и стало основным критерием оценки ответа на лечение. Наиболее часто используется термин “вирусологический ответ”. Вирусологическим ответом на лечение аналогами нуклеозидов и нуклеотидов при ХГВ считают отсутствие ДНК ВГВ в плазме крови на 48-й неделе лечения при исследовании современными высокочувствительными методами [8]. Большинство современных методов выявления ДНК ВГВ в плазме крови имеют чувствительность 10–20 МЕ/мл, что ориентировочно равно 50–100 копиям вирусной ДНК на мл.
Частичный вирусологический ответ определяется как наличие ДНК ВГВ на 24-й (для препаратов с низким генетическим барьером) или 48-й неделе лечения (для препаратов с высоким генетическим барьером или низким риском развития устойчивости на ранних этапах лечения) при условии, что ее концентрация снизилась более чем на 1 log10 МЕ/мл (более чем в 10 раз) от начального уровня [8]. Генетический барьер определяется минимальным количеством мутаций, которые одновременно должны возникнуть в геноме ВГВ, чтобы вирус приобрел устойчивость к данному препарату [11]. Так, ламивудин (ЛМВ) и телбивудин (ТБВ) являются препаратами с низким генетическим барьером, т. к. достаточно всего лишь одной мутации в геноме ВГВ для развития устойчивости к ним. Энтекавир (ЭТВ) относят к препаратам с высоким генетическим барьером, ибо необходимо не менее трех одновременно возникших мутаций в геноме ВГВ для развития устойчивости к нему. Подробнее этот вопрос будет рассмотрен далее.
Вирусологический рецидив определяют как возрастание концентрации ДНК ВГВ в плазме крови более чем на 1 log10 МЕ/мл (более чем в 10 раз) от минимального уровня, достигнутого в процессе лечения, на фоне продолжающегося приема препарата [5–10]. О вирусологическом рецидиве можно говорить только у пациента, сохраняющего приверженность лечению и ранее достигшего вирусологического ответа. Факт возрастания концентрации вируса должен быть подтвержден повторным исследованием с интервалом в месяц. Если возрастание концентрации ДНК ВГВ сопровождается подъемом уровня трансаминаз, повторное подтверждающее исследование может не проводиться.
Биохимическим рецидивом называют возрастание уровня аланинаминотрансферазы (АЛТ) в сыворотке крови после его нормализации в процессе лечения на фоне продолжающегося приема препарата у пациента, приверженного лечению [5–10]. Биохимический рецидив обычно наступает после вирусологического рецидива. Однако АЛТ может быть в пределах нормальных значений в течение длительного времени после развития устойчивости к препарату, поэтому данный параметр нельзя считать достаточно чувствительным к обнаружению резистентности.
О первичной резистентности говорят, если на 12-й неделе лечения наблюдается снижение концентрации ДНК ВГВ менее чем на 1 log10 МЕ/мл (менее чем в 10 раз) от начального ее уровня [6, 8, 10]. Причинами первичной резистентности к лечению могут быть факторы, связанные с особенностями пациента, вируса или препарата. Так, это может быть генетический полиморфизм ферментов, участвующих в превращении действующего вещества ПВП в активную форму или фосфорилировании аналогов нуклеозидов до трифосфатов [12]. Доза препарата и его способность подавлять репликацию вируса также играют немаловажную роль [13]. Кроме того, не исключена возможность заражения штаммом вируса, изначально обладающим генетическими факторами устойчивости к препарату.
Генотипической резистентностью ВГВ к аналогам нуклеозидов и нуклеотидов называют факт обнаружения мутаций в геноме вируса, связь которых с возникновением устойчивости к данному ПВП была ранее подтверждена в исследованиях in vitro [5, 7, 9, 10]. Как правило, мутации устойчивости возникают в гене обратной транскриптазы и приводят к аминокислотным заменам в структуре фермента, что в свою очередь нарушает его взаимодействие с препаратом. Возникновение мутаций устойчивости является наиболее частой причиной вирусологического рецидива в процессе лечения.
Под фенотипической резистентностью понимают сниженную чувствительность ВГВ к ПВП при исследовании in vitro [5, 9, 10]. Такие исследования проводят для подтверждения связи мутации в геноме ВГВ с устойчивостью к лекарственному препарату.
Номенклатура мутаций устойчивости
Ключевым понятием при обсуждении вопроса устойчивости ВГВ к ПВП являются мутации устойчивости. Как упоминалось ранее, мутации устойчивости ВГВ к аналогам нуклеозидов и нуклеотидов, как правило, возникают в гене обратной транскриптазы вируса, являющейся мишенью для препаратов этих групп. Мутации, связанные с устойчивостью, подразделяют на первичные и вторичные. Первичные мутации устойчивости приводят к замене аминокислот в структуре фермента, снижая его чувствительность к препарату [5, 6]. Тем самым вирус приобретает способность к репликации в присутствии ПВП. Однако в большинстве случаев такие мутации приводят одновременно и к снижению репликативной активности вируса по сравнению с его “диким” вариантом. Вторичные, компенсаторные мутации ведут к аминокислотным заменам в структуре фермента, которые восстанавливают функциональные дефекты его активности, возникшие вследствие первичных мутаций устойчивости [5, 6].
Современная система обозначения мутаций устойчивости ВГВ была предложена Stuyver и соавт. в 2001 г. [14]. Так как длина генома ВГВ для разных генотипов вируса несколько отличается, во избежание путаницы авторы предложили нумеровать мутации устойчивости в соответствии с номером аминокислоты в домене обратной транскриптазы. Регион обратной транскриптазы гена вирусной полимеразы (P) имеет одинаковую длину для всех генотипов вируса. Обозначение мутации устойчивости начинается с букв “rt” (от reverse transcriptase – обратная транскриптаза), затем следует однобуквенное обозначение аминокислоты, которая стоит в данном положении у “дикого” варианта вируса, затем – номер кодона (аминокислоты) в домене обратной транскриптазы и наконец – обозначение аминокислоты, которая оказывается в данном положении в результате мутации. Так, например, одна из первичных мутаций устойчивости к ЛМВ обозначается как rtM204V, что означает замену метионина на валин в 204-м положении домена обратной транскриптазы ВГВ. Ранее мутация в этом положении называлась YMDD-мутацией (соответственно, мутантный вариант обозначали как YVDD). Однако данная система обозначения устарела.
Факторы, связанные с формированием устойчивости
Вероятность возникновения устойчивости к ПВП при ХГВ зависит от ряда факторов, связанных с особенностями пациента, характеристиками вируса и курса лечения, а также со свойствами самого препарата.
В ряде исследований показано, что мужской пол, более старший возраст, высокий индекс массы тела, повышенный уровень аминотрансфераз, высокие уровень вирусной нагрузки и индекс гистологической активности, а также наличие мутаций в области coreпромотора генома ВГВ связаны с повышенным риском развития устойчивости к ЛМВ [15–20]. Нельзя полностью исключать влияния генотипа вируса на
риск развития мутаций устойчивости. В нескольких исследованиях наблюдалась более высокая частота возникновения мутаций устойчивости к ЛМВ и адефовиру (АДВ) для генотипов А и D соответственно [21–24]. Однако в большинстве исследований связи генотипа ВГВ с ответом на лечение аналогами нуклеозидов и нуклеотидов отмечено не было [25–27].
Недостаточное подавление вирусной репликации в процессе лечения также является фактором, предрасполагающим к развитию лекарственной устойчивости. Как было показано в исследовании Yuen и соавт., частота возникновения мутаций устойчивости к ЛМВ тем выше, чем выше концентрация ДНК ВГВ на 24-й неделе лечения [28].
Мутации устойчивости ВГВ к аналогам нуклеозидов и нуклеотидов
Накопившийся опыт изучения мутаций устойчивости ВГВ к аналогам нуклеозидов и нуклеотидов показывает, что существует некоторая зависимость между химической структурой препарата и спектром возникающих мутаций устойчивости [29].
По химической структуре аналоги нуклеозидов и нуклеотидов подразделяются на три группы:
• группа аналогов L-нуклеозидов: ЛМВ, ТБВ, эмтрицитабин (МТБ) *, клевудин (КЛВ) *;
• группа карбоциклических аналогов нуклеозидов: ЭТВ;
• группа ациклических С-фосфонатов нуклеотидов: АДВ *, тенофовир (ТФВ) *.
* На январь 2010 г. в России не зарегистрированы.
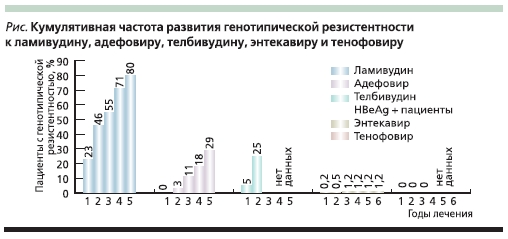
Частота развития резистентности к аналогам нуклеозидов и нуклеотидов приведена на рисунке. Резистентность к ЛМВ прогредиентно нарастает с каждым годом лечения и достигает 80 % к пятому году [30]. Частота развития резистентности к ТБВ несколько ниже, но по сравнению с препаратами других групп достаточно высока. Уже на втором году лечения частота генотипической резистентности достигает 11 % при HBeAg-негативном и 25 % при HBeAg-позитивном ХГВ [31, 32]. Скорость развития устойчивости к АДВ ниже, чем для препаратов из группы аналогов L-нуклеозидов, но было показано, что к 5-му году лечения HBeAg-негативного ХГВ устойчивость к препарату развивается почти у 30 % пациентов [33]. Опыт применения ТФВ при ХГВ пока невелик, однако клинические исследования не выявили развития резистентности к данному препарату в течение 144 недель лечения, что свидетельствует о его хороших перспективах [34, 35]. Очень низкая частота развития мутаций устойчивости характерна для ЭТВ. Через 6 лет лечения у пациентов, ранее не получавших ПВП, частота возникновения генотипической резистентности не превышала 1,2 % [36, 37]. Однако у пациентов, ранее получавших ЛМВ, частота мутаций устойчивости к ЭТВ была значительно выше и достигала почти 60 % на 6-м году лечения [36, 37]. Эти данные подчеркивают целесообразность применения ЭТВ для лечения ХГВ в качестве препарата первой линии. Частота развития резистентности к ПВП в основном определяется двумя главными факторами: способностью препарата подавлять репликацию вируса и его генетическим барьером к резистентности (см. таблицу).
Таблица. Характеристика аналогов нуклеозидов и нуклеотидов по противовирусной активности
и генетическому барьеру к резистентности.
Мутации устойчивости к аналогам L-нуклеозидов
Все препараты данной группы имеют сходную структуру молекулы и механизм действия, как следствие – сходный спектр мутаций устойчивости в геноме ВГВ [38, 39]. Очевидно, что внутри группы наблюдается перекрестная резистентность. Аналоги L-нуклеозидов имеют низкий генетический барьер, следовательно, характеризуются высоким риском развития устойчивости к ним. Достаточно всего одной мутации в геноме ВГВ, чтобы возникла устойчивость к препаратам данной группы. Основными первичными мутациями устойчивости к ЛМВ являются rtM204V и rtM204I (могут обозначаться как rtM204V/I) [40]. Для ТБВ более характерна первичная мутация устойчивости rtM204I [41]. Однако мутация rtM204V совместно с компенсаторной мутацией rtL180M приводит к снижению чувствительности к ТБВ [www.fda.gov]. В исследованиях in vitro показано, что мутация rtM204V/I снижает чувствительность обратной транскриптазы ВГВ к ЛМВ более чем в 1000 раз [40]. В ряде исследований выявлено, что мутация rtA181T/V также вызывает резистентность к ЛМВ и ТБВ, а также является первичной мутацией [42]. Было замечено, что данная мутация вызывает перекрестную резистентность к АДВ [43]. Вторичными компенсаторными мутации для этой группы препаратов являются rtL80V/I, rtV173L и rtL180M [44–46].
Мутации устойчивости к карбоциклическим аналогам нуклеозидов
Единственным представителем данной группы препаратов для лечения ХГВ является ЭТВ. Он обладает высоким генетическим барьером, как следствие – риск развития устойчивости к нему очень низок. В геноме ВГВ должно произойти не менее трех мутаций, чтобы возникла устойчивость к ЭТВ. Для возникновения вирусологического рецидива в процессе лечения ЭТВ обязательно наличие классической мутации резистентности к аналогам L-нуклеозидов rtM204V/I [47]. В отсутствие нее все остальные мутации, характерные для устойчивости к ЭТВ, приводят к умеренному снижению чувствительности ВГВ к препарату (менее чем в 10 раз). Тогда как при наличии данной мутации совместно с несколькими другими чувствительность к препарату может снижаться более чем в 1000 раз [47, 48]. Развитие резистентности к ЭТВ сопровождается возникновением следующих мутаций помимо описанных выше: rt169T, rtL180M, rtT184A/F/G/I/L/S, rtS202G/I и rtM250V. Описано два основных сочетания мутаций
устойчивости к ЭТВ, подтвержденных исследованиями in vitro. К ним относятся rtI69T + rtL180M + rtM204V +rtM250V и rtL180M + rtT184G + rtS202I + rtM204V [47, 48]. Сообщалось также о некоторых других возможных сочетаниях мутаций [49].
Мутации устойчивости к ациклическим С-фосфонатам нуклеотидов
В ряде исследований установлено, что первичными мутациями устойчивости к АДВ являются rtA181T/V и rtN236T [43, 50]. Было отмечено, что данные мутации приводят к умеренному снижению чувствительности вируса к препарату. В in vitro-исследованиях требовалось лишь 3–8-кратное увеличение концентрации препарата для подавления вирусной репликации на 50 % [51]. В исследованиях in vitro было также доказано, что мутация rtN236T практически не влияет на чувствительность ВГВ к ЛМВ, ТБВ и ЭТВ, однако снижает эффективность ТФВ [52]. Мутация rtA181T/V снижает чувствительность ВГВ к АДВ и ТФВ, частично вызывает перекрестную резистентность к ЛМВ и ТБВ [43]. В одном из исследований отмечено, что мутация rtI233V также может вызывать устойчивость к АДВ [53], однако данный факт требует дополнительного изучения, т. к. в других исследованиях такой связи выявлено не было [54, 55]. Sheldon J. и соавт. в своем исследовании выявили мутацию rtA194T, в сочетании с rtL180V + rtM204V связанную с развитием устойчивости к ТФВ [56]. Однако другим авторам данную находку подтвердить не удалось, что свидетельствует о необходимости дальнейших исследований [57].
Методы обнаружения мутаций устойчивости
Наиболее часто для обнаружения мутаций устойчивости используют методы на основе секвенирования (определения последовательности нуклеотидов) фрагмента генома ВГВ, в котором возникают такие мутации (ген полимеразы/обратной транскриптазы ВГВ), или методы на основе гибридизации. Наиболее простым и доступным в России является метод прямого секвенирования.Метод позволяет выявлять любые мутации устойчивости, если доля мутантного варианта вируса превышает 20 % [6, 7]. Предварительное клонирование продукта амплификации и последующее секвенирование большого количества клонов могут значительно повысить чувствительность метода к минорным вариантам вируса, однако такая модификация метода крайне трудоемка. Примером коммерческой технологии выявления мутаций устойчивости на основе секвенирования является разработка компании Visible Genetics TRUGENE HBV (Siemens Health Care Diagnostics Solutions).
Гибридизационные методы основаны на использовании специфических к данным мутациям ДНК-зондов для выявления мутаций. Особенностью методов на основе гибридизации является их более высокая чувствительность к мутантным вариантам вируса. Достаточно 5–10 %-мутантного варианта в вирусной популяции, чтобы он мог быть обнаруженным с помощью методов гибридизации [6]. Примером коммерческой тест-системы на основе гибридизационной технологии для обнаружения мутаций устойчивости в геноме ВГВ является INNO-LiPA HBV DR v.3 (компания Innogenetics). Обнаружение мутаций с помощью ДНК-чипов также основано на технологии гибридизации с ДНК-зондами.
Перспективной технологией выявления мутантных вариантов в вирусной популяции является пиросеквенирование. Большим преимуществом данного метода является его высокая чувствительность к минорному варианту вируса, который может быть выявлен, даже если его доля не превышает 0,1 %.
Однако пока данная технология малодоступна [6].
Для научных исследований иногда используют и другие методы обнаружения мутаций устойчивости, включая MALDI-TOF масс-спектрометрию, однако такие методы, как правило, требуют сложного оборудования и малопригодны к использованию в клинической практике.
Как избежать развития устойчивости ВГВ к лечению?
Снизить риск развития устойчивости ВГВ к лечению возможно. Для этого следует строго следовать ряду правил, выработать которые позволили достаточно длительная практика использования ПВП при ХГВ и результаты широкомасштабных клинических исследований. Одно из главных правил – избегать лечения ПВП, если в этом нет абсолютной необходимости [6–10]. Правильно принять решение относительно назначения лечения позволяет следование международным рекомендациям, которые практически ежегодно обновляются ведущими профессиональными ассоциациями (например, Американской ассоциацией по изучению заболеваний печени [AASLD] и Европейской ассоциацией по изучению печени [EASL]) с учетом современных представлений и новых данных.
Второе правило – если лечение необходимо, правильно подбирать ПВП с учетом его свойств и данных о риске развития устойчивости. Поскольку мутации возникают в процессе репликации вируса, начатое лечение должно как можно быстрее и глубже ее подавить. Очевидно, что в качестве первой линии следует отдавать предпочтение препаратам с высокой эффективностью подавления репликации ВГВ и низким риском развития устойчивости – ЭТВ и ТФВ [6–10].
Третье важное правило – по возможности избегать последовательного лечения несколькими ПВП [6–9], что может способствовать возникновению вариантов вируса с множественной лекарственной устойчивостью. Возможным решением является лечение комбинацией нескольких препаратов,
не имеющих перекрестной устойчивости. Однако данных об эффективности и безопасности такого лечения пока недостаточно [10].
Четвертое правило – регулярно и правильно следить за эффективностью проводимого лечения.
Детальные рекомендации по мониторингу эффективности лечения приводятся в международных рекомендациях [8, 9]. Общим принципом является исследование концентрации ДНК ВГВ в плазме крови каждые 3–6 месяцев в процессе лечения. Особенно внимательно необходимо следить за эффективностью, если лечение все же было начато препаратами с высоким риском развития устойчивости (ЛМВ, ТБВ).
В этом случае исследование вирусной нагрузки необходимо проводить каждые три месяца. Если вирусная нагрузка возрастет в 10 раз и более относительно минимального значения достигнутого в процессе лечения, необходимо провести исследование на мутации устойчивости и подобрать оптимальную схему дальнейшего лечения. Последнее, но крайне важное правило – убедить пациента в необходимости быть приверженным лечению. Отсутствие приверженности – самая частая причина безуспешного противовирусного лечения [6–10].
Лечение ХГВ, вызванного резистентным штаммом вируса
Если в процессе лечения возник вирусологический рецидив, необходимо провести исследование на выявление мутаций устойчивости в геноме ВГВ. Выявленный спектр мутаций является крайне важным при определении дальнейшей тактики лечения пациента. Для определения дальнейшей тактики важно также учитывать данные о ранее проводившемся лечении и его эффективности. Международные рекомендации по выбору препаратов для лечения ХГВ, вызванного устойчивыми штаммами, опираются на результаты исследований перекрестной резистентности [8, 9]. Как правило, рекомендуется добавлять к лечению препарат, не имеющий перекрестной резистентности. В ряде случаев может быть выбрана тактика переключения на другой препарат или их комбинацию. Однако тактика добавления всегда предпочтительней тактики переключения во избежание формирования вариантов вируса с множественной лекарственной устойчивостью. Особенностью ситуации в России является отсутствие зарегистрированных препаратов из группы ациклических С-фосфанатов нуклеотидов (АДВ и ТФВ). Данные препараты являются ключевыми при лечении ХГВ, вызванного вариантами вируса, устойчивыми к ЛМВ, ТБВ и ЭТВ [8, 9]. В этой ситуации единственным вариантом лечения при устойчивости к ЛМВ и ТБВ является назначение ЭТВ в дозе 1 мг в сутки, что не представляется идеальной тактикой, поскольку со временем неуклонно ведет к формированию ЭТВ-резистентных штаммов ВГВ. Для лечения ХГВ, вызванного ЭТВ-резистентными вариантами вируса,
препаратов, доступных на российском рынке, нет. С учетом этого крайне актуальным становится соблюдение описанных выше правил, позволяющих предотвращать развитие лекарственной устойчивости.
Заключение
С расширением спектра ПВП для лечения ХГВ проблема резистентности становится все более и более актуальной. С учетом уроков, полученных при использовании ПВП в лечении ВИЧ-инфекции, следует принимать всевозможные меры для предотвращения развития резистентности к лечению
и распространения вариантов вируса, обладающих мутациями устойчивости к лечению. Кроме того, очевидной является необходимость обеспечения регулярного мониторинга за циркуляцией резистентных к ПВП штаммов ВГВ. Использование в клинической практике современных молекулярных методов диагностики, таких как измерение вирусной нагрузки и выявление мутаций устойчивости в геноме вируса, позволяет своевременно оценивать эффективность проводимого лечения и при необходимости обоснованно корректировать его. Дальнейшие исследования проблемы устойчивости при использовании имеющихся ПВП и их комбинаций позволят разработать научно обоснованные рекомендации по наиболее эффективной тактике лечения ХГВ. Крайне актуальной является разработка новых ПВП с механизмами действия, отличными от таковых существующих аналогов нуклеозидов и нуклеотидов.



