Обоснование
Псориаз (ПС) является хроническим аутовоспалительным заболеванием с вовлечением не только кожи, но и костно-суставной системы. Так как при ПС возникает сложный иммунный каскад с участием как врожденной, так и адаптивной иммунной системы, характерно развитие множественных коморбидных патологий, которые осложняют течение основного заболевания, приводя к трудностям в назначении и проведении терапии, а также к изменению течения клинической картины, сложностям диагностического поиска [1].
За последнее время обнаружено все больше коморбидной связи между различными болезнями. Основными причинами развития коморбидных патологий у пациентов с ПС являются нарушение липидного и углеводного обменов. Чаще всего у пациентов с ПС имеется метаболический синдром, при котором возникает нарушение толерантности к глюкозе/сахарный диабет, ожирение, артериальная гипертензия, дислипидемия [2]. Кроме того, атеросклероз сосудов и стимуляция неоангиогенеза могут приводит к увеличению риска сердечно-сосудистых заболеваний (ишемическая болезнь сердца, острая коронарная и церебральная недостаточность). Подобно пациентам с ПС, у пациентов с ишемической болезнью сердца отмечается повышение уровней цитокинов Th17-лимфоцитов (интерлейкин-17 – ИЛ-17, -6 и -8) в периферической крови. Таким образом, увеличение числа Th17-лимфоцитов у пациентов с ПС может способствовать воспалению сосудов, развитию атеросклероза и сердечно-сосудистых заболеваний. Продукция проангиогенных факторов, включая сосудистый эндотелиальный фактор роста и ИЛ-8, в псориатической бляшке может приводить к развитию и прогрессированию атеросклероза [3, 4].
Кроме того, в основе связи между ПС и атеросклерозом могут лежать общие сигнальные пути окислительного стресса.
Развитие инсулинорезистентности у больных ПС наряду с другими факторами может служить объяснением повышенного риска развития атеросклероза и сопутствующих сердечно-сосудистых заболеваний [5, 6].
Ожирение характеризуется повышенными уровнями С-реактивного белка, ИЛ-6, фактора некроза опухоли-α (ФНО-α) и лептина. Согласно недавним исследованиям, патогенетическая связь между ожирением и ПС может быть воспалительного типа с участием макрофагов, провоспалительных адипокинов и цитокинов. Ожирение влияет на эффективность лечения ПС, влияя как на фармакокинетику, так и на фармакодинамику препаратов. Пациенты с ожирением и ПС часто имеют пониженный ответ на системную и биологическую терапию. Это особенно характерно для лекарств, которые вводятся в фиксированных дозах, а не для тех, где доза корректируется с учетом массы тела пациента. Лечение генно-инженерными биологическими препаратами (ГИБП), доза которых не скорректирована по массе (например, адалимумаб, этанерцепт), может иметь худшую эффективность. Кроме того, ожирение часто связано с нарушениями обмена веществ или метаболизма печени, что повышает риск побочных эффектов традиционной системной терапии [7].
В патогенезе сахарного диабета 1 типа (СД1) участвуют различные цитокины, в т.ч. ФНО-α. Интересно, что Th1 и Th17 также играют важную роль в возникновении СД1. Поэтому предполагают, что на патогенез ПС при СД1 влияют именно цитокины (ФНО-α, ИЛ-23, -17) [1, 8].
Гиперхолестеринемия может запускать воспалительный процесс с участием иммунной системы в мелких сосудах, а Т-лимфоциты могут быть одним из первых типов клеток, активируемых гиперхолестеринемией. Дислипидемии могут также появляться на фоне системной терапии ПС. Ретиноиды в наибольшей степени влияют на развитие дислипидемии. Отмечают повышенные уровни триглицеридов, общего холестерина, липопротеидов низкой плотности и липопротеидов очень низкой плотности, одновременно снижается уровень липопротеидов высокой плотности. Циклоспорин также может приводить к дислипидемии [2–4].
Метаболический синдром, атеросклероз сами по себе могут повышать риск развития хронической болезни почек и почечной недостаточности, которые усугубляются нефротоксичностью некоторых системных препаратов, которые используют в терапии ПС (метотрексат, циклоспорин) [9, 10].
При ПС ввиду хронического процесса и системности отмечаются множественные перекрестные звенья с некоторыми другими воспалительными заболеваниями, в т.ч. с воспалительными заболеваниями кишечника, болезнью Крона, язвенным колитом. У таких пациентов имеются генетические полиморфизмы в рецепторе ИЛ-23, которые приводят к изменениям в цепи ИЛ-12/23 [11–13].
У пациентов с ПС чаще отмечаются депрессивные и тревожные расстройства, которые выраженно снижают качество жизни пациентов и социальную адаптацию. Согласно исследованиям, повышенные при ПС уровни провоспалительных медиаторов ФНО-α и ИЛ-6 в большей степени связаны с депрессией. Распространенность депрессии у пациентов с ПС оценивается в диапазоне от 10 до 62% в зависимости от различных исследований. С другой стороны, стресс и депрессия могут играть определенную роль в развитии и обострении симптомов ПС. Это приводит к порочному кругу, который усугубляет оба заболевания – ПС и депрессию. Психологический стресс связан с изменениями в регуляции иммунной системы и активацией аномальных Т-клеток [13, 14].
Было выявлено, что при распространенном ПС отмечается активация системы «гипофиз–кора надпочечников». С одной стороны, предполагают, что именно эндокринные нарушения влияют на развитие дерматоза. С другой стороны, не исключают и снижения функций эндокринной системы как следствие тяжело протекающей псориатической болезни. При вульгарном ПС в период обострения отмечают увеличение секреции альдостерона и кортикостерона на фоне снижения суточной экскреции дегидроэпиандростерона, эстрона, эстриола. Также у больных ПС в 3 раза увеличено соотношение альдостерон/кортизол, приводящее к внутриклеточному перераспределению электролитов и увеличению выведения с мочой натрия. Кроме того, функциональные изменения в системе «гипофиз–надпочечники» могут отмечаться и в период ремиссии. В период рецидива ПС определяется снижение суточной экскреции с мочой свободного кортизола, дегидроэпиандростерона, этиохоланалона и андростерона, увеличение – кортизола, кортикостерона, 11-дезоксикортизола. У пациентов с ПС отмечается значительно менее выраженная реакция на экзогенное введение адренокортикотропного гормона, чем в контрольной группе. Данные результаты могут свидетельствовать о снижении функциональных резервов коры надпочечников у больных ПС [13, 15].
Исследования состояния щитовидной железы у больных ПС продемонстрировали выраженные изменения ее функционального состояния. По данным одних исследований, базальный уровень тиреотропного гормона (ТТГ) у больных ПС не отличался от нормы, однако ответ на стимуляцию тиролиберином был снижен у абсолютного большинства пациентов. Согласно другим исследованиям, средний уровень ТТГ у больных ПС ниже аналогичного показателя в контрольной группе, т.к. гормонсвязывающая способность и транспортная функция ТТГ у больных ПС ниже, чем у здоровых, и по мере прогрессирования тяжести ПС содержание ТТГ уменьшается, что можно объяснить развитием нарушений белоксинтетической функции печени и увеличением потребности тканей в тиреоидных гормонах. Также, по данным исследований, у 67% пациентов с ПС отмечается гиперфункция щитовидной железы. У них также наблюдалось повышение уровня связанного с белком тироксина при нормальной концентрации свободного гормона, являющегося биологически активной формой гормона. Поэтому у пациентов с ПС нет явных признаков гипертиреоза. Даже в состоянии эутиреоза у больных ПС обнаруживается первичное снижение тироксинсвязывающей способности белков сыворотки при незначительном снижении уровня общего тироксина. При этом уровень трийодтиронина в сыворотке крови имеет тенденцию к снижению [1, 13].
При ПС и псориартрическом артрите повышен риск формирования неалкогольной жировой болезни печени (НАЖБП). К основным синдромам повреждения ГБС у больных ПС и псориатическим артритом относятся цитолитический, холестатическии, печеночно-клеточной недостаточности, синдром иммунного воспаления. Помимо дислипидемического профиля также низкие уровни адипонектина наблюдались у пациентов с ПС и НАЖБП по сравнению с пациентами без поражения печени. Этот аспект может быть связан с адипонектинопосредованным подавлением Т-хелперных цитокинов 1 типа [16, 17].
Ожирение влияет на эффективность лечения ПС, влияя как на фармакокинетику, так и на фармакодинамику препаратов. Пациенты с ожирением и ПС часто имеют пониженный ответ на системную и биологическую терапию. Это особенно характерно для лекарств, которые вводятся в фиксированных дозах, а не для тех, где доза корректируется с учетом массы тела пациента. Лечение ГИБП, доза которых не скорректирована по массе (например, адалимумаб, этанерцепт), может иметь худшую эффективность. Кроме того, ожирение часто связано с нарушениями обмена веществ или метаболизма печени, что повышает риск побочных эффектов традиционной системной терапии [13]. К менее распространенным коморбидным патологиям относят амилоидоз, органические нарушения со стороны нервной системы (энцефалопатии) [18].
Перечисленные состояния могут приводить к выраженному снижению качества жизни пациентов, социальной дезадаптации и даже к инвалидизации пациентов. Коморбидные патологии осложняют течение основного заболевания, приводя к трудностям в назначаемой и проводимой терапии, а также к изменению течения клинической картины, сложностям диагностического поиска. Необходимо учитывать коморбидные патологии при выборе метода терапии, т.к. у каждого отдельного препарата могут быть различными характеристики, скорость наступления ремиссии, долгосрочная эффективность, профиль безопасности и влияние на сопутствующие заболевания.
Цель исследования: изучить профиль безопасности и эффективности ГИБП из группы ингибиторов ИЛ-17А (нетакимаб) у пациентов с ПС гладкой кожи и воспалительной болью в спине с учетом коморбидных патологий.
Методы
Дизайн исследования: проспективное неинтервенционное исследование. Оценку эффективности проводили с учетом общепринятых индексов тяжести ПС (PASI и BSA) и псориатического артрита (BASDAI, DAPSA, ACR20).
Под наблюдением находились 39 пациентов с ПС: 21 (53,8%) мужчина и 18 (46,2%) женщин в возрасте 18–48 лет (средний возраст – 35,3±2,1 года), которые получали ГИБП нетакимаб в дозировке 120 мг подкожно на 0-й, 1, 2-й неделях и затем 120 мг каждый месяц на протяжении 52 недель. Средняя продолжительность ПС кожи составила 14,7 года. Среднее значение PASI – 31,4 балла, BSA – 36,6 балла, также отмечалась высокая активность ПсА со средним значением BASDAI 6,6 (SD=0,4) балла. Основными коморбидными патологиями являлись метаболический синдром (37/94,9%), атеросклероз каких-либо сосудов и ишемическая болезнь сердца (12/30,8%), тревожные или депрессивные расстройства (12/30,8%), нарушения функции щитовидной железы (9/23,1%), СД1 или СД2 (8/20,5%), НАЖБП (3/7,7%), нарушения функции почек (1/2,6%). В наше исследование мы не включали пациентов с воспалительными заболеваниями кишечника и рецидивирующими кандидозными инфекциями. Период наблюдения составил 52 недели.
Перед назначением препарата пациенты прошли обследование в соответствии с клиническими рекомендациями при назначении биологической терапии (клинический анализ крови, мочи, биохимический и общий анализы крови, anti-HCV, HBsAg, anti-HIV, MP/RPR, диаскин или SPOТ-тест, флюорограмма), а также были проведены консультации и мониторинг пациентов ревматологом, эндокринологом (мониторинг гликированного гемоглобина и глюкозы сыворотки крови) и кардиологом (ЭКГ).
Статистический анализ данных проводили при помощи специализированных программ SPSS Statictics, 26.0 (StatSoft Inc, США) и StatTech 2.8.8 (ООО «Статтех», Россия).
Результаты
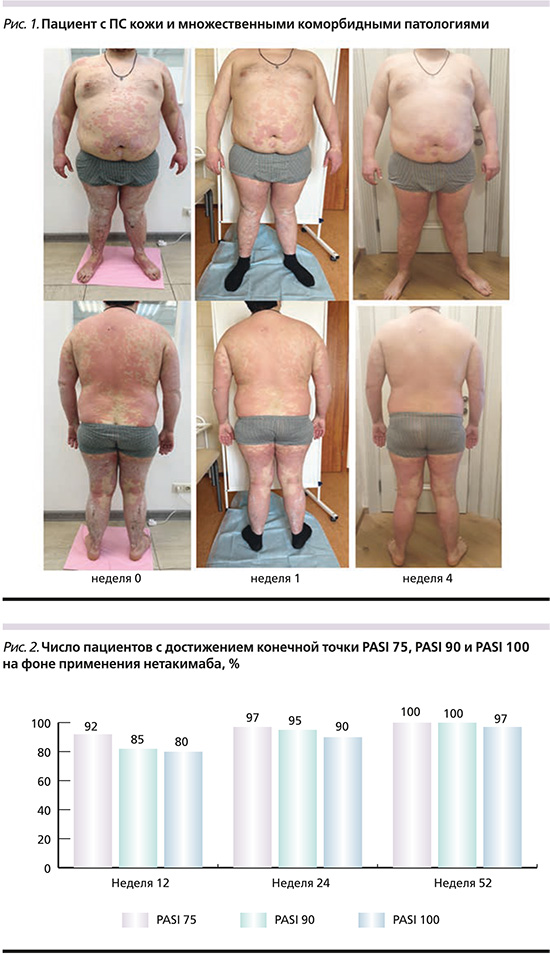
Общая терапевтическая эффективность оценивалась в соответствии с числом пациентов с достижением PASI 75, PASI 90, PASI 100. Большинство пациентов, принимавших нетакимаб, отметили выраженную положительную динамику со стороны кожного процесса и суставов уже к концу третьей недели терапии (рис. 1). К 12-й неделе 36 (92,3%) пациентов достигли уровня PASI 75, 33 (84,6%) – PASI 90 и 31 (79,5%) пациент – PASI 100.
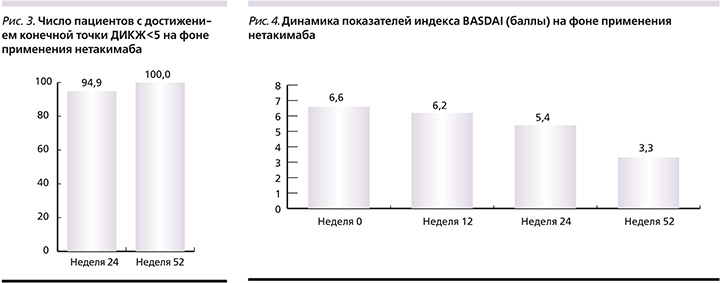
К 24-й неделе дельта PASI 75 отмечена у 38 (97,4%) пациентов, PASI 90 – у 37 (94,9%), PASI 100 – у 35 (89,7%) пациентов. К 52-й неделе 39 (100%) пациентов достигли уровня PASI 75, 39 (100%) – PASI 90 и 38 (97,4%) пациентов – PASI 100 (рис. 2).
На фоне терапии нетакимабом пациенты отметили значительное улучшение качества жизни. К 24-й и 52-й неделям дерматологический индекс качества жизни (ДИКЖ)<5 был у 94,9 и 100,0% пациентов соответственно (рис. 3).
Кроме того, до терапии отмечалась высокая активность заболевания со стороны костно-суставной системы со средним значением BASDAI 6,6 (SD=0,4) балла. Все пациенты в группе нетакимаба сообщили об уменьшении воспалительной боли в спине на 12-й, 24 и 52-й неделях со средним значением BASDAI 6,2 (SD=1,4), 5,4 (SD=1,2) и 3,3 (SD=0,6) соответственно (рис. 4).
Установлено, что 32 (82,1%) пациента в группе нетакимаба достигли ACR20 к концу исследования на 52-й неделе. В промежуточной точке оценки результатов на 12-й неделе ACR20 составила 66,6%. У всех пациентов на момент начала терапии наблюдалась высокая активность заболевания. Большинство пациентов, получавших нетакимаб, достигли ремиссии по DAPSA или низкой активности заболевания по DAPSA через 24 недели терапии.
Следует отметить, что на фоне применения нетакимаба не отмечалось побочых эффектов, которые требовали бы отмены препарата или корректировки дозировки препаратов, принимаемых по коморбидным патологиям. Наблюдалось более медленное действие от терапии нетакимабом у пациентов с ожирением (ИМТ>35) к 12-й неделе по сравнению с пациентами без ожирения (ИМТ до 30), однако к 24-й и 52-й неделям не было выявлено различий в достижении PASI 75, PASI 90, PASI 100 среди таковых. У пациентов с артериальной гипертензией не было отмечено изменений систолического и диастолического давления критического характера, также не было отмечено изменений на ЭКГ. Не наблюдалось побочных эффектов у пациентов с СД1 или СД2, дисфункцией щитовидной железы и НАЖБП. Также в нашем исследовании наблюдался один пациент с хронической почечной недостаточностью, однако его лабораторные показатели не изменялись в худшую сторону (скорость клубочковой фильтрации не выходила за границы 1-й стадии, повысился уровень общего белка, показатели азотистого обмена и уровень протеинурии сохранялись прежними).
Заключение
Таким образом, в нашем исследовании ингибиторы ИЛ-17А (нетакимаб) обладают высокой эффективностью и благоприятным профилем безопасности в отношении клинических симптомов ПС, воспалительной боли в спине (возможно, как ранними признаками псориатического артрита) и множественными сопутствующими коморбидными патологиями. Тяжелые и среднетяжелые формы ПС почти всегда протекают вместе с коморбидной патологией, и выбор соответствующего метода терапии бывает затруднен.
Некоторые лекарственные средства могут помочь при одном коморбидном состоянии и оказать негативное воздействие на другое. В настоящее время в таких случаях все чаще применяют ГИБП благодаря их эффективности и благоприятному профилю безопасности. Согласно публикациям, применение ГИБП оказывает положительное воздействие, в т.ч. и на коморбидные заболевания. В нашем исследовании ингибиторы ИЛ17-А (нетакимаб) показали высокую эффективность и благоприятный профиль безопасности в отношении клинических симптомов ПС, воспалительной боли в спине (возможно, как ранних признаков псориатического артрита) и множественных сопутствующих коморбидных патологий. Однако все еще остается необходимость дальнейшего изучения влияния ГИБП, используемых в терапии ПС, на коморбидные и сопутствующие заболевания. Именно персонализированный подход к терапии таких больных позволит минимизировать риски низкой эффективности терапии, побочных эффектов от большого количества лекарственных препаратов, что будет способствовать улучшению качества жизни пациентов.



