Введение
За последние десятилетия метотрексат признан «золотым» стандартом лечения ревматоидного артрита (РА) и некоторых других форм артрита, а также аутоиммунных заболеваний [1, 2].
Впервые он был использован в лечении РА и псориаза в 1951 г. после его разработки в конце 1940-х гг. в качестве химиотерапевтического средства злокачественных новообразований. Однако ему уделялось мало внимания в терапии ревматических заболеваний, пока в начале 1980-х не было опубликовано серии случаев, описывающих его эффективное использование при РА [3].
Краткосрочные рандомизированные исследования в середине 1980-х гг. подтвердили его эффективность при РА, а последующие долгосрочные наблюдения показали, что ответ был стойким, а токсичность управляемой. Все это способствовало широкому использованию метотрексата в качестве терапии первой линии и признанию его стандартом лечения РА во всем мире [3, 4].
Несмотря на появление множества новых препаратов в ревматологии в последние годы, в т.ч. таргетной биологической терапии, метотрексат остается основой лечения РА благодаря его доступности и оптимальному профилю соотношения эффективности и безо-пасности [1].
Метотрексат используют как в качестве монотерапии первой линии пациентов, ранее не получавших модифицирующие препараты, так и в составе комбинированной терапии в сочетании с другими традиционными или биологическими модифицирующими антиревматическими препаратами при недостаточном ответе на метотрексат для максимального терапевтического эффекта [5–7], однако даже низкие дозы препарата не лишены лекарственно-индуцированной пневмопатии.
Эпидемиология
Потенциальные побочные эффекты, связанные с метотрексатом, привлекают значительное внимание, поскольку они считаются основной причиной отмены препарата [8]. Наиболее частые побочные реакции, связанные с метотрексатом, – это желудочно-кишечные проявления и гепатотоксичность. Поражение легких встречается значительно реже и характеризуется тенденцией к снижению в последние десятилетия [9]. Частота метотрексатового пневмонита варьируется, по данным разных исследований, от 0,3 до 11,6% [10, 11] в зависимости от использованной методологии и критериев диагностики «метотрексатового легкого». Точную частоту метотрексатовой пневмопатии (М-пневмопатии) определить невозможно ввиду сопутствующей потенциально пневмотоксичной терапии, а также возможных легочных проявлений основного ревматологического заболевания [9, 12].
По данным литературы, М-пневмо-патия характеризуется достаточно высокой летальностью, варьирующейся в диапазоне от 11 до 30% [13–16]. Кроме того, показано, что на уровень смертности может влиять продолжительность терапии и именно ранние сроки применения препарата требуют пристального внимания к пациентам. Так, при анализе 56 случаев М-пневмопатии у больных РА показано, что смертность была выше среди пациентов, у которых развился пневмонит на фоне лечения метотрексатом в течение <6 месяцев, по сравнению с пациентами, лечившимися в течение более длительного периода времени [16].
В связи с этим потенциальные побочные эффекты требуют информированности и настороженности со стороны как врачей, так и пациентов при использовании этого препарата [1].
Патогенез и патологические варианты
В отличие от препаратов с дозозависимыми механизмами пневмопатии, такими как амиодарон или блеомицин, при использовании метотрексата легочная токсичность может развиваться при лечении как высокими, так и низкими дозами препарата, что свидетельствует о реакции гиперчувствительности, не связанной с антагонизмом фолиевой кислоты [17]. Соответственно, М-пневмопатия не связана с дефицитом фолиевой кислоты и может возникать при относительно низких дозах (<20 мг в неделю), которые обычно и используются в практике ведения пациентов с РА [18, 19].
Механизмы патологического влияния метотрексата на легкие изучены недостаточно. Обсуждается несколько возможных патогенетических механизмов М-пневмопатии, включая прямую легочную токсичность препарата, гиперчувствительность, иммуносупрессию и измененную экспрессию цитокинов, способствующих воспалительному ответу легких и повреждению тканей [1, 20, 21]. Большинство исследователей полагают, что М-пневмопатия индуцирована реакцией гиперчувствительности IV типа, с чем связаны лихорадка, периферическая эозинофилия, увеличение CD4 клеток в жидкости бронхоальвеолярного лаважа (БАЛ), а также инфильтрация мононуклеарными клетками и формирование гранулематозного воспаления в легких [10, 12, 22, 23]. Вместе с тем существует предположение и о прямой пневмотоксичности метотрексата, опосредованной повреждением альвеолярного эпителия и последующим формированием фиброза легких с уменьшением количества альвеолярных эпителиальных клеток и увеличением фибробластных клеток в легочной ткани [24].
Выделяют два фенотипа М-пневмо-патии: 1-й фенотип возникает на ранних сроках приема метотрексата (<6 месяцев) с преобладанием нейтрофилов, формированием фиброзных изменений в легких и высоким уровнем смертности; 2-й формируется спустя как минимум 6 месяцев терапии метотрексатом с преобладанием лимфоцитов, характеризуется меньшим фиброзообразованием в легких и низким уровнем смертности. В этом исследовании летальность составила 11% среди больных РА с М-пневмопатией, и все случаи относились к группе с ранним началом/низкой кумулятивной дозой метотрексата. Причины этого разделения остаются малопонятными и требуют дальнейших проспективных исследований, однако такая дифференциация метотрексат-индуцированного поражения легких может быть опосредована генетической основой, инициирующей различные иммунологические ответы [16]. При этом генетические факторы могут определять гетерогенность клинического ответа на метотрексат с точки зрения как эффективности, так и токсичности [1].
Иммуносупрессивные эффекты метотрексата ухудшают иммунный статус пациентов, увеличивая риск оппортунистических инфекций, вызываемых Pneumocystis jirovecii, цитомегаловирусом, вирусом ветряной оспы, Nocardia, микобактериями или другими грибами [25, 26]. Пневмоциста – наиболее частый возбудитель, достигающий в некоторых исследованиях до 40% инфекционных осложнений [12, 26, 27], что создает дополнительные трудности в дифференциальной диагностике. В связи с этим целесообразна рекомендация по регулярному мониторингу количества CD4 при кумулятивной дозе метотрексата более 400 мг, особенно среди пациентов с лимфоцитопенией в общем анализе крови [28].
Следует отметить, что пациенты, получающие метотрексат, также подвержены повышенному риску развития лимфопролиферативных заболеваний, которые во многих случаях регрессируют после отмены метотрексата [10, 29, 30].
Возможны разные патогистологические варианты «метотрексатового легкого»: гиперчувствительный пневмонит, острая интерстициальная пневмония, организующаяся пневмония, эозинофильная пневмония (рис. 1), а также поражение плевры и дыхательных путей [31, 32].
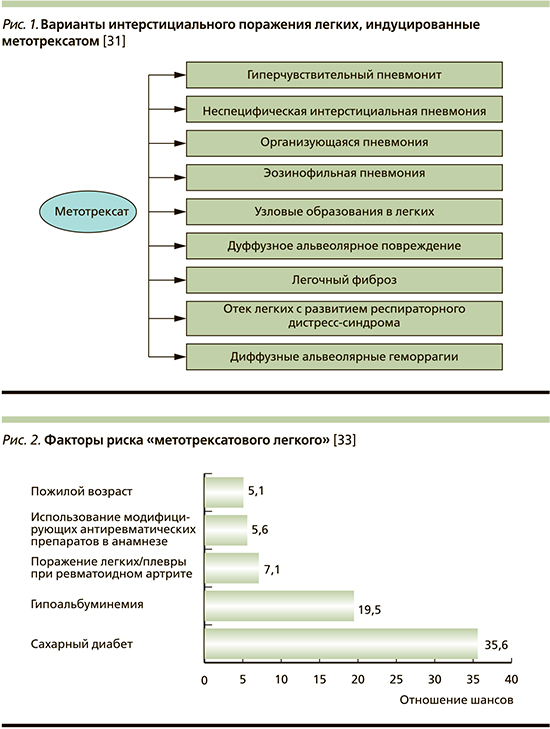
Фиброзирующий фенотип метотрексат-индуцированного интерстициального заболевания легких (ИЗЛ) с формированием «сотового легкого» и поражение бронхиол встречаются редко. Вместе с тем в отсутствие своевременного вмешательства М-пневмопатия может сопровождаться фиброзной перестройкой легочной ткани, что, по литературным данным, выявляется у 10% больных при гистологическом исследовании [12, 30].
Факторы риска
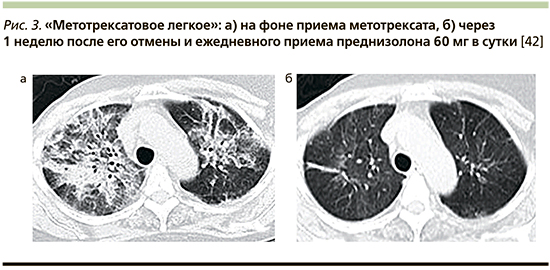
Выделяют несколько факторов риска пневмотоксического эффекта метотрексата: сахарный диабет, гипоальбуминемия, поражение легких/плевры при РА, использование модифицирующих заболевание препаратов, а также пожилой возраст (рис. 2).
Механизмы указанных факторов риска изучены не полностью, однако имеют теоретическое обоснование. Так, сахарный диабет ассоциируется с гиперинсулинемией, которая сопровождается полиглутамацией метотрексата [34]. Этот процесс в свою очередь способствует дисбалансу внутриклеточной и внеклеточной фракции метотрексата и внутриклеточной аккумуляции препарата. Высокий уровень внутриклеточного метотрексата приводит к интенсификации синтеза полиглутамата метотрексата и усилению цитотоксического эффекта. Гипоальбуминемия может способствовать более низкой аффиляции с белками плазмы, что приводит к увеличению уровня свободного метотрексата.
К дополнительным факторам риска относят заболевания легких до инициации препарата, замедление клиренса метотрексата вследствие патологии почек или накопления в плевральной или асцитической жидкостях, при наличии таковых, а также генетический полиморфизм метаболизма метотрексата [9, 12]. Кроме того, нарушение легочной функции также рассматривается как фактор риска М-пневмопатии. Два проспективных исследования показали, что применение метотрексата может способствовать прогрессирующему ухудшению параметров функции внешнего дыхания. В исследованиях показано, что после 2 лет лечения низкими дозами метотрексата у пациентов могут развиваться рестриктивные нарушения со значительным снижением общей емкости легких, функциональной остаточной емкости, объема форсированного выдоха за 1 секунду и форсированной жизненной емкости легких [35, 36]. При исходном снижении параметров легочной функции и диффузионной способности легких у больных РА применение метотрексата может сопровождаться более высоким риском развития М-пневмопатии [37].
Диагностика «метотрексатового легкого»
Диагноз М-пневмопатии основывается на интеграции клинических и радиологических данных и является диагнозом исключения.
«Метотрексатовое легкое» может проявляться в острой и подострой формах, доминирующих по частоте встречаемости, и реже в хронической форме. Симптоматика включает сухой кашель и одышку, наблюдаемые более чем у 80% больных, лихорадка встречается не менее чем у 60% пациентов [10, 11]. По данным литературы, перечисленные клинические проявления нередко сопровождаются эозинофилией периферической крови, присутствующей примерно у 25–50% пациентов с подострым «метотрексатовым легким» [12, 13, 38, 39]. Кроме того, в регистр-рядах у пациентов с метотрексат-индуцированным ИЗЛ продемонстрировано: уровень лимфоцитов периферической крови снижается в момент активной фазы «метотрексатового легкого» и возвращается к норме после выздоровления [40].
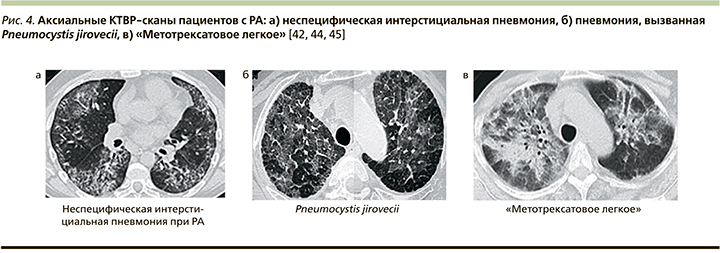
У большинства пациентов клинические проявления развиваются в течение первого года приема препарата [19, 33]. Однако в литературе представлены сообщения о раннем развитии легочного поражения (через 12 дней от начала терапии) и о более поздних дебютах: спустя 18 и более лет применения препарата [27, 41, 42]. Так, в литературе представлен клинический случай пациентки 77 лет, страдавшей РА, по поводу которого принимала метотрексат более 30 лет. Пациентка стала отмечать одышку, нараставшую с течением времени, и непродуктивный кашель. На момент обращения за медицинской помощью одышка возникала при минимальном физическом напряжении и затрудняла самообслуживание пациентки. По данным анамнеза не было продукции мокроты, кровохарканья, не выявлено аллергических реакций, контакта с токсическими веществами, животными, пылью и любыми другими внешне-средовыми воздействиями. РА хорошо контролировался приемом метотрексата в дозе 2,5 мг ежедневно. При объективном осмотре отмечалось повышение температуры тела до 38,2 градуса, сатурации 88% при дыхании воздухом. В общем анализе крови лейкоцитоз – 9,4×109 л, эозинофилы – 18,3%, СОЭ – 111 мм/ч. По данным компьютерной томографии высокого разрешения (КТВР) легких (рис. 3а) выявлено двустороннее снижение прозрачности легочной ткани, преимущественно в верхних отделах. Результаты микробиологических исследований не обнаружили признаков инфекционного процесса. Пациентке был отменен метотрексат и назначен преднизолон per os в суточной дозе 60 мг ежедневно с последующим положительным клинико-рентгенологическим ответом (рис. 3б), что служит фактом, подтверждающим диагноз метотрексатового легкого [42].
Таким образом, клиническая картина метотрексатового легкого малоспецифична и может возникать при различной продолжительности терапии метотрексатом.
Рентгенологические данные отражают лежащий в основе патоморфологический процесс и включают в основном неспецифическую интерстициальную пневмонию (НСИП) и реже организующуюся пневмонию [32, 33, 43]. Рентгенография органов грудной клетки, как правило, не выявляет изменений в течение первых недель клинической симптоматики – продромальном периоде, затем поражение легких быстро прогрессирует с формированием билатеральных диффузных зон альвеолярного уплотнения без специфических радиологических симптомов. При КТВР на ранних стадиях визуализируются рассеянные или диффузные зоны «матового стекла», фокусы консолидации с возможным формированием базального фиброза на более поздних стадиях заболевания [12, 14, 32].
Оценка параметров легочной функции, в частности диффузионной способности легких, помогает оценить степень тяжести интерстициального поражения. Однако дифференциальный диагноз, который включает инфекционные осложнения, вызванные Pneumocystis jirovecii, вирусные и атипичные пневмонии, а также ИЗЛ как проявление системности при РА, нередко представляет сложную клиническую задачу [10, 13]. В некоторых случаях достаточно сложно разграничить лекарственно-индуцированную пневмопатию от поражения легких при РА без проведения детального обследования.
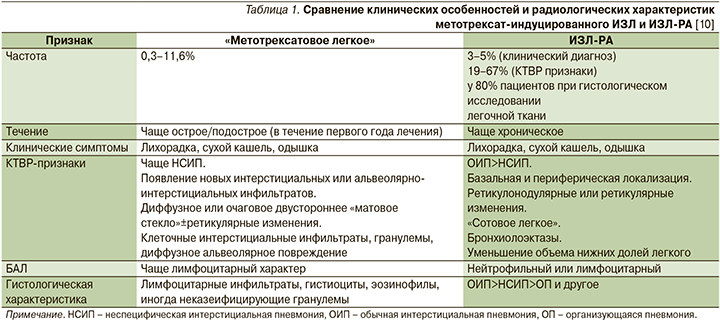
Анализ жидкости БАЛ имеет определяющее значение в дифференциальной диагностике с оппортунистическими инфекциями, поскольку пневмонии, вызываемые этими возбудителями, характеризуются сопоставимыми клинико-радиологическими проявлениями (рис. 4), кроме того, эти возбудители ассоциируются с приемом метотрексата, особенно при кумулятивной дозе свыше 700 мг [15, 26].
Образцы БАЛ необходимо исследовать на бактериальные, вирусные, грибковые и микобактериальные патогены, а также на злокачественные клетки. Анализ жидкости БАЛ более информативен для исключения таких процессов, как инфекция и канцероматозный лимфангит, чем для верификации окончательного диагноза М-пневмопатии [12]. Бронхоскопию с БАЛ проводят пациентам с впервые возникшим заболеванием легких на фоне терапии метотрексатом, когда необходимо исключить такие процессы, как инфекция или злокачественное новообразование (например, при наличии лихорадки, диффузных или узловых инфильтратов по данным рентгенографии или быстро прогрессирующего нарушения легочной функции).
У большинства пациентов при метотрексат-индуцированном ИЗЛ наблюдается лимфоцитарный характер БАЛ [10, 46], хотя нейтрофильный тип БАЛ также может встречаться [39, 47]. Систематический обзор литературы, посвященный характеристикам БАЛ при М-пневмопатии, показал, что лимфоцитоз присутствовал в большинстве (89%) образцов БАЛ, в то время как высокие уровни нейтрофилов выявлены только в 17% случаев [47].
Вместе с тем лимфоцитарный характер БАЛ, как и другие проявления, неспецифичны для «метотрексатового легкого», поскольку они также наблюдаются при ИЗЛ в рамках РА (табл. 1).
В качестве биомаркеров для диагностики и мониторинга, метотрексат-индуцированного ИЗЛ обсуждаются сывороточные уровни KL-6, гликопротеинового антигена и сурфактантного белка D, которые экспрессируются в основном пневмоцитами II типа [48]. Однако обнаружено, что они увеличиваются и при других заболеваниях легких [49], поэтому их диагностическую информативность, если таковая имеется, в контексте метотрексатового легкого еще предстоит определить.
Трансбронхиальная биопсия легкого (ТББ) в ряде случаев может быть полезным диагностическим дополнением. В исследовании, в котором участвовали 44 пациента с лекарственным поражением легких, ¾ из них целенаправленно подверглись ТББ [50], которая оказалась диагностически информативной в 75% случаев. Картина гистологических изменений при поражении легких метотрексатом включает лимфоцитарный альвеолит (71%), организующуюся пневмонию (10%), гиалиновые мембраны (8%), формирование гранулем без признаков некроза в 35% случаев как проявление патогистологической картины гиперчувствительного пневмонита [19]. Гранулематозные изменения при исследовании биоптатов легких обычно свидетельствуют в пользу метотрексат-индуцированных инфильтратов и их наличие позволяет исключить ревматоидное поражение [12].
Следует отметить, что патогистология не имеет самостоятельного диагностического значения для верификации поражения легких, вызванного метотрексатом, однако ее результаты могут предоставить дополнительную информацию, которая при интеграции с клиническими, радиологическими, лабораторными и другими признаками позволяет выставлять окончательный диагноз [10]. Пациентам, которые быстро реагируют на отмену препарата, биопсии легкого обычно не требуется. Напротив, биопсия легкого показана, когда у пациента есть острое, прогрессирующее или тяжелое заболевание и причина пневмонита остается невыясненной [12].
Таким образом, на сегодняшний день не существует высокоспецифического диагностического теста для верификации метотрексат-индуцированной пневмопатии, поэтому положительная динамика КТВР, сопровождающаяся улучшением клинико-функционального статуса пациента на фоне отмены препарата, является основным методом дифференциальной диагностики. Диагноз «метотрексатовое легкое» основан на сочетании соответствующих клинических проявлений, радиологических изменений, результатов анализа жидкости БАЛ, гистологии легких (если таковая имеется) и важнейшим из определяющих признаков – реакции на отмену препарата.
С учетом отсутствия специфического диагностического теста предложен набор критериев для установления диагноза поражения легких, вызванного метотрексатом, которые упоминаются в литературе до настоящего времени [9, 12]. Диагностический набор включает большие и малые критерии (табл. 2).

Метотрексатовое легкое расценивается как определенное при наличии первого или второго в комбинации с третьим большим критерием и наличием минимум трех из пяти малых критериев. Вероятное метотрексатовое легкое подразумевает сочетание второго и третьего больших критериев в дополнение к любым двум малым критериям [13].
Метотрексат и предшествующее ИЗЛ
Метотрексат рекомендуется в качестве терапии первой линии при РА, поскольку он эффективно снижает активность заболевания, заболеваемость и смертность [7, 51]. «Триада» из метотрексата, ИЗЛ и РА привлекает к активным дискуссиям и вызывает разногласия на протяжении многих лет. У больных РА с установленным диагнозом ИЗЛ безопасность метотрексата и других противоревматических препаратов, потенциально обладающих пневмопатическим действием, остается предметом активного обсуждения [2, 9]. Так, исследования, выполненные в 1980–1990-е гг., рассматривали метотрексат в качестве препарата, потенциально индуцирующего ИЗЛ, в т.ч. легочного фиброза [53–55]. В ряде публикаций показано, что уже существующее ИЗЛ при РА рассматривается в качестве неблагоприятного прогностического фактора М-пневмопатии [52, 56–58]. Исходя из этих данных, некоторые ревматологи и пульмонологи имеют сдержанное отношение к назначению метотрексата пациентам с ИЗЛ-РА [2].
Однако с 2001 г. в рандомизированных клинических исследованиях метотрексата при РА не было зарегистрировано ни одного случая метотрексатового пневмонита [19]. Публикации последних лет ставят под сомнение связь между метотрексатом и развитием ИЗЛ [59–61]. Кроме того, в последние годы накапливается все больше данных о протективном действии метотрексата в отношении ИЗЛ–РА [2, 61, 62]. Так, при оценке риска развития ИЗЛ у больных РА прием метотрексата способствовал удлинению времени до появления признаков интерстициального поражения легких: Odds ratio (OR) 0,41, 95% доверительный интервал (ДИ) 0,23–0,75, p=0,004) [61]. Аналогичные данные, подтверждающие гипотезу о возможной обратной связи между использованием метотрексата и развитием ИЗЛ у пациентов с РА, представлены в исследовании «случай–контроль» на 410 пациентах с хроническим фиброзирующим ИЗЛ-РА и 673 – с РА без интерстициального поражения. Было показано, что среди пациентов с ИЗЛ–РА диагноз интерстициального поражения легких выставлялся на 7 лет позже при применении метотрексата по сравнению с больными, которые никогда не принимали метотрексат (4,0±7,4 и 11,4±10,4 года, соответственно; p<0,001) [2]. Кроме того, появляются исследования, свидетельствующие о дозозависимом протективном влиянии метотрексата на ИЗЛ у больных РА. Так, распространенность ИЗЛ была значительно выше в группе больных РА, которые никогда не применяли метотрексат по сравнению с группой пациентов, использующих метотрексат в дозе не менее 15 мг в неделю [62].
Приведенные данные исследования позволяют предположить, что метотрексат может рассматриваться как препарат с модифицирующим эффектом на ИЗЛ-РА, который может быть результатом различных противовоспалительных механизмов, включая 1) прямой иммуносупрессивный эффект метотрексата, специфически нацеленный на легкие, аналогичный тому, что наблюдается при некоторых других иммуноопосредованных легочных заболеваниях, таких как саркоидоз [63]; и 2) косвенный эффект, связанный с управляемым метотрексатом уменьшением системного воспаления, связанного с РА [2].
Таким образом, предшествовавшее ИЗЛ не является специфическим противопоказанием к назначению метотрексата. Однако некоторые эксперты рекомендуют оценивать параметры легочной функции до инициации терапии метотрексатом и при ограниченном респираторном резерве, например снижении диффузионной способности легких менее 70%, рекомендуется соблюдать осторожность при назначении данного препарата. [12, 37], а в случае установленного диагноза ИЗЛ считают целесообразным проводить тщательный клинический и функциональный мониторинг пациентов при лечении метотрексатом [9].
Метотрексат и биологическая терапия
На сегодняшний день метотрексат рассматривается в качестве базового модифицирующего препарата как для монотерапии раннего РА, так и для комбинированной терапии с биологическими препаратами в случае недостаточной эффективности монотерапии [64]. Такая тактика определяется результатами самых ранних исследований фазы III, проведенных с ингибиторами фактора некроза опухоли альфа (анти-TNF-α), которые продемонстрировали, что клинический ответ на биологическую терапию значительно улучшается при добавлении традиционных модифицирующих препаратов, в первую очередь метотрексата [65–67].
Улучшение клинического профиля терапевтического ответа, связанного с добавлением метотрексата к терапии анти-TNF-α, широко документировано у пациентов с РА в условиях реальной клинической практики [66–68]. Среди обсуждаемых механизмов преимущества терапевтической комбинации рассматриваются дополнительные модифицирующие эффекты метотрексата, а также вероятность снижения образование антител к анти-TNF-α-препаратам, что способствует оптимизации терапевтических эффектов [69]. Кроме того, проведенные исследования не демонстрируют увеличения риска ИЗЛ при использовании комбинации метотрексата и анти-TNF-α-препаратов.
Однако в последние годы в связи с расширением использования потенциала биологической терапии проанализированы и другие комбинации препаратов, в частности применение абатацепта, рекомбинантного иммуномодулирующего препарата, в сочетании с метотрексатом. Так, японские исследователи, оценивая эволюцию ИЗЛ у пациентов с РА, длительное время получавших абатацепт, отмечают прогрессирующее течение ИЗЛ среди пациентов на комбинированной терапии метотрексатом (OR=2,75, 95% ДИ: 1,09–148,77) по сравнению с пациентами, получавшими монотерапию абатацептом [70]. Соответсвенно, авторами рекомендуется прекращение приема метотрексата с целью предотвращения прогрессирования ИЗЛ у пациентов с РА, получающих абатацепт.
Лечение «метотрексатового легкого»
Прекращение приема метотрексата является первым шагом терапевтической тактики. В большинстве случаев клиническое улучшение наступает в течение нескольких дней после прекращения приема препарата, за которым следует рентгенологическое улучшение в течение нескольких недель [12]. Было показано, что у большинства пациентов с М-пневмопатией, по данным КТВР, рентгенологическое выздоровление регистрируется в течение 31 дня [32].
В ряде случаев при выраженных клинических проявлениях с признаками дыхательной недостаточности необходимо рассмотреть вопрос о назначении системных глюкокортикостероидов (СГКС). Проспективные исследования по применению СГКС не представлены, однако клинический опыт и данные литературы свидетельствуют: применение СГКС ускоряет выздоровление больных М-пневмопатией [15, 42], хотя описаны случаи фатального течения даже на фоне прекращения метотрексата и назначения СГКС [71].
В большинстве случаев своевременное назначение СГКС (преднизолон в дозе 1 мг/кг/сут. per os) способствует благоприятному исходу метотрексатового легкого. Клиническое и гистологическое сходство пневмонита, вызванного метотрексатом, с острым гиперчувствительным пневмонитом рассматривается в качестве теоретического обоснования определенной эффективности СГКС [72]. Кортикостероиды рекомендуются коротким курсом до клинической стабилизации пациента [12].
В целом прогноз М-пневмопатии благоприятный и большинство пациентов полностью выздоравливают [37]. Повторное введение метотрексата пациентам, у которых развился метотрексатовый пневмонит, может приводить к рецидиву поражения легких, сопровождаясь более тяжелым течением и во многих случаях смертельным исходом [12, 13]. Несмотря на то что есть единичные случаи, когда препарат был успешно повторно введен [73], подобная практика не рекомендуется.
Заключение
Долгосрочное влияние метотрексата на легкие при РА вызывает озабоченность клиницистов на протяжении многих лет. Представленные противоречивые данные литературы о «взаимоотношениях триады» – РА, ИЗЛ и метотрексат – на сегодняшний день не позволяют сделать определенных выводов в отношении М-пневмопатии. С одной стороны, имеются данные о том, что предшествующее ИЗЛ и/или снижение параметров легочной функции служат фактором риска пневмонита, вызванного метотрексатом, и его неблагоприятного течения. С другой стороны, в последние годы накапливаются данные о протективном действии метотрексата в отношении развития ИЗЛ у пациентов с РА. Вопросы лекарственного взаимодействия при комбинации метотрексата с различными биологическими препаратами требуют дальнейших исследований и наблюдений, особенно в отношении высоковероятного неблагоприятного взаимодействия абатацепта и метотрексата. Метотрексатовый пневмонит нуждается в дифференциальной диагностике с инфекционными поражениями легких (Pneumocystis jirovecii и другие оппортунистические инфекции), интерстициальным поражением легких в рамках системности РА и является диагнозом исключения. При высокой диагностической вероятности метотрексатового легкого требуется незамедлительное прекращение приема препарата и назначение СГКС, что обусловлено относительно высокими показателями смертности при метотрексат-индуцированном ИЗЛ.
Таким образом, пневмопатия, вызванная метотрексатом, в большинстве случаев характеризуется благоприятным прогнозом, являясь непредсказуемым осложнением с потенциальным риском летального исхода. Назначение метотрексата должно сопровождаться предварительной оценкой показателей легочной функции и КТВР легких, необходимых для последующей динамической оценки состояния пациента в случае появления/усиления респираторных симптомов. Пациента, принимающего метотрексат, следует информировать о необходимости незамедлительного обращения за медицинской помощью в случае возникновения новых легочных симптомов, таких как кашель, лихорадка и/или одышка.



