Введение
Атопический дерматит (АтД) – распространенное многофакторное воспалительное заболевание кожи хронического рецидивирующего течения, характеризующееся истинным полиморфизмом высыпаний [1, 2]. За последние десятилетия распространенность атопических заболеваний, включая АтД, бронхиальную астму (БА), аллергический ринит (АР) и пищевую аллергию (ПА), имеет тенденцию к росту в общемировой популяции. Атопические заболевания нередко взаимосвязаны на протяжении жизни пациента в рамках такого явления, как атопический марш. Данный термин подразумевает прогрессирование с течением времени от АтД к АР, БА и ПА, а АтД считают «точкой входа» для последующих атопических заболеваний [3].
АтД оказывает влияние на качество жизни пациентов в результате недосыпания из-за частого развития выраженного зуда кожи, обеспокоенности пациентов состоянием кожи и их социальной стигматизации [4]. Как фенотип АтД представляется весьма гетерогенным с позиции этиологии заболеванием. Выделяют три основных вида дефектов при АтД: дефекты барьерной функции эпидермиса, врожденного иммунитета и иммунной регуляции. По данным литературы, у 80% детей, страдающих АтД, отмечается отягощенный семейный анамнез, при этом наличие атопических заболеваний хотя бы у одного из родителей повышает риск развития АтД у ребенка до 45–50%, что формально соответствует аутосомно-доминантному типу наследования – 50%-ный риск передачи заболевания [3, 5, 6].
АтД характеризуется нарушением барьерной функции кожи, снижением содержания длинноцепочечных жирных кислот в липидном слое и лимфогистиоцитарной инфильтрацией [1]. Это приводит к повышенной трансэпидермальной потере жидкости и воспалению кожи [1]. В патогенезе АД важную роль играет Т2-воспаление, обусловливающее дефекты кожного барьера, которое в основном опосредовано Th2-клетками клетками и врожденными лимфоидными клетками 2 типа. Так, в коже больных АтД отмечается повышение уровня T2-цитокинов, продуцируемых данными типами клеток, таких как интерлейкин-4 (ИЛ-4), -10, -13 и -31, наряду с которыми отмечается активизация воспалительных дендритных эпидермальных клеток, вместе с тем имеет место снижение уровня Th1-опосредованных цитокинов, таких как интерферон-γ и ИЛ-2, также отмечается снижение уровня кателицидина и числа плазматических дендритных клеток [1]. Ключевую роль в патогенезе АтД отводят ИЛ-4 и -13, данные цитокины вызывают спонгиоз эпидермиса и снижают экспрессию гена белка филаггрина (FLG) в кератиноцитах, что приводит к нарушению кожного барьера [7–9]. FLG является ключевым белком, участвующим в дифференцировке клеток эпидермиса и осуществлении его барьерной функции; образуется в ходе окончательной дифференцировки зернистых клеток эпидермиса, когда профилаггрин кератогиалиновых гранул протеолитически расщепляется на молекулы филаггрина, которые быстро агрегируют с кератиновым цитоскелетом, что приводит к коллапсу зернистых клеток в плоские безъядерные чешуйки. Образовавшийся роговой слой служит барьером, предотвращающим не только потерю воды, но и проникновение аллергенов и инфекционных агентов [3, 10]. Именно дефектный кожный барьер в сочетании со снижением защитных цитокинов (Th1-опосредованных) и антимикробных пептидов объясняет высокую восприимчивость пациентов с АтД к бактериальным, грибковым и вирусным патогенам [1].
Помимо отрицательного влияния на экспрессию FLG цитокины ИЛ-4 и -13
стимулируют экспрессию ИЛ-31. Повышенная экспрессия ИЛ-31 Th2-клетками приводит к усилению зуда у пациентов с АтД [1, 8, 9]. ИЛ-4 и -13 также связаны с дифференцировкой B-клеток и повышением продукции иммуноглобулина E (IgE) [1]. Кроме того, сообщается о корреляции уровней ИЛ-4 и -13 с тяжестью течения АтД [2, 11].
Таким образом, АтД – это иммуноопосредованное заболевание, в основе которого лежит Т2-воспаление и нарушение функции эпидермального барьера. Данное положение стало основой для разработки препаратов, направленных на подавление ИЛ-4 и -13 в терапии АтД как ключевых Т2-цитокинов, участвующих в патогенезе заболевания [12].
Наружной терапии (в т.ч. проактивная) топическими глюкортикостероидами (ТГКС) или ингибиторами кальциневрина достаточно для контроля большинства пациентов с АтД легкой или умеренной степени тяжести [2, 13–16]. Переход от наружной терапии к системным препаратам может потребоваться в случаях умеренной и тяжелой степеней заболевания, резистентных к местной терапии. Для лечения таких случаев могут быть назначены общие системные иммунодепрессанты (циклоспорин, азатиоприн, метотрексат, микофенолата мофетил) и системные ГКС, которые показали положительные эффекты в серии случаев и клинических испытаниях и упоминаются в европейских, японских и американских руководствах [2, 13, 14, 17–21]. Однако ни один из них не является вариантом долгосрочного лечения из-за их потенциальной токсичности и высокой вероятности развития побочных эффектов. Другой недостаток заключается в том, что большинство этих препаратов не лицензированы для применения пациентами с АтД во многих европейских странах и США [1]. Так, в Российской Федерации для системной терапии АтД из этих препаратов зарегистрированы только системные ГКС и циклоспорин.
Первое свидетельство обнадеживающего прорыва в терапии АтД появилось в 2014 г., когда FDA (Food and Drug Administration) присвоило препарату дупилумаб статус терапии прорыва [3, 22]. Препарат дупилумаб представляет собой рекомбинантное, полностью человеческое моноклональное антитело (МАТ), ингибирующее сигнальные пути ИЛ-4 и -13 посредством связывания с общей альфа-субъединицей рецептора ИЛ-4 [1, 23].
В настоящее время дупилумаб одоб-рен в нашей стране, странах Евросоюза и в США для дополнительной под-держивающей терапии БА среднетяжелого и тяжелого течений у пациентов в возрасте 12 лет и старше с эозинофильным фенотипом или у пациентов с гормональнозависимой БА, получающих пероральные ГКС, в качестве дополнительной поддерживающей терапии взрослых пациентов с плохо контролируемым тяжелым хроническим полипозным риносинуситом, а также для лечения среднетяжелого и тяжелого АтД у пациентов от 6 лет и старше при недостаточном ответе на терапию топическими лекарственными препаратами или в случае, когда такие препараты не рекомендованы к применению, при этом дупилумаб может применяться в монотерапии или одновременно с топическими лекарственными препаратами [23–25].
В клинических исследованиях III фазы с участием 1379 взрослых пациентов с АтД среднетяжелого и тяжелого течения, недостаточно контролируемого при применении местного лечения, монотерапия дупилумабом сопровождалась улучшением признаков и симптомов заболевания, включая зуд, беспокойство, депрессию и качество жизни больных [3, 26]. В группах терапии дупилумабом по сравнению с плацебо значительно реже наблюдалось развитие кожных инфекций. Согласно результатам данных клинических исследований, обе изученные схемы дозирования (300 мг подкожно каждую неделю или 300 мг подкожно каждые 2 недели в течение 16 недель) продемонстрировали схожую эффективность и безопасность. Наиболее частыми побочными эффектами были реакции в месте инъекции и конъюнктивиты [3, 26, 27].
В данной статье приведен опыт применения препарата дупилумаб у трех пациентов с тяжелым АтД.
Клинический случай 1
Пациентка Д. 35 лет на первичном осмотре предъявляла жалобы на распространенные, зудящие высыпания на коже, нарушение сна, связанное с выраженным зудом. Из анамнеза: в детстве – частые эпизоды зуда сгибательных поверхностей конечностей; ухудшение с 2017 г., самостоятельно использовала эмоленты без эффекта. Позже, с 2020 г., наблюдалась у аллерголога в другом медицинском учреждении с диагнозом АтД, были выявлены положительные аллергопробы на полынь, шерсть кошек, с 2020 г. наблюдается также в отделении дерматовенерологии и косметологии ФГБУ «Поликлиника № 1» УДП РФ с диагнозом АтД. Параллельно пациентка была обследована и получала сопутствовавшую терапию у гастроэнтеролога поликлиники с диагнозом «хронический поверхностный гастрит. Дискенезия желчевыводящих путей с нормальной функцией сладж. Наследственная предрасположенность к целиакции».
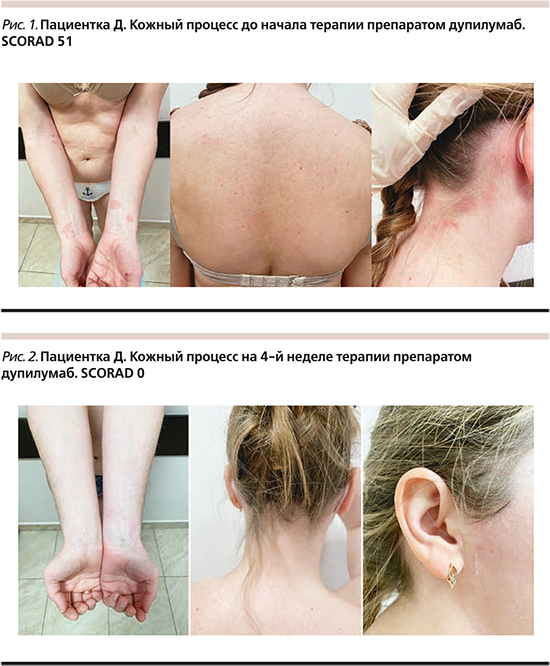
Проведенная терапия у аллерголога и дерматолога, а именно антигистаминными препаратами перорально и внутримышечно (в/м), стабилизаторами мембран тучных клеток перорально, системными ГКС перорально и в/м, стандартная наружная терапия (ТГКС, эмоленты, ингибиторы кальциневрина) – с незначительным, кратковременным эффектом. В связи с тяжелым течением АтД, распространенностью высыпаний на коже, отсутствием эффекта от используемых ранее методов терапии, принято решение о терапии генно-инженерным биологическим препаратом (ГИБП) дупилумаб. Обследована перед началом терапии: общий анализ крови (ОАК), биохимический анализ крови (б/х крови) – норма; иммуноглобулин E общий (IgE общ.) – норма (25,2 МЕ/мл); в соскобе с высыпаний обнаружены элементы гриба Malassezia; чесоточный клещ не обнаружен. Объективно на момент начала терапии: кожный процесс подостровоспалительный, распространенный, представлен сухими лихинифицированными, эритематозно-сквамозными макулами округлых очертаний до 2 см в диаметре на коже верхних конечностей; рассеянными, сухими, местами экскориированными, эритематозными папулами до 3 мм в диаметре на коже спины, ягодиц, груди; яркими, сухими, лихинифицированными, эритематозными макулами неправильных очертаний и немногочисленными эритематозными папулами на коже задней поверхности шеи с незначительным переходом на кожу волосистой части головы (ВЧГ) в затылочной области, на коже передней поверхности шеи, лица в периоральной области, заушных складок; сгибательной лихинификацией; подчеркнутым кожным рисунком; на коже конечностей – макулы гипопигментации с легким отрубевидным шелушением на поверхности. Индекс степени тяжести АтД SCORAD (Scoring Atopic Dermatitis) – 51 (рис. 1). Выполнены подкожные (п/к) инъекции препарата дупилумаб: в начальной дозе 600 мг (2 п/к инъекции), последующие – с интервалом 2 недели в дозе 300 мг, терапия с выраженным положительным эффектом, на 4-й неделе терапии отмечались полный регресс высыпаний, исчезновение зуда, индекс SCORAD 0 (рис. 2). Лабораторные показатели на 4-й неделе терапии: ОАК – норма, IgE общ. – норма (20 МЕ/мл). Побочных эффектов на фоне терапии ГИБП дупилумаб у пациентки не наблюдалось.
Клинический случай 2
Пациент К. 37 лет на первичном осмотре предъявлял жалобы на распространенные зудящие высыпания на коже, нарушение сна, связанное с выраженным зудом. Диагноз АтД установлен в раннем детском возрасте. Отмечает неуклонное рецидивирующее течение с 2017 г., связывает с предшествовавшей иммунизацией от гриппа, ранее проводимой терапией у дерматолога (системные ГКС в/м; антигистаминные препараты перорально и в/м), стандартной наружной терапией (ТГКС, эмоленты, ингибиторы кальциневрина) с кратковременным эффектом. В анамнезе: на левомицетин – токсикодермия, из сопутствовавших заболеваний – болезнь Бехтерева.
В связи с обострением кожного процесса обратился в отделение дерматовенерологии и косметологии «Поликлиника № 1» УДП РФ, обследован: в посеве с высыпаний –Staphylococcus aureus 104 КОЕ/мл, в соскобе с кожи чесоточный клещ не обнаружен, ОАК – норма, IgE общ. –норма (64,2 МЕ/мл), антитела (АТ) к эндомизию и глиадину не обнаружены. Также консультирован аллергологом поликлиники, установлен диагноз хронического АР; бытовой, грибковой, пыльцевой аллергии. В связи с распространенным кожным процессом, тяжелым течением АтД, торпидным к проводимым ранее методам терапии пациенту рекомендована терапия препаратом дупилумаб.
Объективно на момент начала терапии кожный процесс подостровоспалительный, распространенный, симметричный, представлен множественными эритематозно-лихеноидными высыпаниями, располагающимися местами на эритематозном фоне на коже шеи, туловища, конечностей. Кожа в области высыпаний, преимущественно в области сгибательных поверхностей конечностей, шеи, лихинифицирована, инфильтрирована. На коже лица, преимущественно в периорбитальной области, эритематозно-сквамозные очаги с нечеткими контурами. Веки отечны, утолщены, выражена периорбитальная складчатость. На коже тела часть элементов носит пруригинозный характер (элементы покрыты в центральной части точечной геморрагической корочкой).
В очагах поражения местами мелкопластинчатое шелушение, экскориации. Кожа кистей с эритематозно-сквамозными сухими макулами, располагающимися на фоне неяркой эритемы. На коже в области фаланг пальцев, мочек ушей линейные трещины до 5 мм в длину, единичные геморрагические корки. На коже ВЧГ множественные экскориации, легкое мелкопластинчатое шелушение, геморрагические корки до 3 мм в диаметре, кожа ВЧГ в затылочной области слабо лихинифицирована. Ногтевая пластина 4-го пальца левой кисти изменена – с поперечными бороздами в центральной части. Все ногтевые пластины кистей блестят, истончены (симптом полированных ногтей). Фолликулярный кератоз конечностей. Белый стойкий дермографизм. Индекс SCORAD – 73 (рис. 3).
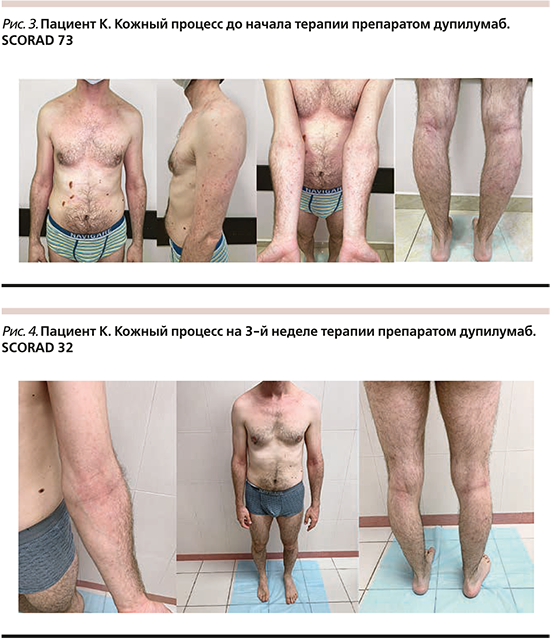
У пациента на фоне трехнедельной терапии препаратом дупилумаб (введение в начальной дозе 600 мг [2 п/к инъекции], последующие – с интервалом 2 недели в дозе 300 мг п/к) отмечалась положительная динамика в виде отсутствия новых высыпаний, разрешения высыпаний на кожном покрове (регресс порядка 90%), снижения выраженности зуда. Объективно кожный процесс на 3-й неделе терапии представлен немногочисленными эритематозными, лихеноидными высыпаниями на шее, туловище, конечностях, располагающимися на эритематозном фоне, кожа в области высыпаний, преимущественно в области сгибательных поверхностей конечностей, шеи лихинифицирована. Выражена складчатость век. Н/пластина 4-го пальца левой кисти изменена – с поперечными бороздами в центральной части. Симптом полированных ногтей положительный. Фолликулярный кератоз конечностей. Белый стойкий дермографизм. Индекс SCORAD на 3-й неделе терапии – 32 (рис. 4). Обследования на фоне терапии (ОАК, б/х крови, ОАМ) – в пределах нормы. Побочных эффектов на фоне терапии не наблюдалось.
Клинический случай 3
Пациентка К. 31 года страдает АтД с детства, отмечает неуклонный рецидивирующий характер заболевания на фоне стандартной наружной терапии, системных ГКС короткими курсами. С 2018 г. терапия препаратом циклоспорин А с эффектом. В связи с наступлением беременности в июле 2019 г. отмена циклоспорина, через месяц после отмены отмечено обострение кожного процесса, на фоне назначенной наружной терапии (ТГКС, эмоленты) – увеличение площади высыпаний, в связи с чем получала терапию препаратом метилпреднизолон с постепенным уменьшением дозы до 1 мг/сут. (решение о приеме данного препарата принято медицинским консилиумом совместно с врачами-гинекологами). В марте 2020 г. – роды, через 3 месяца после которых отмечала обострение кожного процесса вновь, в связи с чем совместно с врачом-педиатром было принято решение об отмене грудного вскармливания с целью подбора системной терапии АтД для матери. На момент дерматологического осмотра в июне 2020 г. пациентка предъявляла жалобы на распространенные зудящие высыпания на коже, нарушение сна, связанное с выраженным зудом. Обследована: ОАК – эозинофилы 16%, остальные показатели в пределах нормы, IgE общ. – 115,8 МЕ/мл, б/х крови – норма.

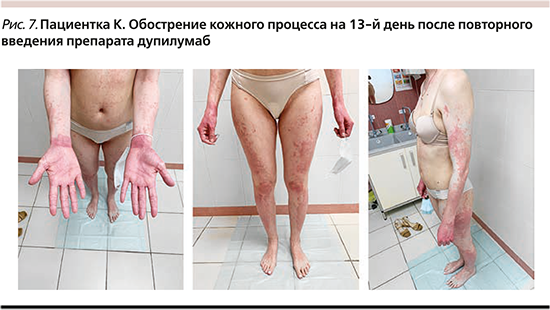
Объективно на момент осмотра: патологический кожный процесс островоспалительный, распространенный, симметричный, локализован на коже лица, шеи, туловища, конечностей, представлен эритематозными сухими пятнами и папулами, множественными экскориациями и участками лихенификации кожи, кожа кистей ярко-красного цвета, отечна, фолликулярный кератоз конечностей, белый стойкий дермографизм. Индекс SCORAD – 71 (рис. 5). Было принято решение о лечении ГИБП дупилумаб: введение в начальной дозе 600 мг (2 п/к инъекции), последующие с интервалом в 2 недели в дозе 300 мг п/к. После первого введения препарата дупилумаб пациентка отмечала улучшение состояния в виде регресса зуда, улучшения качества сна, улучшения «качества кожи», однако через 2 дня отметила появление новых элементов на коже и конечностей, сопровождавшееся интенсивным жжением и зудом, в связи с чем обратилась на повторный осмотр. Объективно на момент повторного осмотра: патологический кожный процесс распространенный, носит островоспалительный характер, локализован в области лица, шеи, туловища, конечностей, представлен распространенными отечными уртикариями, сохраняются множественные экскориации и участки лихенификации кожи, кожа кистей ярко-красного цвета. Индекс SCORAD – 42 (рис. 6). Лабораторно отмечалось увеличением уровня IgE общ. (388,8 МЕ/мл), эозинофилов крови (14%). В связи с развитием крапивницы получала в течение 3 дней в/в капельно раствор дексаметазона 12 мг на 200 мл физраствора. Также получала сопутствующую терапию: внутрь атаракс 25 мг/сут 7 дней, наружно эмоленты, ТГКС. На фоне терапии отмечено улучшение в виде регресса уртикарных высыпаний и жжения кожи. Новых высыпаний на фоне терапии не отмечала, зуд кожи регрессировал на 60%. Через 2 недели от первого введения дупилумаба произведена повторная инъекция препарата в дозе 300 мг п/к. На 13-й день после повторной инъекции отмечала обострение кожного процесса, усиление выраженности зуда, самостоятельно принимала антигистаминные препараты без эффекта. Объективно на момент повторного осмотра: патологический кожный процесс носит распространенный воспалительный характер, симметричный, локализован на коже лица, шеи, туловища, конечностей, новые элементы представлены эритемой с отечным компонентом, уртикариями и мелкопапулезными высыпаниями, кожа ладоней лихенифицирована, застойно-красного цвета («ихтиозная рука») (рис. 7). По данным лабораторных обследований: IgE общ. – 181,3 МЕ/мл, эозинофилы крови – 12%. На осмотре был назначен препарат дупилумаб в дозе 300 мг п/к, в/в капельно раствор дексаметазона 12 мг на 200 мл физраствора; стабилизатор мембран тучных клеток перорально, наружно ТГКС, эмоленты без выраженного эффекта со стороны кожи.
В связи с развитием нежелательного явления на фоне ГИБТ препаратом дупилумаб, а именно, крапивницы, было принято решение о переводе пациентки на терапию препаратом циклоспорин А. В настоящее время пациентка получает лечение циклоспорином А, с выраженным эффектом, отмечается клиническая ремиссия, стабилизация лабораторных показателей.
Заключение
Таким образом, в статье представлены наблюдения трех пациентов с тяжелой формой АтД одной возрастной группы, которые продемонстрировали положительный ответ на терапию ГИБП дупилумаб. У двух представленных пациентов препарат дупилумаб продемонстрировал высокую эффективность, за 1 месяц терапии был достигнут быстрый результат в отношении снижения индекса SCORAD – с 51 до 0 баллов и с 73 до 32 баллов. У одной пациентки, несмотря на положительный эффект со стороны кожного процесса (снижение индекса SCORAD – с 71 до 42 баллов), на фоне терапии наблюдалось развитие крапивницы. Тем самым, данные случаи иллюстрируют сложность ведения пациентов с АтД именно в подборе адекватной терапии, особенно в случае упорного течения заболевания.



