Введение
Псориаз – распространенное, хроническое, рецидивирующее, иммуноассоциированное заболевание, связанное с нарушением Т-клеточного иммунитета, приводящее к поражению кожи, опорно-двигательного аппарата, сердечно-сосудистой, нервной, эндокринной и других систем, нарушению метаболических процессов.
Псориаз является одним из самых распространенных хронических тяжелых заболеваний кожи, способный приводить к инвалидизации. По данным S.K. Kurd, J.M. Gelfand (2009), псориазом страдают около 3,5% населения планеты (примерно 125 млн человек) [1]. В Российской Федерации официальная статистическая отчетность Минздрава РФ ведется с 2009 г. По данным Минздрава, в РФ в 2019 г. всего зарегистрирован 362 881 больной псориазом, что соответствует 247,2 случая на 100 тыс. населения. Впервые в жизни диагноз «псориаз» поставлен 95 821 пациенту.
Отдельной статистике подвергается артропатический псориаз: на 2019 г. зарегистрированы всего 20 883 больных, 14,2 случая на 100 тыс. населения страны, из них 3221 пациенту диагноз поставлен впервые в жизни (2,2 случая на 100 тыс. населения).
Псориаз встречается во всех возрастных группах, но наибольшее число пациентов – в возрасте от 20 до 50 лет. Дети и пожилые пациенты хоть и в меньшей степени, но подвержены этому заболеванию и в данных группах пациентов сложнее подобрать лекарственную терапию [2, 3].
Прорыв в изучении иммунопатогенеза псориаза привел к признанию его заболеванием, имеющим серьезные последствия для здоровья, выходящие за пределы кожи. Патофизиология псориаза включает воспалительные медиаторы, такие как фактор некроза опухоли-α (ФНО-α), интерферон-α (ИФН-α) и ИФН-γ, интерлейкин-1β (ИЛ-1β), -6, -12, -17A, -17F, -22 и -23 из различных иммунных клеток, в первую очередь Т-хелперов типа 1 и Т-хелперов типа 17 (Th17), а также кератиноцитов, других Т-клеток и дендритных клеток [4].
Точные причины развития коморбидных заболеваний у пациентов с псориазом не установлены, однако общие пути развития системного воспаления, иммунные нарушения, общие факторы риска, генетическая предрасположенность играют важную роль.
Артрит давно известен как одно из самых частых сопутствующих заболеваний при псориазе, однако пациенты с псориатической болезнью подлежат комплексному медицинскому обследованию, т.к. входят в группы риска по развитию сердечно-сосудистых (нарушения ритма, инфаркт миокарда, инсульт) и метаболических заболеваний (сахарный диабет [СД], атеросклероз, дислипидемия, ожирение), патологии со стороны желудочно-кишечного тракта и почек, злокачественных новообразований (в т.ч. кожи), инфекций, психических расстройств (тревожность, депрессия), неврологических заболеваний (рассеянный склероз, мигрень), болезней легких (хроническая обструктивная болезнь легких [ХОБЛ]) и глаз (увеит).
В связи с этим следует отметить, что своевременное начало лечения псориаза системными препаратами, в частности применение генно-инженерной биологической терапии (ГИБТ), дает лучший прогноз в отношении развития коморбидных состояний, значительно снижаются риски развития атеросклероза, СД, сердечно-сосудистых осложнений, угрожающих жизни. И несомненно, «чистая», свободная от псориатических высыпаний кожа положительно влияет на психоэмоциональное состояние пациента [4, 5].
Особенности коморбидных состояний пациентов с псориазом
Рассмотрим некоторые особенности коморбидных состояний пациентов с псориатической болезнью.
В ряде систематических обзоров и мета-анализов, оценивающих связь между псориазом и основными нежелательными сердечно-сосудистыми событиями (Armstrong et al., Gaeta et al., Gu et al., Horreau et al., Horreau et al., Miller et al., Pietrzak et al., Samarasekera et al., Xu et al., 2012–2013) установлено, что псориаз может быть независимым фактором риска развития сердечно-сосудистых заболеваний (ССЗ) и СД, причем риск развития серьезных сердечно-сосудистых осложнений (MACE – major adverse cardiovascular events) в виде инфаркта миокарда, инсульта, атеросклероза выше у пациентов с тяжелым течением псориаза. Вероятно, данные состояния могут быть обусловлены системным, хроническим Т-клеточным воспалением. Риски развития MACE повышаются у пациентов с отягощенным семейным анамнезом по ССЗ. Однако оценка многих полигеномных исследований показывает, что гены, связанные с развитием псориаза, полностью независимы и кардинально отличаются от генов, обусловливающих развитие таких заболеваний, как ишемическая болезнь сердца (ИБС) и метаболический синдром (МС). Только фактора системного воспаления как пускового механизма в развитии сердечно-сосудистых осложнений мало, причем при таком распространенном кожном заболевании, как атопический дерматит, который также обусловлен иммуноопосредованным воспалением, частота ССЗ ниже, чем в общей популяции.
Псориаз связан с многочисленными состояниями, которые сами по себе представляют основные факторы риска ССЗ (например, курение, ожирение). В 2017 г. J. Takeshita et al. обобщили доказательства ожирения, артериальной гипертензии (АГ), СД, дислипидемии и МС как сопутствующих заболеваний при псориазе, при этом МС по существу представляет собой комбинированное проявление ожирения, АГ, инсулинорезистентности и дислипидемии. У псориаза и коморбидных заболеваний могут быть общие локусы восприимчивости.
Также одним из аргументов в пользу того, что псориаз – это независимый фактор ССЗ, служит сходство между воспалительными процессами в псориатических и атеросклеротических бляшках, а именно резистентность к инсулину, эндотелиальная дисфункция, регуляция Т-лимфоцитами, вовлеченность в процесс нейтрофилов, моноцитов/макрофагов и тромбоцитов. Многочисленные исследования показали, что повышенные сывороточные уровни Th17-клеток и ассоциированных с ними провоспалительных цитокинов (ИЛ-17, -6 и -8) присутствуют при псориазе. Показано, что эти 3 цитокина и С-реактивный белок (СРБ) вызывают воспаление при нестабильной ИБС, включая нестабильную стенокардию и острый инфаркт миокарда, а ИЛ-17 и -6, наряду с ИЛ-1β и ФНО-α преимущественно экспрессируются в животных моделях стареющих коронарных артерий, восприимчивых к ишемии, ИЛ-8 и СРБ также были обнаружены в атеросклеротических бляшках [6, 7].
Понятие «псориатический марш» рассматривает псориаз как заболевание, сопровождающееся хроническим системным воспалением – центральным механизмом, лежащим в основе патофизиологии инсулинорезистентности (о чем свидетельствует повышенный HOMA-IR), висцерального ожирения, АГ, дислипидемии и эндотелиальной дисфункции, приводящей к снижению эластичности сосудов.
В результате ряд воспалительных процессов индуцирует развитие атеросклероза, который может приводить к инфаркту миокарда или инсульту [7].
В 2012 г. Flammer и Ruschitzka предложили теорию двух бляшек при одном синдроме. Профили цитокинов кожных поражений при псориазе и поражении сосудов при атеросклерозе очень похожи, схожесть отражается в повышенном числе лимфоцитов Th1 и Th17. Было показано, что пути цитокинов Th1 и Th17 участвуют в патогенезе как псориаза, так и атеросклероза. Сверхэкспрессия цитокинов Th17 у пациентов с псориазом может опосредовать сосудистое воспаление и развитие атеросклероза и сопутствующих ССЗ. Другие возможные механизмы включают общие генетические факторы, секрецию адипокинов, состав и функцию липопротеидов, ангиогенез, окислительный стресс, микрочастицы и гиперкоагуляцию. Выявленная мутация в инсулин-чувствительной пептидазе связывает псориаз с АГ и СД [7, 8].
Установлено, что МС чаще встречается у пациентов с псориазом, чем в общей популяции. По результатам исследования, проведенного Campos et al., в амбулаторной клинике специализированной больницы в João Pessoa/Paraiba обнаружили дислипидемию у 93%, АГ – у 46%, ожирение – у 40% и СД – у 33% исследованной выборки (пациенты с псориатическим артритом в возрасте от 30 до 74 лет без других хронических воспалительных заболеваний, наблюдаемые в отделении ревматологии) [8].
При анализе имеющихся крупных ретроспективных и проспективных когортных исследований и исследований типа «случай–контроль» с 1995 по 2018 г., проведенных в США, Великобритании, Бразилии, Италии, Франции, Испании, Таиланде, Чехии, Китае, Турции и Румынии, выявлена повышенная распространенность СД 2 типа (СД2) среди пациентов с псориатическим артритом по сравнению с фоновой популяцией, причем вероятность развития СД2 не коррелировала с тяжестью псориатического артрита и возрастом пациента. Распространенность СД2 среди пациентов с псориатическим артритом была на 7–11,7% выше по сравнению с контрольной группой.
Karoli et al. сравнили 96 пациентов с псориатическим артритом со 100 пациентами контрольной группы и обнаружили, что распространенность сопутствующих заболеваний, связанных с МС (СД2, гиперлипидемия и АГ), включая диагностику МС в целом, была значительно выше у пациентов с псориатическим артритом (40 против 22%). Можно сделать вывод: среди пациентов с псориатическим артритом важно проводить профилактические мероприятия в отношении МС, а также просветительскую работу среди пациентов данной группы с целью уменьшения факторов риска СД2 и МС в целом [8, 9].
Выявлена связь ожирения и хронического субклинического воспаления, которая проявляется в изменении синтеза адипокинов (например, уровень лептина повышается, а уровень адипонектина понижается). Эта дисрегуляция способствует тромбозу и поддерживает каскад воспалительных реакций, стимулируя синтез ФНО-α, СРБ, ИЛ-6, фибриногена и ингибитора активатора плазминогена-1. Жировая ткань также экспрессирует высокие уровни фактора роста эндотелия сосудов (VEGF), которые дополнительно поддерживаются циркулирующим ИЛ-17A при псориазе [9].
Также изучаются клеточные эффекты ИЛ-17 и других провоспалительных маркеров на уровне взаимодействия с рецепторами в печени, кишечнике, почках, сосудах с целью доказать эффективность ГИБТ для лечения или снижения риска развития коморбидных состояний пациентов с псориазом [10].
Однако профиль безопасности биологических препаратов для ССЗ все еще не ясен. Требуются длительные наблюдения за пациентами с псориазом, страдающими ССЗ [11].
В одном из крупных проспективных когортных исследований проведен сравнительный анализ рисков серьезных ССЗ для пациентов с хроническим бляшечным псориазом средней и тяжелой степенями, получавших ГИБТ разных групп. Исследование проведено с использованием данных BADBIR (British Association of Dermatologists Biologics and Immunomodulators Register). Проанализированы случаи 5468 пациентов, получавших лечение биологическими препаратами (951 – устекинумаб, 1313 – этанерцепт и 3204 – адалимумаб). Во вторичный анализ тоже были включены 2189 пациентов, получавших метотрексат. Срок наблюдения составил от 1,5 до 2,0 лет. В группах устекинумаба, ФНО-α, адалимумаба, этанерцепта и метотрексата были 7, 29, 23, 6 и 9 пациентов, у которых наблюдались серьезные ССЗ соответственно.
В целом не было обнаружено различий в риске серьезных ССЗ между этанерцептом, адалимумабом и устекинумабом для взрослых пациентов с умеренно-тяжелым бляшечным псориазом после кратко- и среднесрочного воздействия. Воздействие биологической терапии или метотрексата на риск серьезных ССЗ у пациентов с псориазом может проявляться дольше [12–14].
Цель настоящей работы: анализ спектра коморбидных заболеваний у пациентов с бляшечным распространенным псориазом средней и тяжелой степеней, которые получали ГИБТ препаратом секукинумаб, и у пациентов, получавших лечение метотрексатом, а также изучение динамики показателей клинического и биохимического анализов крови и СРБ у пациентов данных групп до начала лечения (за 1 год) и в течение 1-го года терапии, оценка влияния лечения различными препаратами (секукинумаб и метотрексат) на течение псориаза, коморбидных состояний и лабораторных показателей.
Собственные данные
Исследование проводилось на базе ФГБУ «Поликлиника № 1» УД Президента РФ в отделении дерматовенерологии и косметологии. Мы проанализировали истории болезней трех пациентов с установленным диагнозом «распространенный псориаз тяжелого течения», получавших терапию секукинумабом, и 2 пациентов, лечившихся метотрексатом. Все пациенты проходили лечение не менее года.
Всем пациентам установлен диагноз «распространенный бляшечный псориаз более 10 лет», однако за последние несколько лет все отмечали появление боли в суставах и было подтверждено псориатическое поражение суставов.
Пациент Г., мужчина 62 лет, страдает псориазом в течение 25 лет, в течение 10 лет беспокоят боли в суставах. Характер заболевания непрерывно рецидивирующий с тяжелым течением. Кожный процесс носит распространенный хронический воспалительный характер, представлен типичными псориатическим папулами и бляшками, расположенными на коже туловища, верхних и нижних конечностей, волосистой части головы, отмечаются поражение ногтевых пластин стоп и кистей, изменения по типу «масляного пятна» и «наперстка». Ранее пациент получал наружную гормональную терапию метотрексатом без выраженного эффекта. В связи с тяжелым течением псориаза, поражением суставов, неэффективностью базисной противовоспалительной терапии с декабря 2018 г. по настоящее время пациент получает лечение препаратом секукинумаб по стандартной схеме (300 мг в виде подкожной инъекции в качестве начальной дозы на 0-й, 1-й, 2-й, 3-й неделе с последующим ежемесячным введением в качестве поддерживающей дозы начиная с 4-й недели) с положительным эффектом. После 5-й инъекции отмечен регресс боли в суставах, псориатических высыпаний на коже туловища и конечностей, сохраняются высыпания в области паховых и подмышечных складок, на коже волосистой части головы и изменения ногтевых пластин стоп.
Пациент длительно наблюдается у терапевта, эндокринолога, гастроэнтеролога, ревматолога. Сопутствующие заболевания: ИБС: атеросклеротическая болезнь сердца, гипертоническая болезнь (ГБ) II стадии 2-й степени, риск очень высокий, гипертрофия левого желудочка, нарушение ритма и автоматизма сердца: повторные эпизоды сино-атриальной блокады без гемодинамически значимых пауз; одиночная желудочковая экстрасистолия. НК I, стенозирующий обструктивный билатеральный каротидный атеросклероз, инсулиннезависимый СД2 без осложнений, нетоксический узловой зоб до 1 см, ожирение 2-й ст., НПВС-гастропатия: эрозивный гастрит, эрозивный бульбит, ремиссия. Стеатогепатит умеренной степени активности, фиброз печени, хронический некалькулезный холецистит, ремиссия, дискинезия желчевыводящих путей, долихосигма, хронический поверхностный колит, МС, спондилоартрит с преимущественным поражением грудного отдела позвоночника, сакроилеит 2-й ст. ФН 1, подагра. Пациент получает соответствующую базисную терапию.
Оценивая динамику течения сопутствующих заболеваний с 2017 г. можно отметить, что ухудшение наблюдается преимущественно со стороны углеводного обмена (в 2017 г. – нарушение толерантности к глюкозе, в 2021 г. – инсулиннезависимый СД2 без осложнений) и состояния печени (с 2019 г. новый диагноз – фиброз печени). В феврале 2020 г. пациент перенес окклюзивный тромбоз поверхностной вены левой верхней конечности. Остальные состояния без выраженной отрицательной динамики.
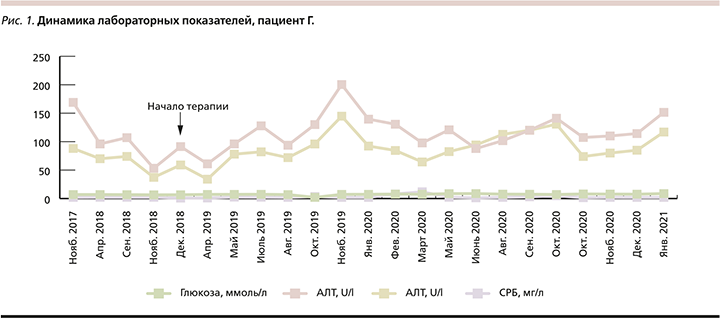
Лабораторные исследования. До лечения и на фоне терапии в общем анализе крови и мочи патологических изменений не наблюдалось. Особое внимание стоит уделить показателям, повышенным до начала лечения, – это глюкоза, аланинтрансаминаза (АЛТ), аспарагинтрансаминаза (АСТ), ẙглутамилтрансфераза (ГГТ) и СРБ. До лечения и во время первого года, когда пациент получал секукинумаб, уровень глюкозы в крови в среднем составлял 7,0 ммоль/л, далее отмечалось некоторое увеличение значений – максимально до 8,8 ммоль/л. Динамика данных показателей отражена на рис. 1.
Пациентка М. 61 года в течение 10 лет страдает распространенным бляшечным псориазом с поражением кожи кистей и стоп, волосистой части головы, кожи в области крупных суставов. Ногтевые пластины кистей изменены по дистрофическому типу. Около года беспокоят боли в суставах кистей. Ранее получала лечение топическим глюкокортикостероидными и противовоспалительными препаратами, препаратами с кальципотриолом с временным улучшением.
Пациентка регулярно наблюдается у терапевта, кардиолога, пульмонолога, эндокринолога, гастроэнтеролога. Сопутствующие заболевания: ИБС –атеросклеротический кардиосклероз. ГБ II ст., АГ 1-й ст., риск 3. Целомическая киста перикарда. НК 0. Нарушение толерантности к глюкозе. Хроническая ишемия головного мозга. Нетоксический многоузловой зоб до 1 см. ХОБЛ – хронический обструктивный бронхит, ремиссия. Бронхиальная астма, атопическая форма, контролируемая. Диффузная фиброзно-кистозная мастопатия. Грыжа пищеводного отверстия диафрагмы. Хронический гастродуоденит, ремиссия. Дискинезия желчевыводящих путей. Хронический бескалькулезный холецистит, ремиссия. Дивертикулярная болезнь толстой кишки. Полипы толстой кишки (удалены в анамнезе). Хронический геморрой, ремиссия. Миома матки. Варикозная болезнь нижних конечностей.
В связи с наличием таких коморбидностей псориаза, как ИБС (атеросклеротический кардиосклероз, ГБ, нарушение толерантности к глюкозе), а также с учетом поражения социально значимых участков кожи и поражения суставов была рекомендована терапия биологическим препаратом секукинумаб. Лечение начато в апреле 2019 г. по стандартной схеме (300 мг в виде подкожной инъекции в качестве начальной дозы на 0, 1, 2, 3-й неделе с последующим ежемесячным введением в качестве поддерживающей дозы, начиная с 4-й недели) и продолжается по настоящее время.
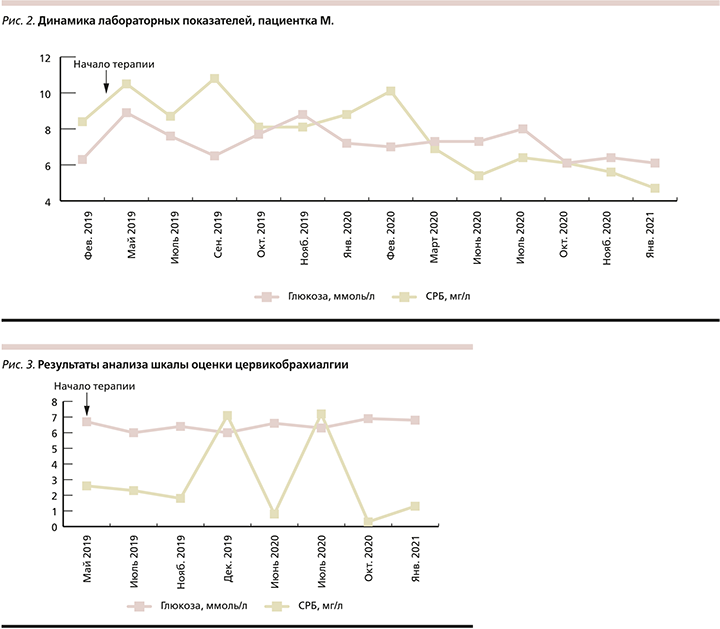
До и во время лечения секукинумабом пациентка находилась на лабораторном контроле. До лечения в клиническом анализе крови и мочи патологических изменений не наблюдалось, в биохимическом анализе крови можно было отметить стойкое повышение уровня общего холестерина (максимально до 6,7 ммоль/л), глюкозы (максимально до 7,2 ммоль/л), ГГ (до 54 U/L) и стабильное повышение уровня СРБ до 8,4 мг/л. Стоит отметить, что ГИБТ привела к незначительному повышению уровня печеночной АЛТ (максимально до 41 U/L) и уровня ГГТ (максимально до 60 U/L в первые 2 месяца лечения, далее уровень ГГТ снизился до исходных значений и отмечена тенденция к нормализации показателя). Уровень СРБ даже на фоне лечения сохранялся стабильно высоким (максимально до 10,8 мг/л), и лишь спустя год терапии отмечалась тенденция к его снижению (средний показатель – 5,0 мг/л). Отрицательного влияния на уровень холестерина ГИБТ не оказала. Спустя 1,5 года терапии уровень глюкозы в крови оставался на прежнем уровне по сравнению со значениями до начала лечения, однако в общем анализе мочи обнаружена глюкоза (максимально 112,3 ммоль/л). Динамика лабораторных показателей отражена на рис. 2.
Пациент Я. 61 года более 10 лет страдает распространенным вульгарным псориазом с поражением кожи туловища, конечностей, волосистой части головы, половых органов, складок, ногтевых пластин стоп и кистей; около 2 лет отмечает появление боли в межфаланговых суставах кистей. Из анамнеза: ранее получал наружную терапию топическими глюкокортикостероидами (ГКС) с временным улучшением, фототерапию (УФБ 311), неоднократно проходил курсы лечения эксимерным лазером Excilite µ без выраженного положительного эффекта, получал терапию препаратом метотрексат 7,5 мг в неделю в течение 2 недель. В связи с жалобами на плохую переносимость лечения препарат отменен, получил курс циклоспорина А с титрованием дозировки с 200 до 50 мг, на фоне лечения – ремиссия, однако после отмены препарата отмечено появление высыпаний в области кожи локтей и тыла кистей. В связи с данными анамнеза принято решение о проведении ГИБТ препаратом секукинумаб. Лечение начато в марте 2020 г. по стандартной схеме (300 мг в виде подкожной инъекции в качестве начальной дозы на 0-й, 1-й, 2-й, 3-й неделе с последующим ежемесячным введением в качестве поддерживающей дозы начиная с 4-й недели), получает терапию по настоящее время.
Пациент регулярно наблюдается у терапевта с диагнозами ГБ I стадии, 2-й степени, риск 3, дислипидемия, хроническая сердечная недостаточнсть 0, атеросклероз брахицефальных артерий без стенозирования; у эндокринолога – нарушение толерантности к глюкозе; у ревматолога – подагра, вторичный подагрический артрит правого коленного сустава; у уролога – мочекаменная болезнь, ремиссия, состояние после контактной уретеролитотрипсии и дистанционной ударно-волновой литотрипсии (апрель 2016 г.), хронический пиелонефрит, ремиссия, доброкачественная гиперплазия предстательной железы.
При анализе лабораторных показателей стоит обратить внимание на стойкое повышение уровня глюкозы в крови, среднее значение до лечения секукинумабом в течение первых 10 месяцев лечения не изменилось и составило в среднем 6,0 ммоль/л. Показатели клинического анализа крови и мочи, а также уровни АЛТ и АСТ оставались в пределах нормы. До лечения у пациента эпизодически отмечено повышение уровня мочевой кислоты даже при терапии аллопуринолом (максимально до 545,8 мкмоль/л) и креатинина (максимально до 480 мкмоль/л), а во время лечения секукинумабом уровень этих показателей оставался в пределах референсных значений. Среднее значение СРБ (до лечения секукинумабом 2,98 мг/л) на фоне терапии секукинумабом снизилось до 0,8 мг/л. Динамика лабораторных показателей отражена на рис. 3.
Пациентка Г. 66 лет страдает распространенным вульгарным псориазом около 15 лет. Ранее получала наружную противовоспалительную терапию, с 2013 по 2015 г. – терапию ГИБП бродалумабом с положительным эффектом со стороны кожных покровов.
В 2015 г. была переведена на препарат секукинумаб. Однако в связи с развитием язвенного колита данная терапия отменена и дальнейшего системного лечения псориаза не получала. С 2016 г. отмечает периодические рецидивы со стороны кожного покрова, в последнее время с тенденцией к сокращению межрецидивных промежутков и увеличению длительности обострений. С учетом сопутствующей патологии с февраля 2020 г. пациентка получает лечение препаратом метотрексат в дозировке 10 мг п/к 1 раз в неделю и наружную терапию в виде топических ГКС и эмолентов с положительным эффектом, достижение PASI 75 спустя 10 месяцев терапии.
Сопутствующие заболевания – ИБС, стенокардия напряжения ФК I, ГБ II ст., АГ ст. 2., риск 3. Хронический простой бронхит, ремиссия. Нарушение толерантности к глюкозе. Метаболический синдром. Дискинезия сфинктера Одди по панкреатическом типу. Язвенный колит, тотальный вариант с преимущественной локализацией в правых отделах кишечника без явлений мальабсорции, нестойкая ремиссия. Хронический гастрит с эрозиями в анамнезе, ремиссия. Гастроэзофагеальная рефлюксная болезнь: эрозивный эзофагит, нестойкая ремиссия. Жировая неалкогольная болезнь печени минимальной активности.
Лабораторный контроль показал отсутствие патологических изменений в клиническом анализе крови и мочи. Уровень печеночных ферментов, глюкозы крови до лечения (за 1 год) и в течение 1 года терапии метотрексатом без отрицательной динамики. На фоне обострения псориаза в январе и феврале 2020 г. до начала системной терапии уровень СРБ составил 14,5 мг/л, в дальнейшем к сентябрю 2020 г. он снизился до 5,3 мг/л. Таким обоазом, со стороны желудочно-кишечного тракта ухудшений за год терапии не выявлено.
Пациент Л. 74 лет болен ладонно-подошвенным псориазом с 2012 г.
Получал наружную терапию топическими противовоспалительными препаратами без выраженного положительного эффекта. В связи с прогрессирующей формой заболевания, отсутствием стойкого улучшения на фоне наружной терапии назначен препарат метотрексат, который пациент получал с октября 2017 г. в дозировке 10 мг в неделю, а с декабря 2020 г. дозировка снижена до 5 мг 1 раз в 7 дней. Обострения со стороны кожного процесса нет.
Сопутствующие заболевания: ИБС, атеросклеротический кардиосклероз с ГБ 2-й ст., АГ 1–2 ст., риск 4.
Хронический обструктивный бронхит, ремиссия. Хронический некалькулезный холецистит, ремиссия. Доброкачественная гиперплазия предстательной железы. Хронический простатит в стадии ремиссии. Кисты левой почки. Дивертикулез толстой кишки. Хронический геморрой, ремиссия. Хроническая недостаточность мозгового кровообращения в вертебро-базилярном бассейне, компенсация. Бронхиальная астма смешанного генеза, гормонозависимая форма среднетяжелого течения.
Лабораторный контроль проведен в соответствии с требованиями, предъявляемыми при лечении метотрексатом. Пациент хорошо переносит лечение, что выражается в хорошем ответе на терапию и отсутствии патологии со стороны показателей клинического и биохимического анализов крови и клинического анализа мочи.
Заключение
Анализируя истории болезней пациентов с псориазом среднего и тяжелого течения, мы отметили, что у всех была выявлена патология сердечно-сосудистой системы (ИБС, ГБ, атеросклероз, нарушение углеводного – нарушение толерантности к глюкозе или СД и/или жирового обмена – ожирение, дислипидемия, МС, жировая дистрофия печени), также частым спутником стали заболевания желудочно-кишечного тракта (нередко ятрогенного характера, например, при частом приеме нестероидных противовоспалительных средств при болях в суставах, как и осложнение терапии ГИБП). Серьезных сердечно-сосудистых осложнений (инфаркта миокарда и инсульта) не выявлено ни у одного из пациентов, получавших секукинумаб, был диагностирован окклюзивный тромбоз поверхностной вены левой верхней конечности. Уровень СРБ повышался у пациентов в период обострения псориаза и имел тенденцию к снижению на фоне системной терапии как секукинумабом, так и метотрексатом. Большинство пациентов хорошо переносили лечение, и патологические изменения лабораторных показателей не требовали отмены терапии.
Таким образом, можно сделать вывод: подход к выбору терапии пациентов с псориазом должен быть всегда индивидуальным, важен полидисциплинарный подход к обследованию пациентов с целью раннего выявления сопутствующей коморбидной патологии и возможных осложнений.


