Введение
До 2030 г., по мнению ВОЗ, стоит глобальная задача по преодолению туберкулеза [1]. Она существенно осложняется широким спектром побочных реакций (ПР) противотуберкулезных препаратов (ПТП), лимитирующих процесс лечения. Терапия в случае туберкулеза с множественной лекарственной устойчивостью может продолжаться 24 месяца, а наиболее частые ПР затрагивают функции важнейших систем жизнеобеспечения человека [2–4]. Наряду с видимыми осложнениями и ПР могут быть и отсроченные последствия, такие как эмбрио- и фетотокисческое действия препарата. Принимая во внимание актуальность разработки новых ПТП отечественного производства, в настоящем исследовании поставлена цель изучения токсического влияния на плод и эмбрион в эксперименте на крысах нового ПТП группы диарилхинолинов с рабочим названием «тиозонид» (производитель АО «Фарм-Синтез»). Лекарственное средство по химической структуре представляет собой -{1R,2S+1S,2R}-1-(6-Бром-2-хлорхинолил-3-ил)-4-(диметиламино)-2-(нафталин-1-ил)-1-фенилбутан-2-ол [5]. Этот препарат продемонстрировал специфическую противотуберкулезную активность как в in vitro, так и in vivo в экспериментальных исследованиях на животных. На модели генерализованного туберкулеза у мышей показано, что показатели КОЕ микобактерий туберкулеза в легких мышей при монотерапии тиозонидом сравнимы с таковыми при монотерапии рифампицином в аналогичной дозе. Показано также, что имеет место синергизм действия с ПТП 1-го ряда изониазидом, рифампицином и этамбутолом, в частности, совместная терапия тиозонидом с изониазидом или рифампицином приводит практически к полному выздоровлению подопытных животных, что было доказано бактериологически и гистологически [6].
Цель исследования: изучение в эксперименте на крысах токсического влияния на плод и эмбрион нового противотуберкулезного препарата группы диарилхинолинов с рабочим названием «тиозонид».
Методы
Опыты по изучению влияния тиозонида на эмбриональное развитие (регистрация на 20-й день беременности) проведены на 30 беременных белых беспородных крысах с исходной массой 220–250 г. Первым днем беременности считали день обнаружения сперматозоидов в вагинальных мазках самок, подсаженных накануне к самцам в соотношении 2:1. Тиозонид вводили в 1%-ном крахмальном растворе внутрижелудочно с помощью желудочного зонда с 1-го по 19-й день беременности в дозах 10 и 100 мг/кг. Контрольным животным в те же сроки беременности вводили внутрижелудочно растворитель – 1%-ный крахмальный раствор. Во время опыта следили за общим состоянием и поведением животных. Крыс взвешивали на 1-й, 7, 14 и 20-й дни беременности. Эвтаназию животных осуществляли на 20-й день беременности. Плоды взвешивали, измеряли их кранио-каудальный размер. Определяли пол плодов и подвергали их макроскопическому осмотру на предмет выявления видимых аномалий развития. Затем часть плодов фиксировали в растворе Буэна для изучения состояния внутренних органов на серийных срезах через плод (метод Вильсона в модификации А.П. Дыбана). Другую часть плодов фиксировали в 96%-ном этиловом спирте и окрашивали по методу Доусона для выявления дефектов скелета. Подсчитывали число точек окостенения различных костей скелета (череп, конечности, ребра, грудина, кости таза, позвоночник).
Изучение антенатального влияния тиозонида на постнатальное развитие животных проводили в опытах на 20 белых беспородных крысах, по 10 животных в группе. Препарат вводили внутрижелудочно с 6-го дня беременности до родов в дозе 100 мг/кг. Контрольным животным в те же сроки беременности вводили растворитель – 1%-ный крахмальный раствор. Во время опыта следили за общим состоянием и поведением самок и взвешивали их на 1-й, 6, 14 и 20-й дни беременности. Регистрировали день родов, число крысят в помете и распределение их по полу.
Показатели постнатального развития:
1. Динамика массы крысят (взвешивание на 5-й, 15, 30, 45 и 60-й дни жизни);
2. Физическое развитие крысят (сроки отлипания ушной раковины, обрастания шерстью, прорезывания резцов, открытия глаз, открытия вагины, опускания яичек);
3. Становление двигательной активности (тест «горизонтальная веревочка»);
4. Формирование сенсорно-двигательных рефлексов (рефлексы переворачивания на плоскости и избегания края);
5. Поведение в условиях «открытого поля» (регистрация горизонтальной и вертикальной двигательной активности, исследовательской и эмоциональной реакций, груминга) [7].
Полученные данные подвергались статистической обработке при помощи программы STATISTICA 6.0 for Windows. Количественные показатели были представлены в виде М±SЕ, где М – среднее значение, SЕ – стандартная ошибка среднего. Для проверки различий качественных показателей использовали непараметрический критерий Манна–Уитни (попарные сравнения несвязанных совокупностей данных), если достигнутый уровень значимости различий не превышал 0,05, их считали достоверными [8].
Результаты
В ходе проведенных исследований эмбрио- и фетотоксического действий тиозонида установлено, что препарат при введении зондом внутрь в дозах 10 и 100 мг/кг существенно не изменял общего состояния и поведения животных. При введении препарата в изучаемых дозах прирост массы крыс в различные сроки беременности, соответственно, общий прирост массы беременных крыс с 1-го по 20-й день беременности не отличались от контрольных значений (табл. 1).

При внутрижелудочном введении препарата тиозонид в дозе 10 мг/кг отмечалось некоторое увеличение показателей эмбриональной гибели (табл. 2). Однако выявленная гибель находилась в пределах колебаний аналогичного показателя контрольной группы (р>0,05). В дозе 100 мг/кг такого эффекта не наблюдалось. Масса тела и размер плодов, подвергнутых антенатальному воздействию тиозонидом в дозах 10 и 100 мг/кг, были близкими к контрольным значениям (р>0,05).
При наружном макроскопическом осмотре у некоторых плодов наблюдались кровоизлияния в подкожную клетчатку: у 7,8% плодов в контроле, в опытных группах у 7,4% (10 мг/кг) и у 5,8% (100 мг/кг), гематомы, соответственно, у 9,8, 6,2 и 9,2% плодов, гиперемия кожных покровов у 14,4; 12,3 и 7,5%. Разница по сравнению с контролем во всех случаях оказалась статистически недостоверной (р>0,05).
При изучении состояния внутренних органов и костной системы у плодов контрольной группы и плодов, подвергшихся действию тиозонида, не выявлено значимых различий в развитии. Обнаруженное число кровоизлияний в малый таз и грудную полость не различалось в группах животных: у 5 из 68 плодов в контроле, у 4 из 42 плодов, подвергшихся антенатальному воздействию тиозонида в дозе 10 мг/кг (р=0,76) и у 5 из 51 плода, получившего антенатальное воздействие тиозонида в дозе 100 мг/кг (р=0,71).
Поскольку при введении лекарственных средств во время беременности отрицательное влияние может проявляться не только в гибели и уродствах эмбрионов, но и в отклонениях развития, наблюдаемых в постнатальном периоде, нами поставлены эксперименты по изучению возможности неблагоприятного антенатального воздействия потенциальных лекарств на развитие потомства.
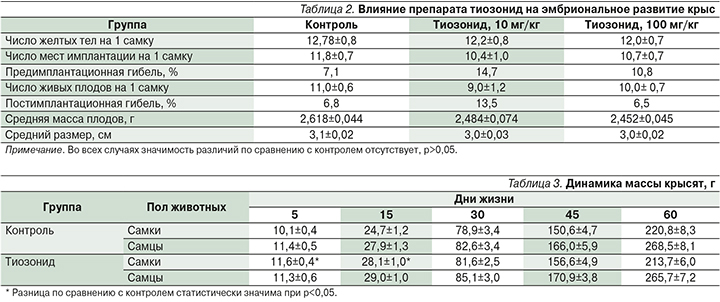
В результате проведенных исследований установлено, что самки потомства, подвергнутого антенатальному воздействию тиозонида, на 5-й и 15-й дни жизни весили несколько больше контрольных (табл. 3), в дальнейшем показатели массы тела перестали отличаться от контроля. Показатели массы самцов во все сроки наблюдения соответствовали контрольным величинам.
По признакам физического развития подопытные крысята не отличались от контрольных. Так, независимо от групповой принадлежности отлипание ушной раковины у крысят наступало на 2–3-й день жизни, обрастание шерстью – на 9-й, прорезывание резцов – на 8–9-й, открытие глаз – на 15–18-й день жизни. Опускание яичек у самцов происходило на 26–28-й день жизни; открытие вагины у самок заканчивалось на 43-й день жизни.
Известно, что в норме к 5-му дню жизни крысята еще не держат голову, движения их носят хаотический характер, отсутствует целенаправленная двигательная активность. В то же время у крысят уже четко выражены такие безусловные рефлексы, как переворачивание на плоскости и избегание края. На 5-й день жизни крысята были подвергнуты испытаниям в тесте удерживания на горизонтальной веревочке. В те же сроки жизни определяли наличие безусловных рефлексов переворачивания на плоскости и избегания края. Поставленные опыты позволили в ходе регистрации времени этих реакций составить представление о мышечной силе и локомоторной координации крысят. В ходе опыта установлено, что рефлексы переворачивания на плоскости и избегания края на 5-й день жизни сформированы у всех подопытных и контрольных крысят и соответствуют физиологической норме (табл. 4).

В тесте изучения поведения в «открытом поле» установлено, что крысы перемещаются в основном по периферии поля (табл. 5). Горизонтальная двигательная активность подопытных самок крысят была снижена по сравнению с контролем за счет меньшей активности в центре поля. Вертикальная двигательная активность была снижена у самцов потомства. Разница по сравнению с контролем имела уровень значимости р=0,05. По остальным регистрируемым показателям – груминг, исследовательская и эмоциональная реакции – различий в поведении подопытных и контрольных крысят установлено не было.
Обсуждение результатов
Безопасность лекарств для беременной женщины – тема с продолжительной историей. Она вошла в практику врачей с использованием ацетаминофена, вальпроевой кислоты и ретиноидов, породив дискуссии о соотношении риска и пользы от применения лекарственных веществ, а также шансах развития неблагоприятных клинических последствий во время беременности [9]. С развитием оценки глобального влияния лекарственных препаратов стали появляться работы, в которых исследователи поднимают вопросы о влиянии экологически значимых концентраций лекарств на виды природных сред обитания.
В частности, показано, что тетрациклин в экологически значимых концентрациях способен вызывать эмбриотоксические и тератогенные эффекты, создавая риск для целостности карпа обыкновенного C. сarpio [10].
Безопасности ПТП уделяется внимание по мере регистрации новых средств этой группы. В частности, в 2010 г. всесторонне освещались ПР нового производного рифамцинина, 3-(4-циннамилпиперазинилиминометил) рифамицина и его натриевой соли (рифацинны). Было показано, что это ПТП сочетает низкую токсичность, отсутствие тератогенного и эмбриотоксического действия с более высокой терапевтической эффективностью, нежели рифампицин, у пациентов с инфильтративной, диссеминированной и полостной формами туберкулеза легких [11]. Группа диарлхинолинов представляется перспективной в качестве источника ПТП, поскольку из трех новых средств, выведенных на рынок в последнее время (бедаквилин, деламанид, претоманид), бедаквилин служит представителем этой группы. Выявлены данные, предполагающие безопасным его назначение в 3-м триместре беременности. Описан случай, когда женщина, больная туберкулезом с множественной лекарственной устойчивостью возбудителя, лечившаяся по схеме, включившей бедаквилин, в течение последних 3 недель беременности родила ребенка без отклонений от нормы. Через 2 года после родов не было выявлено признаков токсического действия препарата на плод [12].
Выводы
В связи с полученными нами данными экспериментального исследования нового ПТП тиозонид резонно предполагать его безопасное применение в схемах длительной терапии. Показанное отсутствие эмбрио- и фетотоксического эффектов позволяют ожидать безопасного применения нового препарата у людей.



