Введение
Сахарный диабет (СД) – одна из самых распространенных эндокринных патологий. Более 450 млн человек во всем мире страдают СД 2 типа (СД2), и их число прогрессивно увеличивается. Тяжелым осложнением СД является диабетическая нейропатия, приводящая к ранней смертности и инвалидизации больных.
Так, известно, что кардиоваскулярная автономная нейропатия (КАН) служит независимым фактором риска тяжелой кардиальной патологии и случаев смерти [1]. Исследования последних лет продемонстрировали увеличение риска безболевого инфаркта миокарда и внезапной смерти более чем в 2 раза у больных КАН и СД по сравнению с СД без нейропатии. Однако по крайней мера ранние стадии кардиоваскулярной дисфункции имеют функциональный характер и могут быть обратимыми [2].
С другой стороны, сенсомоторная нейропатия на своих поздних стадиях служит причиной синдрома диабетической стопы (СДС) и ампутации нижних конечностей у больных СД в 80–85% случаев [3]. Таким образом, ранняя диагностика и профилактика диабетической нейропатии позволяют предотвращать развитие тяжелой кардиоваскулярной патологии и хронических осложнений СД [4].
В то же время, по данным ряда исследований и мета-анализов, СД2 ассоциирован с низким уровнем общего тестостерона в сыворотке крови [5]. Гипогонадизм у мужчин – один из самых распространенных эндокринных синдромов. Диагностика основывается на клинических признаках и симптомах, а также на лабораторных данных (уровень общего тестостерона в утренние часы менее 12 нмоль/л) [6, 7]. С возрастом многие мужчины страдают от снижения продукции тестостерона. Около 15–25% мужчин старше 50 лет имеют уровень тестостерона значительно ниже нормальных значений для пациентов 20–40 лет [8, 9]. Кроме того, мужчины 45 лет и старше с низким уровнем тестостерона более чем в 2 раза чаще страдают ожирением, СД2, артериальной гипертензией по сравнению со своими сверстниками [10–13]. Гипогонадизм у мужчин ассоциирован с кардиоваскулярной патологией, общей и кардиоваскулярной смертностью в возрасте старше 50 лет [14, 15].
Таким образом, применяя вышеуказанные критерии, процент больных СД2 и гипогонадизмом достигает 50% [16, 17]. Однако гипогонадизм и эректильная дисфункция (ЭД) зачастую остаются недиагностированными осложнениями СД2. Исследование MMAS (the Massachusetts Male Aging Study) продемонстрировало, что более 75% мужчин с СД имеют или будут иметь в течение жизни ЭД [5]. Исследования последних лет подтвердили, что у больных СД ЭД является предиктором острой сердечно-сосудистой патологии благодаря своей связи с КАН. Таким образом, низкий уровень тестостерона, ЭД и кардиоваскулярная патология тесно взаимосвязаны у больных СД2 [7, 18].
Множество исследований продемонстрировали связь заместительной терапии тестостероном (ЗТТ) с нормализацией уровня глюкозы в крови, дислипидемии, суррогатных маркеров атеросклероза, а также с уменьшением объема талии, инсулинорезистентности, ожирения у мужчин с гипогонадизмом [11, 12, 19]. Однако данные о влиянии ЗТТ на хронические осложнения СД крайне ограничены [15, 18].
Цель исследования: оценить влияние ЗТТ на течение диабетической полинейропатии у мужчин с СДС в анамнезе и возрастным гипогонадизмом.
Методы
В исследование были включены 49 мужчин с СД2 и СДС в анамнезе, по поводу которого больные ранее получали оперативное лечение, в т.ч. ампутацию на уровне стоп. Все пациенты подписали информированное согласие до включения в исследование, одобренное локальным этическим комитетом. Критериями исключения служили противопоказания к ЗТТ (полицитемия, высокий риск рака простаты), а также ишемия нижних конечностей, диагностируемая при снижении лодыжечно-плечевого индекса менее 0,9.
Оценивались антропометрические показатели, включая рост, вес, соотношение объема талии к объему бедер, а также лабораторные показатели, такие как гликированный гемоглобин, липидный спектр сыворотки крови. Уровень общего тестостерона в начале исследования колебался от 1,3 до 12 нмоль/л и во всех случаях был ниже 12 нмоль/л.
Жалобы пациентов на онемение, покалывание, жжение и боли в стопах оценивали с помощью шкалы общего симптоматического счета (ОСС). Для определения тяжести сенсомоторной нейропатии применяли комбинированную шкалу нейропатического дисфункционального счета (НДС), которая хорошо коррелирует с результатами электронейромиографического исследования периферических нервов и включает оценку как сухожильных рефлексов, так и болевой, тактильной, температурной и вибрационной чувствительности.
Для оценки КАН выполнялся ряд функциональных тестов: тест с глубоким дыханием, 30:15-тест, маневр Вальсальва, проба с пассивным ортостазом, проба с динамометром. Артериальный барорефлекс определялся кросс-корреляционным методом. В соответствии с последними рекомендациями КАН диагностировалась как функциональная (ранние изменения) в случаях одного патологического теста, как подтвержденная, если два и более тестов изменены, и как тяжелая при симптоматической и/или бессимптомной ортостатической гипотензии.
Все включенные в исследование больные были поделены на две группы: первая (25 пациентов) получала ЗТТ (Омнандрен-250, 250 мг в/м 1 раз в неделю), пациенты второй группы (24 человека) получали плацебо.
Все обследования проводились исходно и после 6 месяцев терапии.
Для статистического анализа применялся пакет программ Statistica v.10. Для сравнения переменных использовались Манн–Уитни-тест, тест Фишера с поправкой Йоте. Результаты представлены как средняя±ошибка средней. Значимыми считались отклонения при р<0,05.
Результаты
Исходные характеристики пациентов представлены в табл. 1.
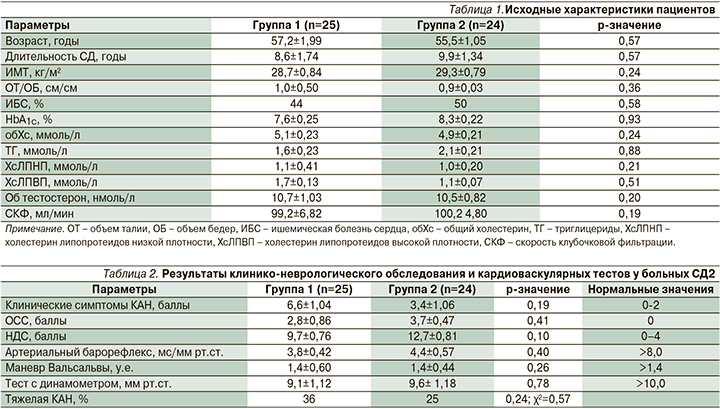
Пациенты обеих групп были сопоставимыми по возрасту, длительности СД, антропометрическим и лабораторным параметрам. Уровень гликированного гемоглобина составлял 7,6±0,25 и 8,3±0,22% соответственно (р=0,93).
В ходе клинико-неврологического исследования умеренная или выраженная нейропатия диагностирована у всех пациентов (табл. 2).
КАН и значительное снижение артериального барорефлекса также выявлены во всех случаях. Тяжелая КАН диагностирована в обеих группах с сопоставимой частотой (36 и 25% соответственно; χ²=0,57; р=0,24).
Спустя 6 месяцев лечения только пациенты группы 1 (получавшие ЗТТ) отметили облегчение симптомов гипогонадизма и улучшение качества жизни. В этой группе уровень общего тестостерона сыворотки крови значительно возрос по сравнению с группой 2 (группа плацебо; 21,9±3,45 и 9,8±2,45 нмоль/л соответственно; р<0,05).
Однако значимых изменений ИМТ, соотношения объема талии к объему бедер, а также уровней гликированного гемоглобина и липидного спектра крови не наблюдалось в обеих группах (рис. 1, 2).
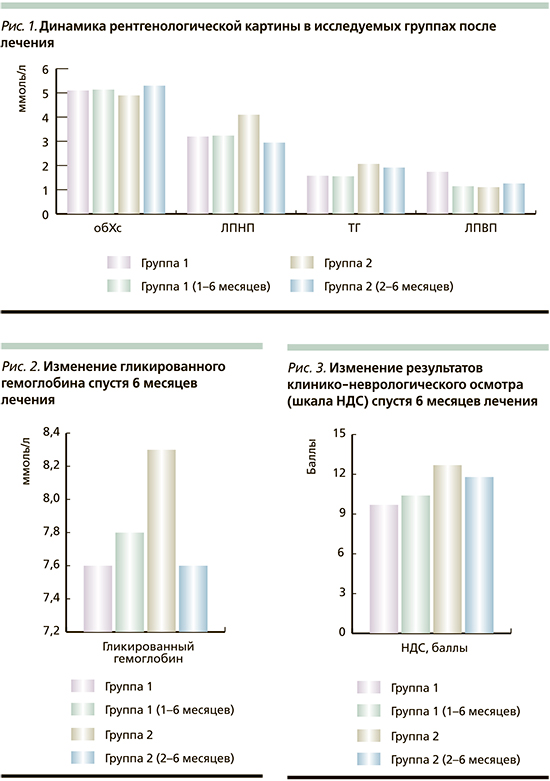
Кроме того, не зарегистрировано значимых изменений результатов клинико-неврологического осмотра под влиянием ЗТТ (рис. 3).
Однако в то же время нами выявлены значительные изменения некоторых параметров сердечно-сосудистой иннервации. Так, ЗТТ привела к восстановлению периферической вазоконстрикции на холодовой стимул (22,9±3,11 и 28,5±2,39% исходно и спустя 6 месяцев лечения соответственно, р=0,029). Кроме того, зарегистрировано возрастание прироста артериального давления во время пробы с динамометром (9,1±1,12 и 10,4±1,48 мм рт.ст. исходно и через 6 месяцев лечения соответственно, р=0,04).
Вместе с тем значимых изменений параметров маневра Вальсальвы и артериального барорефлекса под влиянием лечения не наблюдалось.
Таким образом, ЗТТ привела к восстановлению нормальной реакции на пробу с пассивным ортостазом и значимому снижению числа случаев тяжелой КАН (табл. 3).
В то же время в группе больных, получавших плацебо (группа 2), зарегистрировано увеличение числа случае бессимптомной ортостатической гипотензии (табл. 3).
Нами не было выявлено тяжелых нежелательных явлений на протяжении 6 месяцев ЗТТ.
Обсуждение
ЗТТ применяется для лечения мужского гипогонадизма более 60 лет.
К благоприятным эффектам ЗТТ относятся улучшение сексуальной функции, качества жизни, снижение жировой массы, возрастание мышечной и костной массы тела.
Существует множество фармакологических препаратов для лечения мужского гипогонадизма. Наряду с трансдермальными формами и внутримышечными инъекциями пролонгированного тестостерона ундеконата широко используются инъекции тестостерона ципионата (1 или 2 раза в неделю) благодаря экономической выгоде и хорошей переносимости [7].
ЗТТ не только облегчает симптомы низкого уровня тестостерона, но и устраняет последствия темной стороны его дефицита, такие как инсулинорезистентность, гипергликемия, артериальная гипертензия, дислипидемия и атеросклероз [17, 20]. Пожилые мужчины с СД2 часто страдают гипогонадизмом, и нормализация уровня тестостерона может улучшать метаболический контроль, помогать избегать поздних осложнений диабета. Так, мужчины с СД имеют более низкий уровень тестостерона по сравнению со своими сверстникам, причем уровень общего тестостерона сыворотки крови обратно пропорционален гликированному гемолобину [21, 22]. ЗТТ больных СД2 снижает висцеральное ожирение, инсулинорезистентность, улучшает метаболические параметры и эндотелиальную функцию, причем эти эффекты могут быть дозозависимыми. Исследования последних лет продемонстрировали улучшение чувствительности к инсулину, снижение жировой массы тела на фоне ЗТТ, а также связь с дозой тестостерона [23]. Для реализации эффекта ЗТТ на чувствительность к инсулину и тем более прямого воздействия на поджелудочную железу необходимо достичь скорее верхней границы нормального уровня тестостерона в крови, чем нижней [24].
В то же время G. Hackett et al. показали, что ответ мужчин с СД2 и гипогонадизмом на ЗТТ снижен в случае депрессии. В этом исследовании почти четверть (23%) пациентов с СД2 имели депрессию, а распространенность гипогонадизма достигала 50% [18]. Депрессия часто случается у больных СД, особенно с хроническими осложнениями.
Есть несколько возможных объяснений, почему в нашем исследовании не отмечалось какого-либо влияния ЗТТ на висцеральное ожирение и метаболические параметры мужчин с СД2 и гипогонадизмом. В то же время ЗТТ положительно повлияла на некоторые хронические осложнения СД. В течение 6 месяцев она привела к нормализации симпатической части кардиоваскулярной автономной нейропатии. В результате к концу лечения значительно уменьшилось число случаев ортостатической гипотензии и тяжелой КАН, что является весьма важным результатом, поскольку именно тяжелые формы КАН приводят к ранней инвалидизации и смертности этих пациентов.
Таким образом, мы продемонстрировали нейропротективный эффект ЗТТ, имеющий ряд возможных объяснений. КАН напрямую связана с чувствительностью к инсулину и ухудшается при инсулинорезистентности. Тестостерон непосредственно модулирует чувствительность к инсулину независимо от изменений жировой массы тела [25].
А. Неинфекционное воспаление играет ключевую роль в патогенезе нейропатии и микроангиопатии при СД. Этот процесс сопровождается повышением продукции воспалительных цитокинов (TNF-α) со снижением экспрессии ИЛ-2, -6 и -8 [26, 27]. Таким образом, активация воспалительных цитокинов ведет к повреждению как толстых миелинизированных, так и тонких немиелинизированных нервных волокон у больных СД. Показано, что андрогены ингибируют экспрессию провоспалительных цитокинов и хемокинов, что приводит к уменьшению воспаления [28].
Б. В патогенезе микроангиопатий при СД вовлечена также эндотелиальная функция, и ЗТТ может оказывать положительное воздействие именно через эндотелий, что и было продемонстрировано ранее в нескольких исследованиях [29].
Заключение
Данные о влиянии ЗТТ на хронические осложнения СД2 чрезвычайно ограничены [30]. В наше исследование были включены мужчины с СД2, периферической сенсомоторной нейропатией, операциями на стопах по поводу СДС в анамнезе и гипогонадизмом, страдавшие КАН, зачастую в тяжелой форме. Главным результатом был тот факт, что в этой группе тяжелых пациентов ЗТТ сопровождалась снижением выраженности КАН, регрессом даже ее тяжелых стадий. Однако каких-либо изменений в метаболических параметрах не наблюдалось.
Таким образом, ЗТТ может иметь дополнительное положительное влияние на микроциркуляторные осложнения у больных СД2 с гипогонадизмом независимо от параметров метаболического контроля и изменений жировой массы тела.


