Введение
В декабре 2019 г. в Китае в провинции Ухань была впервые зарегистрирована новая коронавирусная инфекция (COronaVIrus Disease 2019), вызывающая тяжелый острый респираторный дистресс-синдром. Международный комитет по таксономии вирусов 11 февраля 2020 г. присвоил официальное название возбудителю инфекции – SARS-CoV-2. Всемирной организацией здравоохранения к 29 октября 2020 г. зарегистрировано 44 351 506 подтвержденных во всем мире случаев COVID-19, включая 1 171 255 случаев со смертельным исходом. Уровень смертности от COVID-19 оценивается в 0,5–1,0% [1, 2]. В России общее число умерших с COVID-19 за апрель–декабрь 2020 г. – 162 249 человек [3].
SARS-CoV-2 представляет собой одноцепочечный (+)РНК-вирус, относящийся к роду Betacoronavirus семейства Coronaviridae. Вирионы всех коронавирусов имеют суперкапсид с большими шиповидными отростками в виде булав длиной 5–10 нм, формируемыми S-гликопротеинами. Их наличие, напоминающие зубцы короны, и дало название всему семейству. Предполагается, что новый возбудитель является рекомбинантным штаммом между коронавирусом летучих мышей и не известным по происхождению коронавирусом. Данное предположение основывается на том, что генетическая последовательность SARS-CoV-2 на 79% cходна с последовательностью SARS-CoV. Ввиду их близкого родства считается, что патогенетические механизмы развития инфекции у SARS-CoV и SARS-CoV-2 протекают по одному принципу [4, 5].
Основным путем распространения данного вируса среди людей является передача через вирусоносные респираторные капли, при этом, как правило, первые симптомы у заразившихся COVID-19 развиваются уже на 5–6-е сутки после заражения. К наиболее частым симптомам заболевания относятся стойкая лихорадка, общая и мышечная слабость, миалгии, сухой кашель с небольшим количеством мокроты. Реже наблюдаются симптомы со стороны желудочно-кишечного тракта (диспепсия, диарея) [1, 4, 5].
У лиц со сниженным иммунным ответом инфекционный процесс распространяется на альвеолы, что приводит к разрушению сурфактанта, избыточной экссудации и дальнейшему снижению дыхательной функции. При тяжелых формах болезни происходит замещение пораженных участков соединительной тканью с развитием фиброза легких [4, 5].
Патофизиология инфекции SARS-CoV-2
Внедрение в клетку коронавируса – это сложный процесс, который включает связывание рецептора и протеолиз, приводящий к слиянию вируса и клетки. В клетку человека проникновение SARS-CoV-2 происходит при помощи ангиотензин-превращающего фермента-2 (АПФ2), обладающего высокой аффинностью к S-гликопротеинам семейства коронавирусов (как SARS-CoV, так и SARS-CoV-2) [6]. АПФ2 экспрессируется в верхних дыхательных путях, в альвеолярном эпителии I и II типов, клетках легких, сердца, эндотелиальных клетках, эпителии канальцев почек, энтероцитах и в поджелудочной железе [7, 8]. После связывания с АПФ2 проксимальные сериновые протеазы, такие как TMPRSS2, участвуют в праймировании белка и расщеплении шипа. Протеазы впоследствии высвобождают спайк-гибридный пептид, и клеточный вирус проникает через эндосомный путь. Низкий уровень pH и наличие протеаз, таких как катепсин-L, характерных для эндосомального комплекса мембраны, способствуют доставке генома SARS-CoV-2 в цитозоль, где дальнейшая репликация вируса приводит к образованию зрелых вирионов и последующему распространению. Инфицированные клетки подвергаются апоптозу или некрозу и вызывают воспалительные реакции, сопровождающиеся активацией провоспалительных цитокинов или хемокинов, что приводит к увеличению числа воспалительных клеток. CD4+Т-хелперные (Th1) клетки регулируют процессинг и представление антигена, снижают иммунитет против внутриклеточных патогенов, таких как CoV, посредством выработки интерферона γ (ИФН-γ). Клетки Th17 индуцируют набор нейтрофилов и макрофагов, продуцируя интерлейкин-17 (ИЛ-17), -21 и -22 [9]. SARS-CoV-2 инфицирует циркулирующие иммунные клетки и увеличивает апоптоз лимфоцитов (CD3, CD4 и CD8 Т-клеток), приводящих к лимфоцитопении. В последующем степень лимфоцитопении обусловливает тяжелое течение инфекции SARS-CoV-2 [10]. Снижение функции Т-лимфоцитов приводит к подавлению врожденного иммунитета, образованию системы, приводящей к секреции массы воспалительных цитокинов во время т.н. цитокинового шторма [11]. При этом наблюдаются повышенные значения циркулирующих цитокинов/хемокинов (ИЛ-6, фактор некроза опухоли-α – ФНО-α), хемокинов (CXC-хемокиновый лиганд 10 – CXCL10) и CC-хемокиновый лиганд 2 (CCL2), участвующих в развитии цитокинового шторма, что в последующем играет немаловажную роль в реакции гипервоспаления, вызванной SARS-CoV-2, ведущей к полиорганной недостаточности [12, 13].
У пациентов с СД2 выявляются повышенные уровни циркулирующего фурина, клеточной протеазы, участвующей в облегчении проникновения вируса путем расщепления S1- и S2-доменов белка-шипа [14, 15]. Эти исследования подтверждают гипотезу, согласно которой пациенты с сахарным диабетом 2 типа (СД2) более восприимчивы к инфекции SARS-CoV-2 [15]. У пациентов с СД2 отмечаются более сниженный хемотаксис нейтрофилов, фагоцитоз и внутриклеточное уничтожение микробов, что приводит к позднему гипервоспалительному ответу [16].
Предикторы тяжелого течения COVID-19 у пациентов с СД
К группам риска тяжелого течения и высокой смертности по причине COVID-19 относятся прежде всего лица старше 65 лет и пациенты с хроническими заболеваниями [17].
В настоящее время хорошо известно, что пожилой возраст, наличие СД2, артериальной гипертензии (АГ) и морбидного ожирения (индекс массы тела ≥ 40 кг/м2) у пациентов с COVID-19 может приводить к тяжелым осложнениям [18]. С учетом высокой распространенности сердечно-сосудистых заболеваний (ССЗ), ожирения и АГ у пациентов с СД2 неизвестно, вносит ли СД2 независимый вклад в этот повышенный риск [19].
Склонность больных СД к более тяжелому течению болезни с большей частотой летальных исходов может быть объяснена особенностями взаимодействия вируса и его рецептора в условиях гипергликемии, особенностями иммунного ответа и состоянием здоровья больных СД в целом [20].
Возможные механизмы, которые могут повысить восприимчивость к COVID-19 пациентов с СД, включают: а) более высокое сродство связывания с клетками и быстрое проникновение вируса; б) снижение вирусного клиренса; в) снижение функции Т-клеток; г) повышенную восприимчивость к гипервоспалению и «цитокиновому шторму»; д) наличие ССЗ [21].
По последним данным, в моноцитах человека повышенный уровень глюкозы непосредственно увеличивает репликацию SARS-CoV-2, а гликолиз поддерживает репликацию SARS-CoV-2 за счет продукции митохондриальных активных форм кислорода (АФК) и активации фактора-1α (HIF1-α), индуцируемого гипоксией [21], что может способствовать распространению вируса. В соответствии с этим предположением гипергликемия или наличие в анамнезе СД2 оказались независимым предиктором высокой заболеваемости и смертности среди пациентов с SAR-CoV-2 [22].
Следует отметить, что ухудшение показателей гликемии является частым осложнением COVID-19 у пациентов с нарушением толерантности к глюкозе или СД. Предыдущие вирусные пандемии, вызванные SARS-CoV-1, MERS-CoV и H1N1, показали, что пациенты с СД и нерегулярным гликемическим контролем имели значительный риск осложнений [23]. На сегодняшний день число исследований, посвященных анализу предикторов тяжелого течения и смертности среди пациентов с СД и COVID-19, стратифицированных по уровню гликемии, крайне мало.
B. Bode et al. в своем исследовании показали более высокий процент смертности (41, против 14,8%; p<0,001) у пациентов с COVID-19 (n=184) и неконтролируемой гипергликемией (определяемой как >10 ммоль/л в течение любого 24-часового периода) без ранее диагностированного СД2 (гликированный гемоглобин – HbA1c<6,5%) по сравнению с пациентами с СД2 в анамнезе (HbA1c≥6,5%) [23]. Это свидетельствует о том, что «стрессовая» гипергликемия у пациентов может приводить к худшим исходам по сравнению с таковыми с ранее диагностированным СД2 и получающим сахароснижающую терапию. Однако эти результаты основаны на очень небольшом количестве когорт.
Многоцентровое ретроспективное исследование, проведенное в Китае, показало, что высокий уровень глюкозы натощак (≥7,0 ммоль/л) при поступлении был независимым фактором повышения смертности среди пациентов с COVID-19 без СД2 [24]. Поэтому целесообразно строго контролировать уровень глюкозы в крови и проводить интенсивное лечение стойкой гипергликемии у пациентов с прогрессирующим тяжелым течением COVID-19. У большинства пациентов с СД2, получающих инсулинотерапию, инфекция SARS-CoV протекает с быстро возрастающей потребностью в высоких дозах инсулина, часто превышающих 100 МЕ/сут. [25].
Большое ретроспективное исследование 810 пациентов с СД2, проведенное L. Zhu et al., продемонстрировало значительное увеличение процента таких осложнений, как септический шок (4,7 против 0,0%; p=0,004), острый респираторный дистресс-синдром (21,4 против 7,1%; p<0,001), острая почечная недостаточность (3,8 против 0,7%; p=0,019) и острый инфаркт миокарда (9,9 против 1,4%; p<0,001) у пациентов с плохо контролируемым диабетом (n=528) и уровнем глюкозы в крови натощак более 10,0 ммоль/л по сравнению с группой с удовлетворительным гликемическим контролем (n=282), у которых уровень глюкозы натощак в крови находился в пределах от 3,8 до 10 ммоль/л. В совокупности эти результаты свидетельствуют о том, что неконтролируемая гипергликемия (уровень глюкозы натощак в крови >10 ммоль/л) приводит к более высоким рискам тяжелого течения COVID-19 и значительному увеличению смертности среди больных СД2 или без него по сравнению с пациентами с целевыми показателями уровня глюкозы крови натощак менее 10 ммоль/л [26].
Известно, что кетоацидоз является частым осложнением СД1. Отмечено, что и у пациентов с СД2 на фоне инфицирования COVID-19 может развиваться кетоацидоз. Так, в одном из научных обзоров показано, что у 77% пациентов с COVID-19 и СД2 развился кетоацидоз [27].
Механизмы развития воспаления и инсулинорезистентности у пациентов с COVID-19 и СД2
Инфицирование SARS-CoV-2 приводит к повышению уровня медиаторов воспаления в крови, включая липополисахариды, воспалительные цитокины и токсичные метаболиты [28]. Модуляция активности естественных клеток-киллеров и продукция ИФН-γ увеличивают интерстициальную/сосудистую проницаемость для провоспалительных медиаторов [29]. Кроме того, заражение SARS-CoV-2 приводит к увеличению образования АФК [30], что способствует развитию фиброза легких, отеку легких и острому респираторному дистресс-синдрому [24]. На рис. 1 «молниями» указаны патогенетические механизмы, доминирующие у пациентов с СД2.
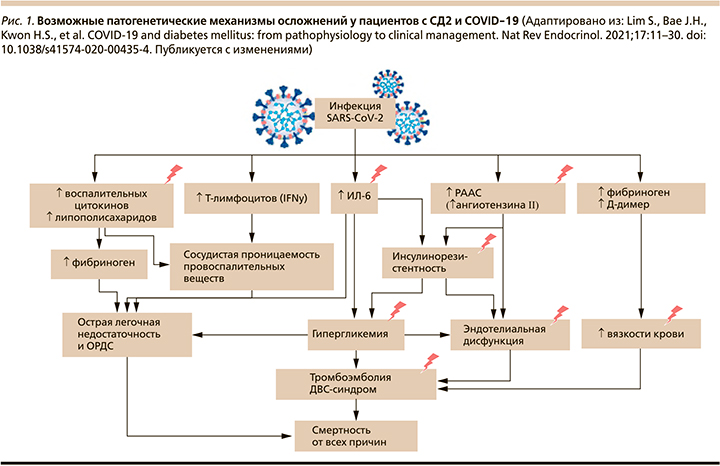
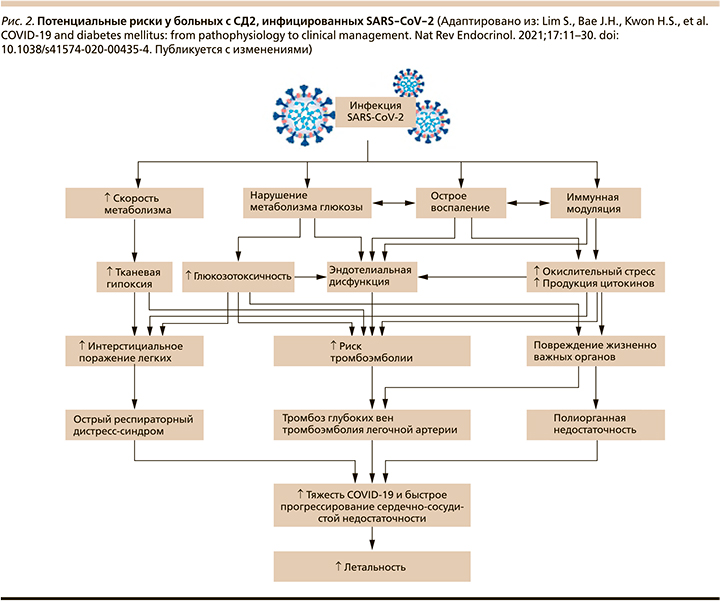
Продукция АФК и вирусная активация ренин-ангиотензин-альдостероновой системы (РААС) [31–33] (через повышенную экспрессию ангиотензина II) вызывают инсулинорезистентность [33], гипергликемию [34] и повреждение эндотелия сосудов, приводя к сердечно-сосудистым катастрофам, тромбоэмболии и диссеминированному внутрисосудистому свертыванию (ДВС-синдром) [35, 36]. На рис. 2 более темным розовым цветом обозначены процессы, преобладающие в патогенезе развития тяжелых осложнений у пациентов с СД2. Такие факторы, как глюкозотоксичность, острое воспаление, окислительный стресс, продукция цитокинов, эндотелиальная дисфункция, способствуют увеличению риска тромботических осложнений и повреждению жизненно важных органов у больных СД2 (рис. 2) [37].
После внедрения вируса в организм человека происходят его распознавание иммунокомпетентными клетками и индукция т.н. цитокинового шторма с выбросом массы провоспалительных цитокинов (ФНО, ИЛ-1β, -6, -8, -17 и др.) и хемокинов (MCP1, IP10, MIP1α) [20]. Недавние публикации свидетельствуют о том, что при СД выброс цитокинов в ответ на вирусную инфекцию происходит гораздо интенсивнее, чем при нормальном углеводном обмене [20, 21]. Почему так происходит? Ответ был получен в недавнем исследовании, где было показано, что реализация иммунного ответа и активность воспалительных реакций напрямую зависят от обеспеченности этих процессов энергией и количеством поглощенной глюкозы иммунными клетками. Повышенная экспрессия ИЛ-6 и -8 у пациентов с вирусной инфекцией показала прямую зависимость от высокого уровня гликемии. Глюкоза служит как бы источником энергии, «топливом» для бурных иммунологических реакций! Следовательно, пациенты с СД и неудовлетворительным контролем гликемии подвержены более высокой активности цитокинового шторма и риску неблагоприятного исхода вирусной инфекции [20].
Кроме того, лекарственные препараты, часто используемые в клинической практике для лечения пациентов с COVID-19, такие как системные глюкокортикостероиды (ГКС) или противовирусные препараты, могут способствовать ухудшению показателей гликемии. Однако в одном из исследований отмечено, что терапия ГКС, в частности, дексаметазоном снижает смертность среди пациентов, находившихся на искусственной вентиляции легких, на 36% (соотношение риска – ОР=0,64, 95% соотношение шансов – ОШ=0,51–0,81), у пациентов, получавших кислород, только на 18% (ОР=0,82, 95% ОШ). ГКС снижают выработку цитокинов и предотвращают развитие полиорганных осложнений у пациентов с тяжелой формой COVID-19 [38].
С другой стороны, введение больших доз ГКС может приводить к неконтролируемой гипергликемии. Считаем, что для формирования правильного представления пользы и вреда используемых лекарственных препаратов для пациентов с COVID-19 необходимы дальнейшие долгосрочные исследования, особенно пациентам с СД.
Заключение
В совокупности данные результаты показывают, что новая коронавирусная инфекция SARS-CoV-2 оказывает огромное влияние на течение СД, поскольку усиливает воспалительный ответ организма и изменяет реакцию иммунной системы, приводя к трудностям в контроле гликемии.
В ряде исследований достоверно показано, что у пациентов с СД2 и COVID-19 отмечается более высокий риск летальности по сравнению с когортами без диабета. Также продемонстрировано, что пациенты с некомпенсированным СД2 или «стрессовой» гипергликемией (уровень глюкозы натощак в крови >10 ммоль/л) имеют значительно более высокий риск тяжелого течения COVID-19 и неблагоприятного исхода по сравнению с пациентами с удовлетворительным контролем гликемии (уровень глюкозы в крови < 10 ммоль/л). Таким образом, предотвращение инфицирования COVID-19 на сегодняшний день остается лучшим решением.
В этих обстоятельствах пациенты с СД2 должны прилагать всевозможные усилия для поддержания здорового образа жизни и снижения потенциальных факторов риска. Оптимальная стратегия ведения этих пациентов, такая как выбор сахароснижающих, антигипертензивных и гиполипидемических препаратов, является важной темой для текущих и будущих исследований.


