Актуальность
Ишемическая болезнь сердца (ИБС) является одной из актуальных медикосоциальных проблем. Прежде всего это обусловлено значительной распространенностью заболевания в популяции, составляющей до 40%, большой смертностью и инвалидизацией больных [1]. Нарушения сердечного ритма (НСР) и проводимости – частые и достаточно грозные осложнения ИБС, отягощающие ее течение и прогноз [2, 3]. Частота развития НСР у больных ИБС, по мнению различных авторов, колеблется от 45 до 90% [4–6].
В настоящее время амиодарон рассматривается как один из наиболее эффективных и безопасных антиаритмических препаратов. Частота его применения среди других антиаритмических средств составляет до 24%. Препарат эффективен как в профилактике, так и в купировании различных НСР [7, 8]. Амиодарон достоверно снижает общую смертность на 13%, а смертность вследствие аритмии – на 29%. Его эффективность для пациентов с предсердной и желудочковой экстрасистолией составляет 90%, у пациентов с угрожающими жизни НРС достигает 41% [9, 10]. В то же время у большинства больных, особенно пожилого возраста, отмечается сочетание ИБС с патологией щитовидной железы (ЩЖ) [11].
Амиодарон – йодированное жирорастворимое производное бензофурана, по структуре близкое к тироксину. В одной таблетке амиодарона (200 мг) содержится 75 мг йода. Суточная потребность человека в йоде составляет около 150 мкг. При проведении этапа насыщения препаратом (900–1200 мг/сут) пациент получает практически за один прием годовую норму йода (до 300 суточных доз) [12]. В настоящее время доказано, что влияние амидорона на ЩЖ связано как со структурным сходством препарата с тиреоидными гормонами, так и с содержанием большого количества йода в нем. Прием препарата, который индуцирует запуск аутоиммунных процессов в ЩЖ, а также длительный (от 1 до 3 месяцев) период полувыведения амиодарона способствуют развитию различных нарушений основного обмена [13]. По данным эпидемиологических исследований, распространенность амиодарон-ассоциированных тиреопатий колеблется от 2 до 24% [14]. В большинстве случаев у больных развивается субклинический гипотиреоз (18%) либо манифестный тиреотоксикоз (15,8%), значительно реже – клинический гипотиреоз (1,5%) или субклинический тиреотоксикоз (1,5%) [15].
Наиболее грозным осложнением, возникающим на фоне терапии амиодароном, является амиодарон-ассоциированный тиреотоксикоз (ААТ), в основе развития которого лежат два совершенно разных патогенетических механизма [7, 15]. Так, при развитии ААТ 1-го типа ведущую роль играет йод, высвобождающийся из лекарственного вещества, что приводит к увеличению синтеза тиреоидных гормонов на фоне уже имеющейся патологии ЩЖ. При развитии ААТ 2-го типа ведущую роль играет сама молекула амиодарона в качестве токсического деструктивного агента. Кроме этого выделяют смешанный тип ААТ, при котором имеют место признаки ААТ как 1-го, так и 2-го типов. Чаще всего диагностика смешанного варианта осуществляется ретроспективно, либо по результатам гистологического исследования ткани ЩЖ, либо по особенностям клинического течения болезни [16].
В развитии амиодарон-ассоциированной тиреопатии большое значение имеет исходное состояние тиреоидного статуса (ТС) больных [15, 17, 18].
У пациентов с патологией ЩЖ общая частота тиреотоксикоза и гипотиреоза, развивающихся на фоне приема амиодарона, в среднем в 2 раза выше, нежели у больных без изменений в железе. При этом наличие множественных узловых образований в ЩЖ значительно увеличивает риск развития нарушений основного обмена [14, 19].
Наряду с морфологическими изменениями в структуре ЩЖ наличие аутоиммунного поражения тироцитов способствует раннему формированию у больных как ААТ, так и амиодарон-ассоциированного гипотиреоза. Повышение титра антител к тиреопероксидазе (ТПО) и тиреоглобулину (ТГ) является прогностически неблагоприятным фактором течения заболевания [14, 15, 17].
Амиодарон-ассоциированные тиреопатии могут развиваться как в первые месяцы, так и через несколько лет лечения. Благодаря накоплению препарата и его метаболита в тканях, а также их медленному выведению из организма нарушения основного обмена могут дебютировать даже через несколько месяцев после отмены амиодарона. Развитие тиреопатий у «эутиреоидных» пациентов зависит как от дозы, так и от длительности приема препарата. Наиболее часто они формируются на 6–9-й месяц приема амиодарона в суточной дозе более 400 мг [17, 19].
Цель исследования: оценить лабораторные и структурные показатели ЩЖ у больных ИБС с развившимся амиодарон-ассоциированным тиреотоксикозом.
Методы
Проведен анализ историй болезней 530 больных ИБС, получавших амиодарон по поводу различных НСР.
В большинстве (78,2%) случаев больные получали амиодарон по поводу мерцательной аритмии (МА); в 21,8% препарат был назначен для купирования предсердной или желудочковой экстрасистолии. Диагноз ААТ устанавливали на основании характерной клинической картины, лабораторных и инструментальных методов обследования. Всем больным выполнялись исследования уровня тиреотропного гормона (ТТГ), свободного тироксина (Т4св) и трийодтиронина (Т3), титра антител к рецепторам ТТГ, тиреопероксидазе (ТПО) и тиреоглобулину (ТГ), а также ультразвуковое исследование (УЗИ) ЩЖ. При выявлении узловых образований в ЩЖ выполнялось сцинтиграфическое исследование с 99mТс.
В последующем была проведена ретроспективная оценка структурно-функционального состояния ЩЖ 40 больных ИБС с развившимся впоследствии ААТ. Средний возраст обследованных пациентов составил 56,2±4,1 года. ИБС у обследованных диагностировалась в течение последних 6–8 лет. Группу сравнения составили 36 больных ИБС, также принимавших амиодарон, но без развития нарушений основного обмена. Обследованные пациенты были сопоставимыми по полу, возрасту и длительности заболевания. Исследование ТС у всех участников исследования включало оценку анамнеза заболевания, пальпацию и УЗИ ЩЖ, определение показателей основного обмена и специфических аутоантител к тиреоидной ткани. Пальпаторно размеры ЩЖ оценивали в соответствии с классификацией Всемирной организации здравоохранения (1994). При выполнении УЗИ ЩЖ определяли линейные размеры органа с последующим вычислением его объема, а также оценивали эхогенность и структуру тиреоидной ткани.
Результаты
Изучение историй болезни показало, что ААТ развился у 43 (8,1%) пациентов, при этом у 40 (93,2%) из них диагностировалась манифестная форма заболевания. У мужчин ААТ развивался значительно чаще, чем у женщин (68,3 и 31,7% соответственно).
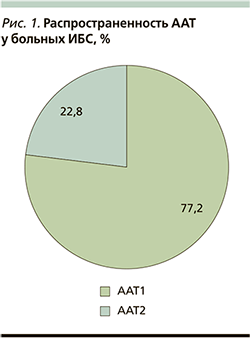 При оценке основных форм ААТ установлено, что наиболее часто у больных ИБС определялся первый тип заболевания – 31 (77,2%) обследованный. В то же время ААТ 2-го типа диагностировался лишь у 9 (22,8%). Распространенность основных форм ААТ у больных ИБС представлены на рис. 1.
При оценке основных форм ААТ установлено, что наиболее часто у больных ИБС определялся первый тип заболевания – 31 (77,2%) обследованный. В то же время ААТ 2-го типа диагностировался лишь у 9 (22,8%). Распространенность основных форм ААТ у больных ИБС представлены на рис. 1.
По анамнестическим данным, больные развившимся ААТ постоянно принимали амидарон в терапевтической дозе в течение 4,2±1,1 года. Внутривенные инфузии препарата 2 и более раза по поводу пароксизмов НСР выполнялись 29 (72,5%) из них. Для лиц группы сравнения средняя продолжительность приема амиодарона была несколько меньше – 3,3±0,4 года. При этом число больных, получавших внутривенное введение препарата, также было значительным, как и у больных ААТ, – 26 (73,1%).
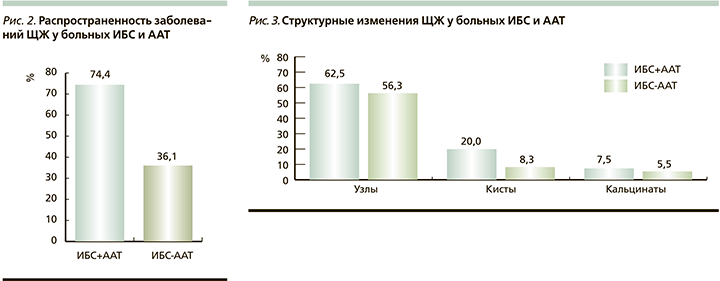
У 32 (74,4%) обследованных основной группы в течение 6,2±1,1 года до развития ААТ диагностировались различные заболевания ЩЖ. Наиболее частыми из них были узловой эутиреоидный зоб (УЭЗ) и хронический аутоиммунный тиреоидит (ХАУТ), которые определились соответственно у 22 (68,7%) и 7 (21,9%) больных. У остальных 3 (9,4%) обследованных диагностировался диффузно-узловой токсический зоб (ДТЗ). Из обследованных пациентов основной группы 17 (53,1%) на протяжении 3,2±0,9 года принимали медикаментозную терапию по поводу нарушений основного обмена. В большинстве (82,3%) случаев пациенты постоянно принимали левотироксин натрия. Больные ДТЗ на протяжении 6,1±2,1 месяца принимали тиреостатики.
В то же время в группе контроля заболевания ЩЖ диагностировались лишь у 13 (36,1%) обследованных в течение последнего 3,2±0,9 года. Как и у обследованных основной группы наиболее частой патологией были УЭЗ и ХАУТ – 8 (61,5%) и 5 (38,5%) больных соответственно. Распространенность заболеваний ЩЖ среди больных ИБС и ААТ представлена на рис. 2.
Заместительную терапию по поводу первичного гипотиреоза принимали 4 (30,7%) пациента.
Сравнительный анализ гипофизарно-тиреоидного гомеостаза у обследованных пациентов показал следующее. При ретроспективном анализе у всех диагностировалось эутиреоидное состояние.
При этом уровень ТТГ у больных ИБС с впоследствии развившимся ААТ был на 18,8% достоверно ниже (р<0,05), чем у лиц группы сравнения (см. таблицу). Также было установлено отсутствие достоверных различий значений Т4св и Т3 у всех обследованных пациентов. При исследовании иммунологических показателей ТС титр антител к ТПО и ТГ был повышен у всех больных. У обследованных пациентов основной группы он был на 79,2% достоверно выше (р<0,05) по сравнению с другими больными.

Всем лицам, включенным в исследование, проведена пальпация ЩЖ при физикальном обследовании. Было установлено, что у большинства обследованных лиц обнаружены нормальные размеры железы. В то же время у 5 (12,5%) больных ИБС с развившимся ААТ определен диффузный зоб 1-й степени. В группе сравнения увеличение ЩЖ 1-й степени отмечено лишь у 2 (5,5%) больных.
Применение сонографического метода исследования позволило установить, что у всех обследованных пациентов средний объем ЩЖ не превышал нормальных показателей. В то же время у больных ИБС и ААТ средний объем ЩЖ был на 10,2% больше, чем у лиц группы сравнения.
Важным аспектом нашего исследования был анализ частоты и характера органических тиреопатий у обследованных пациентов по данным УЗИ. Наибольший удельных вес среди структурных изменений ЩЖ имели узловые и кистозные образования. Узловые образования в структуре ЩЖ отмечены у 25 (62,5%) обследованных основной группы. При этом доля больных с двумя и более узлами составляла 56,3% (14 больных). В группе сравнения аналогичные изменения ЩЖ встречались в 22,2% случаев (8 обследованных). При этом число лиц с двумя и более узлами также было значительно меньше, чем в основной группе, – 3 (37,5%) больных.
Наиболее часто кистозные образования в структуре ЩЖ также отмечались у больных ИБС с ААТ – 8 (20%) обследованных. Изменения структуры ЩЖ у больных ИБС в сочетании с ААТ представлены на рис. 3.
У лиц группы сравнения они определялись лишь у 3 (8,3%) больных. В большинстве случаев у всех обследованных выявлялись единичные кистозные образования ЩЖ.
Число пациентов с кальцинатами в структуре ЩЖ было незначительным и существенно не различалось в каждой группе обследованных – 3 (7,5%) и 2 (5,5%).
Обсуждение
ААТ у больных ИБС развивается в 8% случаев, протекает в манифестной форме и наиболее часто встречается у мужчин. При этом длительность и способ приема амиодарона существенно не влияют на сроки развития ААТ.
Исходное состояние тиреоидного статуса больных ИБС, принимавших амиодарон, оказывает существенное влияние на риск развития у них ААТ. Длительный анамнез заболеваний ЩЖ, прием заместительной или тиреостатической терапии способствуют раннему формированию ААТ.
У больных ИБС с развившимся впоследствии ААТ по сравнению с контрольной группой отмечались существенные изменения показателей как основного обмена, так и маркеров аутоиммунных процессов в ЩЖ. Наиболее важным при этом стало повышение в 2 и более раз титра атител к ТПО и ТГ, а также достоверное увеличение значений ТТГ.
Структурные изменения ЩЖ в среднем в 3 раза чаще встречались у больных ИБС с развившимся ААТ, чем в контрольной группе обследованных. При этом наиболее часто диагностировались множественные узловые и кистозные образования ЩЖ.
Выраженные нарушения тиреоидной системы у больных ИБС, принимавших амиодарон, обусловливали в большинстве случаев развитие ААТ первого типа.
Заключение
Таким образом, структурно-функциональное состояние ЩЖ больных ИБС с развившимся ААТ характеризуется длительным анамнезом различной патологии железы, ее выраженными структурными изменениями, а также повышением титра аутоантител к тироцитам и концентрации тироксина, что способствуют более частому развитию первого типа заболевания.


