Введение
Прием некоторых сахароснижающих лекарственных средств (ССЛС) может быть ассоциирован с риском развития холестатического варианта лекарственного поражения печени (ЛПП). Точная распространенность данного осложнения не известна, однако в литературе описан ряд случаев его развития в ответ на глимеперид [1], метформин [2,3], глибенкламид [4,5], глипизид [6], пиоглитазон [7] и другие тиазолидиндионы [8].
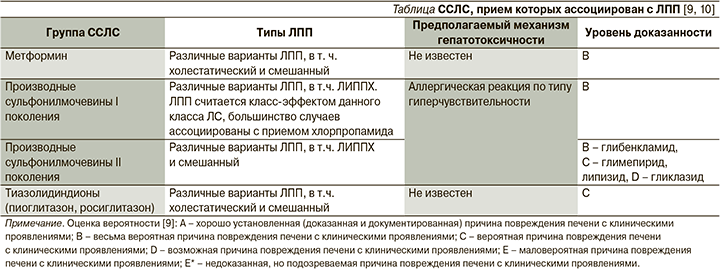
Возможные механизмы развития лекарственно-индуцированного поражения печени с холестазом (ЛИППХ) на фоне их приема, а также степень вероятности взаимосвязи ССЛС–ЛПП суммированы в таблице.
Сахароснижающие лекарственные средства
ЛПП с клиническими проявлениями на фоне лечения метформином встречается очень редко, в литературе описано менее десятка случаев, несмотря на широкое применение этого ЛС в течение нескольких десятилетий [9, 11]. Были описаны все клинические варианты ЛПП, в т.ч. и ЛИППХ [2, 3, 12–14]. Cимптомы (желтуха, слабость, повышенная утомляемость) обычно появляются через 1–8 недель после инициации лечения метформином. Аллергические проявления не типичны, но в отдельных случаях сыпь, лихорадка и эозинофилия все же встречаются. Поскольку этот препарат обычно назначается в комбинации с другими ССЛС, некоторые из которых также вызывают ЛПП, часто бывает трудно установить, вызвано ли повреждение метформином или иным ЛС. Наиболее убедительным в таких случаях является тот факт, что ЛПП возникает вскоре после начала приема препарата, а не во время длительной терапии. Симптомы обычно исчезают вскоре после прекращения приема метформина.
ЛПП считается класс-эффектом производных сульфонилмочевины (ПСМ) I поколения, при этом большинство случаев их развития ассоциировано с приемом хлорпропамида (степень вероятности взаимосвязи – В) [2, 9, 11, 15–16]. На фоне лечения ПСМ II поколения также описаны случаи развития ЛПП с клиническими проявлениями, при этом степень вероятности взаимосвязи разнится для разных представителей класса (В – для глибенкламида, С – для глимепирида и глипизида, D – для гликлазида), складывается впечатление, будто это осложнение является класс-эффектом также и ПСМ II поколения [9], большинство случаев ассоциировано с применением глибенкламида [9, 17]. Незначительное повышение уровня печеночных ферментов во время терапии ПСМ как I, так и II поколений в плацебо-контролируемых исследованиях отмечалось менее чем у 1% пациентов, причем эти показатели были аналогичными таковым в группе плацебо. ЛПП с клиническими проявлениями, ассоциированными с приемом этого класса ЛС, встречаются редко, но подобные сообщения имеют место в отношении практически каждого препарата этого класса. На фоне приема ПСМ I и II поколений описаны различные клинико-морфологические формы ЛПП, в т.ч. ЛИППХ, они не различаются на фоне приема конкретных препаратов данного класса. Патофизиологическим механизмом развития ЛПП на фоне лечения ПСМ I и II поколений предположительно служат аллергические реакции по типу гиперчувствительности.
ЛПП обычно появляется в течение 2–12 недель после начала приема ПСМ I поколения и в течение 3–12 недель – II поколения, хотя в некоторых случаях повреждение печени возникало через много месяцев или даже лет после начала лечения, чаще после недавнего увеличения дозы. Пациенты предъявляют жалобы на усталость, тошноту, дискомфорт в животе, кожный зуд; появляются желтуха и моча темного цвета. Аллергические проявления (лихорадка, сыпь, эозинофилия) при развитии ЛПП на фоне ПСМ I поколения встречаются с частотой до 50% случаев, а на фоне ПСМ II поколения они редки. После отмены ПСМ клинико-лабораторные признаки ЛПП обычно быстро исчезают.
Представляет интерес тот факт, что возникновение ЛПП на фоне приема одного из представителей класса ПСМ не означает, что подобное повреждение возникнет при лечении другим, было также опубликовано много примеров отсутствия рецидива при повторном применении того же препарата, но в более низких дозах. Тем не менее следует учитывать то обстоятельство, что между различными ПСМ I поколения может быть перекрестная чувствительность, поэтому при возникновении ЛПП на фоне терапии ПСМ рекомендуется назначать ССЛС другой группы. Если это по каким-то причинам невозможно, то в случае развития ЛПП на фоне ПСМ I поколения можно рассмотреть возможность последующего назначения ПСМ II поколения.
В любом случае обязательно тщательное мониторирование уровня печеночных ферментов в крови.
В очень редких случаях ЛПП с клиническими проявлениями ассоциируется с приемом ЛС класса тиазолидиндионов, пиоглитазона и росиглитазона (в обоих случаях степень вероятности взаимосвязи – С).
В литературе описано менее 10 случаев ЛПП на фоне приема каждого из этих препаратов [7, 18, 19], варианты ЛПП были различными, в т.ч. описано и ЛИППХ. Клинические симптомы обычно появляются в промежутке между 1-м и 6-м месяцами после начала терапии пиоглитазоном и между 1-й и 12-й неделями в случае инициации терапии росуглитазоном. Аллергические проявления редки.
В большинстве случаев симптомы исчезают в течение 1–3 месяцев после прекращения терапии тиазолидиндионами. На фоне приема препаратов данного класса не описано случаев развития синдрома «исчезающих желчных протоков».
Случаев развития ЛИППХ на фоне приема новых классов ССЛС (ингибиторы дипептидилпептидазы 4-го типа, агонисты рецепторов глюкагоноподобного пептида-1, ингибиторы натрий-глюкозного котранспортера 2-го типа), ингибиторов α-глюкозидазы, инсулинов в литературе не представлено.
Лечение лекарственно-индуцированных поражений печени с холестазом
Одной из наиболее эффективных и безопасных стратегий лечения пациентов с ЛПП независимо от клинической формы, но особенно ЛИППХ является назначение препаратов УДХК, что обусловлено их цитопротективным, антиапоптотическим и иммуномодулирующим эффектами, а также способностью уменьшать проявления цитолиза, холестаза и стеатоза печени [20]. При этом ключевыми преимуществами УДХК при холестатическом варианте ЛПП являются защита от цитотоксического действия солей желчи, стимуляция гепатобилиарной секреции, антиоксидантные эффекты, повышение уровня глутатиона [21–22].
В литературе имеются описания ряда клинических случаев, демонстрирующих высокую эффективность УДХК в лечении ЛИППХ. Так, Лазебник Л.Б. и соавт. [23] описывают случай развития лекарственно-индуцированного гепатита, вызванного приемом статинов, у пациента в возрачте 43 лет с ишемической болезнью сердца (ИБС), неалкогольной жировой болезнью печени и ожирением [23]. Статины (аторвастатин в дозе 10 мг) были рекомендованы пациенту в стационаре в связи с развившимся острым инфарктом миокарда. Диагноз при выписке был сформулирован следующим образом: «ИБС. Острый задне-диафрагмальный инфаркт миокарда. Состояние после тромболитической терапии стрептокиназой. Недостаточность кровообращения IIА ст. Эпизод сердечной астмы.
Артериальная гипертензия III стадии 2-й степени, риск IV. Дислипидемия IIБ. Алиментарно-конституциональное ожирение III ст. Мочекаменная болезнь. Геморрой». После выписки пациента на фоне приема рекомендованных препаратов его продолжали периодически беспокоить боли ноющего, сжимающего характера за грудиной при быстрой ходьбе, в связи с чем он вновь госпитализирован для обследования и лечения и у него впервые выявлено повышение уровня АЛТ до 3 высших границ нормы (ВГН). В связи с болями за грудиной пациенту выполнена коронарография и выявлен гемодинамически значимый стеноз промежуточной ветви правой коронарной артерии, выполено стентирование, которое осложнилось диссекцией артерии, для коррекции которой проведено аутовенозное аортокоронарное шунтирование без искусственного кровообращения. Послеоперационный период также протекал с осложнениями (плеврит, перикардит, повышение температуры тела до 37,5°С), но на фоне медикаментозной терапии состояние улучшилось и пациент выписан домой с рекомендациями по приему блокаторов кальциевых каналов, антикоагулянтов с последующим переходом на антиагреганты, β-адреноблокаторов, аторвастатина в дозе 10 мг/сут.
В регулярных контрольных биохимических анализах крови после проведенной операции отмечено постепенное нарастание АЛТ (до 6 ВГН), АСТ (до 3 ВГН), а также появились признаки холестаза (ГГТП до 2 ВГН), в связи с чем произведена отмена статина, сопровождавшаяся последующим снижением уровня АЛТ (до 2 ВГН) и АСТ (норма), однако в связи с прогрессированием дислипидемии возобновлен прием аторвастатина в дозе 10 мг/сут, сопровождавшийся повышением АЛТ (до 17 ВГН) и АСТ (до 10 ВГН). Пациент госпитализирован в специализированное гастроэнтерологическое ЛПУ, где после обследования установлен следующий диагноз: «ИБС: Стенокардия напряжения.
Функциональный класс II. Постинфарктный кардиосклероз. Аортокоронарное шунтирование от 2006 г. Гипертоническая болезнь III стадии, 2-й степени, риск 4. Атерогенная дислипидемия IIБ. Экзогенно-конституциональное ожирение II ст. Лекарственный (статиновый) гепатит. Хронический гастрит с наличием хронических эрозий в стадии обострения. Недостаточность кардии. Холестероз желчного пузыря, сетчатая форма. Хронический панкреатит, ремиссия. Мочекаменная болезнь. Хронический пиелонефрит вне обострения». Для уточнения состояния печени и установки диагноза выполнена биопсия печени. Заключение: хронический портальный и лобулярный гепатит низкой степени активности, аутоиммунный холангит.
Назначено лечение: диета с ограничением жиров, отменен аторвастатин, назначены УДХК (5 капсул в сутки), адеметионин, препараты пищеварительных ферментов (панкреатин), пентоксифиллин. На фоне этой терапии уровни трансаминаз, билирубина, ГГТП нормализовались, но в связи с недостижением целевых значений липопротеидов низкой плотности (ЛПНП) пациенту было рекомендовано возобновить прием статинов (симвастатин – 10 мг/сут), но в сочетании с УДХК (4 капсулы в сутки). Через полгода с целью контроля состояния функции печени выполнена ее биопсия. Заключение: хронический очаговый портальный гепатит минимальной степени активности. Биохимический анализ крови: АЛТ – 69,4 ЕД/л, АСТ – 39,1 ЕД/л, холестерин – 5,75 ммоль/л, ЛПНП – 3,8 ммоль/л, триглицериды – 1,38 ммоль/л. Скорректирована гиполипидемическая терапия: добавлен эзетимиб в дозе 10 мг/сут. Полный отказ данного пациента от приема статинов был невозможен ввиду очень высокого риска развития сердечно-сосудистых осложнений. Принято решение о продолжении приема УДХК (3 капсулы в сутки).
Таким образом, комбинированная терапия статином и УДХК привела к положительной динамике состояния пациента, что клинически проявлялось переходом дислипидемии в IIа-степень, улучшением гистологической картины печени и уменьшением признаков холестаза [23].
Рациональность и эффективность тактики комбинированного приема статинов и УДХК (Урсосан®, ПРО.МЕД.ЦС Прага а.о., Чехия) с целью уменьшения риска ЛПП установлена в наблюдательном когортном исследовании РАКУРС [24] (262 пациента в возрасте 60,1±8,9 года), в котором больные, принимавшие статины для вторичной профилактики сердечно-сосудистых осложнений, были разделены на 2 группы: 1-я – пациенты, которым назначена УДХК, 2-я группа – больные на монотерапии статинами. Выявлено, что терапия статинами в комбинации с препаратами УДХК способствовала статистически значимому (р<0,001) снижению уровней общего холестерина и ЛПНП через 6 месяцев наблюдения в 2 раза. При этом отмечали статистически значимое (p<0,001) снижение уровней АЛТ, АСТ, ЩФ и ГГТП. Уровни общего билирубина и КФК сыворотки крови за время наблюдения не изменились (p=0,65 и р=0,16 соответственно). Таким образом, полученные результаты позволили авторам исследования сделать вывод, согласно которому комбинированная терапия статинами и УДХК не только способствует гепатопротекции и снижает риски статин-индуицрованного повреждения печени, но и усиливает их гиполипидемическое действие, что проявляется в большем снижении уровня общего холестерина и ЛПНП в сравнении с монотерапией статинами (р=0,01) [24].
В другой публикации [25] описывается клинический случай пациентки 65 лет, госпитализированной в стационар в связи с жалобами на слабость, пожелтение кожных покровов и склер, кожный зуд, периодические боли в эпигастрии и правом подреберье, тошноту после приема пищи. Описанные жалобы впервые появились за 3 месяца до госпитализации. Тогда же в биохимическом анализе крови было впервые выявлено повышение уровней «печеночных» трансаминаз (АЛТ в 30 раз, АСТ в 17), билирубина (в 3 раза) и ГГТП (в 7). Признаков билиарной гипертензии при ультразвуковом исследовании органов брюшной полости выявлено не было.
В анамнезе у пациентки длительный (в течение 1,5 лет) прием амиодарона (суммараная доза препарата – 156 г) по поводу эпизодов фибрилляции предсердий, перенесенный острый гепатит В (полное выздоровление), лапароскопическая холецистэктомия по поводу калькулезного холецистита, поливалентная лекарственная аллергия.
В общем анализе крови выявлены небольшое уменьшение количества эритроцитов, гиперхромия и эозинофилия; в биохимическом анализ крови АЛТ повышена до 1041 МЕ/л, АСТ – до 1437, также отмечено повышение ГГТП, ЩФ и общего билирубина за счет прямой фракции. Коагулограмма без особенностей. При гистологическом исследование биоптата печени выявлен стеатогепатит с наличием эозинофилов и воспалительно-клеточного инфильтрата (гистологическая картина, характерная для нежелательных реакций типа В [реакции гипертчувствительности]). На основании данных анамнеза и результатов лабораторных и инструментальных методов исследований установлен диагноз «острый гиперсенситивный лекарственный холестатический гепатит, индуцированный приемом амиодарона». Амиодарон был отменен. Начаты дезинтоксикационная терапия, плазмаферез; назначен преднизолон в дозе 120 мг/сут внутривенно с последующим переходом на прием препарата внутрь в дозе 30 мг/ сут и Урсосан в дозе 1000 мг/сут. Через 4 недели лечения у пациентки наблюдалась выраженная положительная динамика, проявившаяся уменьшением астении, желтухи, кожного зуда и нормализацией лабораторных показателей [25].
В третьем клиническом случае [26] представлено описание множественных осложнений длительной (около 6 лет) фармакотерапии (бесконтрольное самолечение амиодароном в суммарной дозе >1500 г, средняя суточная доза – 650 мг) пациентки 60 лет: брадикардия, серо-фиолетовая окраска кожи лица, тремор рук, парезы нижних и верхних конечностей, «амиодароновое легкое», нарушение зрения, диспепсия и др. Со слов пациентки, она принимала амиодарон из-за страха развития пароксизмов фибрилляции предсердий, которая возникла 16 лет назад после перенесенного миокардита. В клиническом анализе крови имела место лейкопения (лейкоциты – 2,9×109/л) и ускорение СОЭ до 48 мм/ч.
В биохимический анализе крови: общий холестерин – 6,12 ммоль/л, АСТ – 82 ЕД/л, АЛТ – 68 ЕД/л, С-реактивный белок – 2,77 мг/дл, фибриноген – 5 г/л. На ЭКГ выявлен синусовый ритм с ЧСС 50 уд/мин. с эпизодами фибрилляции предсердий с ЧСС до 75 уд/мин. Признаки гипертрофии миокарда левых отделов сердца, при КТ органов грудной клетки – КТ-признаки интерстициального пневмонита, на спирографии – умеренные нарушения вентиляционной функции легких по смешанному типу. Окулист констатировал наличие стромальной дистрофии роговицы. На основании жалоб, клинической симптоматики, результатов лабораторных и инструментальных методов исследования был выставлен следующий диагноз: «хроническая интоксикация амиодароном с поражением кожи, периферической и центральной нервной системы, легких, печени; подострая восходящая моторно-сенсорная полинейропатия с периферическим тетрапарезом преимущественно в нижних конечностях до 2 баллов; лекарственный тремор кистей рук; лекарственный фиброзирующий альвеолит; дыхательная недостаточность I–II ст.; лекарственный гепатит с минимальной степенью активности; дистрофия роговицы». Фоновое заболевание: постмиокардитический миокардиосклероз; фибрилляция предсердий, персистирующее течение; гипертоническая болезнь II ст.; артериальная гипертензия 3-й ст., риск IV (очень высокий); хроническая сердечная недостаточность I–IIА, функциональный класс II.
Амиодарон был отменен, пациентке назначены диета, пропафенон 150 мг 3 р/сут, метопролол 50 мг 2 раза в сутки, лизиноприл 10 мг/сут, витамины группы В, антихолинэстеразные средства, УДХК 250 мг 3 раза/сут. На фоне проводимой терапии у пациентки была отмечена положительная динамика, клинически проявлявшаяся увеличением силы в конечностях, купированием симптомов полинейропатии, уменьшением тремора в кистях, регрессом цианоза слизистых оболочек, одышки, кашля, диспепсии, нарушений зрения. Через 6 месяцев женщина начала самостоятельно передвигаться. Нормализовались показатели клинического и биохимического анализов крови. На холтеровском мониторировании ЭКГ пароксизмов фибрилляции предсердий не выявлено. Показатели вентиляционной функции – без особенностей. КТ органов грудной клетки: признаки ретикулярно-интерсициальных изменений на фоне пневмосклероза. Ультразвуковое исследование органов брюшной полости: диффузная неоднородность паренхимы печени, подчеркнутость портальных трактов [26].
Следует отметить, что амиодарон достаточно часто вызывает нежелательные реакции со стороны практически любых органов и систем. Так, при длительном (≥5 лет) применении до 75% пациентов могут испытывать осложнения терапии амиодароном, такие как нарушения функции щитовидной железы, нейропатия зрительного нерва, периферическая нейропатия, пульмо- и гепатотоксические реакции и др., а бессимптомное повышение трансаминаз у таких больных выявляют еще чаще (40–80% пациентов) [27–40]. Таким образом, поражение печени является, пожалуй, самой распространенной нежелательной реакцией, обусловленной применением амиодарона. При этом подобные нежелательные реакции могут возникать немедленно, в течение ближайших нескольких часов или дней (например, гепатит тяжелого течения, вызванный внутривенной инфузией амиодарона), а также спустя несколько недель или даже лет [30–40].
Известно, что морфологическими формами ЛПП, ассоциированными с приемом амиодарона, являются фосфолипидоз, макро- и микровезикулярный стеатоз [41], гепатит [42], цирроз [43] и холестаз [44]. Развитие острого тяжелого гепатита, обусловленного введением амиодарона, в большинстве случаев носит обратимый характер, однако имеются литературные данные о случаях возникновения острой печеночной недостаточности с летальным исходом [45].
Амиодарон оказывает свое повреждающее действие на клетки печени при помощи нескольких механизмов. Так, амиодарон и его основной липофильный метаболит дезэтиламиодарон накапливаются в печени в значительном количестве, что может приводить к возникновению фосфолипидоза [45]. Другим важным механизмом, с которым связано появление микровезикулярных жировых влючений в гепатоцитах на фоне приема амиодарона, является михондриальная дисфункция. Амиодарон и его активный метаболит накапливаются в митохондриях гепатоцитов и ингибируют транспорт электронов, блокируют окислительное фосфорилирование. Следовательно, повреждение печени, индукция апоптоза и некроз гепатоцитов на фоне приема амиодарона обусловлены рядом факторов, особенно велика роль митохондриальной дисфункции и нарушения бета-окисления жирных кислот [45].
Пропафенон является адекватной и безопасной альтернативой амиодарону для пациентов с нарушениями ритма сердца. Так, в рандомизированном двойном слепом контролируемом исследовании по сравнению эффективности перорального приема пропафенона (доза 600 мг) и внутривенного введения амиодарона (300 мг – нагрузочная доза, после которой в течение 12–24 часов дополнительно вводилось 600 мг препарата) у пациентов с фибрилляцией предсердий после перенесенной операции аорто-коронарного шунтирования [46] было показано, что длительность первого (p=0,361), второго (p=0,832) и третьего (p=0,298) эпизодов фибрилляции предсердий, необходимость в кардиоверсии (p=0,998) и повторного введения ЛС (p=0,557, 0,699) были сопоставимыми у пациентов, принимавших амиодарон и пропафенон. При этом повторные пароксизмы фибрилляции предсердий наблюдались в группе пропафенона несколько реже (30,9%) по сравнению с группой амиодарона (34,3%) [46]. Следует обратить внимание на то, что пропафенон в более удобной для пациента лекарственной форме (для приема внутрь) оказался не менее эффективным, чем при внутривенном введении. Это важно, т.к. в случае возникновения внезапного пароксизма фибрилляции предсердий далеко не всегда есть возможность проведения парентерального (внутривенного) введения антиаритмика. К тому же парентеральное введение ЛС более травматично, ассоциировано с гораздо большим числом и риском осложнений, обусловленных непосредственно процессом введения препарата (паравазальное введение, инфекционные осложнения, в т.ч. сепсис, флебит, тромбоз и др.) [47]. В другой работе по сравнению эффективности восстановления синусового ритма у пациентов с пароксизмом фибрилляции предсердий с помощью внутривенных инфузий пропафенона или амиодарона [48] восстановление синусового ритма констатировано у 74,1% пациентов, получавших пропафенон, и у 70,4% пациентов, принимавших амиодарон. Однако среднее время восстановления синусового ритма в группе пропафенона было намного меньше (3,5 и 16,6 часа соответственно, различия между группами статистически значимы, p<0,01). На основании полученных данных авторами был сделан вывод, согласно которому у пациентов с пароксизмом фибрилляций предсердий внутривенное введение пропафенона способствует более быстрому восстановлению синусового ритма по сравнению с амиодароном [48]. При этом на фоне приема пропафенона до настоящего времени не зарегистрировано случаев развития острой или хронической печеночной недостаточности, а также синдрома «исчезающих желчных протоков» [9]. Таким образом, пропафенон является сопоставимой по эффективности, но более безопасной альтернативой амиодарону, который возможно использовать в комбинации с препаратами УДХК, в т.ч. пациентам с амиодарон-индуцированным поражением печени.
Высокая эффективность применения УДХК пациентами с ЛИППХ имеет высокую доказательность, продемонстрированную в ряде клинических исследований. Так, в рандомизированном плацебо-контролирумом клиническом исследовании [49], в которое вошли в общей сложности 112 пациентов, рандомизированных в группу наблюдения (n=54, получали терапию УДХК в дозе 13–15 мг/кг массы тела в сутки) и группу контроля (n=58, получали плацебо) [49], контроль функции печени проводился каждые 2 недели. Конечными точками исследования были смерть, трансплатация печени или развитие тяжелого поражения печени (общий билирубин сыворотки крови ≥2,5 мг/дл в совокупности с международным нормализованным отношением ≥1,5, асцитом или энцефалопатией). Как оказалось, в группе лечения отмечен статистически значимо более низкий уровень ЩФ, а количество летальных исходов и случаев необходимости трансплантации печени среди пациентов с тяжелыми ЛПП сопоставимое [49].
В другой работе, выполненной А. Wree et al. [50], изучались эффективность и безопасность комбинированной терапии УДХК и глюкокортикостероидами (ГКС) у пациентов (n=15) с тяжелыми ЛПП гепатоцеллюлярного и холестатического типов [50]. Девять из 15 больных получали терапию ГКС с постепенным снижением дозы в течение нескольких недель, в то время как оставшиеся 6 пациентов – пульс-терапию ГКС в течение 3 дней.
УДХК назначалась в обеих группах. Наилучшие результаты лечения наблюдались у больных (n=10) без гистологических признаков предшествовавшего поражения печени (билирубин и уровни печеночных трансаминаз снижались до значений <50% от пиковых концентраций в течение 2 недель и приходили в норму в течение 4–8 недель). У пациентов (n=3), у которых имелись положительные антитела (антиядерные антитела и/или антитела к растворимому печеночному антигену/печеночнопанкреатическому антигену [SLA/LP]) и/или гистологические признаки хронического гепатита, наблюдалось более медленное снижение билирубина и концентрации трансаминаз в плазме крови, что требовало продления иммуносупрессии (ГКС или азатиоприн) еще на 6 месяцев [50]. На основании полученных данных авторами был сделан вывод: комбинированная терапия ГКС (независимо от режима) и УДХК является эффективной и в большинстве случаев способствует быстрой нормализации функции печени, проявляющейся нормализацией биохимических показателей (билирубин, «печеночные» трансаминазы) [50]. В проспективном пилотном исследовании S.M. Lang et al. [51] анализировалась эффективность применения УДХК в дозе 250–500 мг/сут с целью снижения гепатотоксических реакций у пациентов, получавших противотуберкулезное и антимикобактериальное лечение.
В исследование вошли в общей сложности 27 пациентов (средний возраст – 44 года). В результате приема УДХК у 21 из 27 (77,8%) больных наблюдалось снижение уровня «печеночных» трансаминаз (АЛТ, АСТ), ЩФ и билирубина в сыворотке крови до нормальных значений. Также у всех пациентов отмечалось улучшение клинической картины. Нежелательных реакций выявлено не было. На основании полученных данных авторами был сделан вывод, согласно которому прием УДХК взрослыми пациентами, принимающими противотуберкулезные и антимикобактериальные препараты способствует регрессу гепатотоксических проявлений фармакотерапии [51]. Еще в одной работе [52] по изучению влияния УДХК на состояние пациентов с ЛПП (152 человека, рандомизированных в группу активной терапии (больные, получавшие УДХК) и группу контроля (больные, не получавшие УДХК) выявлено, что биохимические маркеры повреждения печени (АЛТ, общий билирубин, АСТ) были статистически значимо (р<0,05) ниже в группе наблюдения по сравнению с группой контроля [52].
Убедительные доказательства эффективности назначения УДХК пациентам с ЛПП, полученные по результатам клинических исследований, легли в основу решения о включении УДХК в клинические рекомендации по ведению пациентов с ЛПП. Так, в соответствии с рекомендациями Российской гастроэнтерологической ассоциации [53] пациентам с ЛИППХ рекомендуется назначение УДХК в суточной дозе 13–15 мг на килограмм массы тела [53–55]. В клинических рекомендациях Российской гастроэнтерологической ассоциации и Российского общества по изучению печени в разделе по диагностике и лечению холестаза [53–55] особое внимание уделяется эффективности и оправданности назначения УДХК, а также ее комбинации с ГКС в определенных клинических ситуациях.
В рекомендациях подчеркивается, что имеются обнадеживающие результаты применения сочетания ГКС с УДХК при ЛПП гепатоцеллюлярного и холестатического типов [50, 53–56]. Лекарственный гепатит упоминается в инструкции к препарату УДХК Урсосан® (ПРО.МЕД.ЦС Прага а.о., Чехия) [57].
В клинических рекомендациях Российского научного медицинского общества терапевтов и Научного общества гастроэнтерологов России по ЛПП у взрослых [58] отмечено, что применение УДХК к пациентам с холестатическим и смешанным вариантами ЛПП способствует нормализации биохимических маркеров состояния функции печени и положительным морфологическим изменениям в структуре печени: уменьшению индекса гистологической активности, нормализации диаметра, уменьшению фиброза и инфильтрации лимфоцитами портальных трактов, отсутствию перипортальных некрозов, гиперплазии ретикуло-эндотелиальной системы, уменьшению признаков холестаза (уровень убедительности рекомендаций – В; уровень достоверности доказательств – 2) [58]. Имеются также сведения об эффективности применения УДХК в отношении пациентов с ЛПП, перенесших трансплантацию печени, а также при проведении иммуносупрессивной терапии.
В Рекомендациях Европейской ассоциации по исследованию печени (European Association for the Study of the Liver, EASL) [59] также отмечается положительный эффект от применения УДХК пациентами с ЛПП, который отмечается не менее чем у двух третей пациентов [59, 60].
Среди всех препаратов УДХК выделяется Урсосан® (ПРО.МЕД.ЦС Прага а.о., Чехия), который характеризуется высоким качеством и чья эффективность подтверждена реальной клинческой практикой [23–26]. Данный препарат возможно применять длительно (в т.ч. числе несколько месяцев), что актуально для пациентов, вынужденных получать долгосрочную или пожизненную терапию ЛС с потенциальным гепатотоксическим действием (например, препараты для лечения туберкулеза, противоревматические средства и т.д.) [21, 22].
Профилактика ЛИППХ
Для профилактики ЛИППХ рекомендуется [53, 58, 61, 62]:
- точно следовать предписаниям инструкции по медицинскому применению ЛС;
- учитывать возможные взаимодействия между ЛС, которые потенциально могут увеличивать риск развития ЛИППХ;
- избегать полипрагмазии (избыточное назначение ЛС пациенту);
- контролировать уровни биохимических маркеров функции печени (ЩФ, ГГТП, АСТ, АЛТ);
- избегать избыточного потребления алкоголя.
Так же как это было продемонстрировано в клинических примерах и клинических исследованиях, представленных в данном обзоре ранее, в отношени некоторых пациентов с факторами риска развития ЛИППХ возможно рассмотреть профилактическое назначение гепатопротекторов, УДХК, особенно в случае невозможности отказаться от приема потенциально гепатотоксичных лекарственных препаратов [53, 58, 61, 62].
Заключение
Таким образом, ЛИППХ – достаточно частое лекарственно-индуцированное заболевание, возникающее на фоне приема достаточно большого количества ЛС, применяемых для лечения сердечно-сосудистых и эндокринных заболеваний, и имеет тенденцию к затяжному течению. В связи с этим необходимо повышать информированность врачей первичного звена, кардиологов и эндокринологов о возможности развития подобной нежелательной лекарственной реакции, методах диагностики, профилактики и лечения ЛИППХ. Одним из направлений терапии ЛИППХ является применение УДХК, что нашло отражение в российских рекомендациях по ЛПП. Показана целесообразность ее применения для профилактики развития ЛПП. Терапевтическая эффективность препарата Урсосан® (ПРО.МЕД.ЦС Прага а.о., Чехия), большая доказательная база, отличная переносимость и выгодные ценовые характеристики (соотношение стоимость/эффективность) позволяют рекомендовать данное ЛС для лечения и профилактики ЛИППХ у широкого круга больных кардиологического и эндокринологического профиля.
Вклад авторов. Написание текста – О.Д. Остроумова, А.П. Переверзев, Е.Е. Павлеева, А.Г. Комарова. Редакти-рование текста – О.Д. Остроумова.


