Обоснование
Анкилозирующий спондилит (АС) – хроническое воспалительное заболевание из группы спондилоартритов (СпА), характеризующееся обязательным поражением крестцово-подвздошных суставов и/или позвоночника с потенциальным исходом в анкилоз, с частым вовлечением в патологический процесс энтезисов и периферических суставов [1]. АС относится к аксиальному спондилоартриту (аксСпА) наряду с нерентгенологическим аксСпА (нр-акСпА). Главная цель лечения больных аксСпА – максимальное улучшение качества жизни, связанного со здоровьем, посредством контроля симптомов воспаления, предупреждения прогрессирования структурных повреждений, сохранения функции и социальной активности [2]. При неэффективности стандартной терапии, включающей, как правило, немедикаментозные методы лечения и нестероидные противовоспалительные средства (НПВС), и сохраняющейся высокой активности заболевания пациентам с АС показана генно-инженерная биологическая терапия (ГИБП). Также пациентам с проявлениями периферических артритов могут назначаться локальные инъекции глюкокортикостероидов (ГКС) и сульфасалазин. В настоящее время для лечения АС из ГИБП применяются препараты группы ингибиторов фактора некроза опухоли α – иФНО-α (инфликсимаб – ИНФ, адалимумаб – АДА, голимумаб – ГМБ, этанерцепт – ЭТЦ, цертолизумаба пэгол – ЦЗП) и ингибитор интерлейкина-17А – иИЛ-17А (секукинумаб).
С учетом того, что АС мультифакториальное заболевание, его клиническая картина весьма разнообразна и помимо поражения опорно-двигательной системы включает внесуставные проявления (поражение глаз в виде увеита, воспалительные заболевания кишечника, псориаз кожи и ногтей, IgA-нефропатию, нарушение ритма сердца). Течение заболевания весьма индивидуально и от каждого пациента требует индивидуального подхода к терапии. Зачастую АС характеризуется очень высокой активностью, быстрым прогрессированием болезни и плохим ответом на биологическую терапию.
Клинический пример 1
Пациент С. 45 лет проходил неоднократное стационарное лечение в клинике НИИР им. В.А. Насоновой с 2011 по 2019 г. с диагнозом «анкилозирующий спондилит, HLAB-27-ассоциированный, развернутая стадия, с внеаксиальными (коксит, артрит) и внесуставными проявлениями (OU – хронический, вялотекущий увеит, OS – послеоперационная афакия; псориаз), активность высокая, ФК-3». Дебют заболевания с 15 лет (1990), начинался с артритов мелких суставов кистей и стоп. Пациент наблюдался по месту жительства с диагнозом «ревматоидный артрит», принимал НПВС (индометацин 150 мг/сут) и гидроксихлорохин 200 мг/сут в течение 2 месяцев. С 1992 г. появились боли воспалительного характера в области крестцово-подвздошных суставов, в грудном отделе позвоночника (ГОП). В 1993 г. впервые развился острый увеит слева, проводились локальные введения ГКС с эффектом. С 1995 г. возникли боли в поясничном отделе позвоночника (ПОП), при обследовании выявлен двусторонний сакроилиит 2-й стадии по Келлгрену по данным рентгенографии костей таза, в связи с чем по месту жительства установлен диагноз «спондилоартрит». С 2004 г. впервые обнаружен псориаз волосистой части головы и в области локтевого сгиба слева. До 2010 г. состояние удовлетворительное, болевой синдром в позвоночнике купировался приемом НПВС по требованию. Ухудшение состояния наблюдалось с мая 2010 г. в виде усиления болей воспалительного характера в шейном отделе позвоночника (ШОП) и ГОП. При приеме НПВС возникали многократный жидкий стул, боли в животе. В апреле 2011 г. впервые госпитализирован во 2-е ревматологическое отделение НИИР, где был назначен сульфасалазин 2 г/сут и в связи с высокой активностью заболевания, наличием факторов неблагоприятного прогноза (увеит OU, двусторонний коксит 2-й стадии – BASRI-hip, по данным рентгенографии костей таза и УЗИ тазобедренных суставов) и непереносимостью НПВС инициирована терапия ГИБП. После отмены первого ГИБП – ИНФ, далее принимал последовательно 4 иФНО-α, отмененных в связи с вторичной неэффективностью (табл. 1).
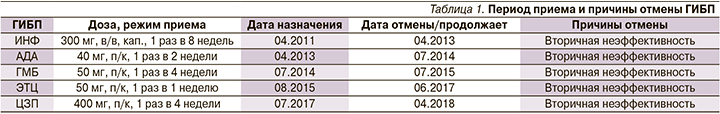
В марте 2012 г. рецидив увеита OU. С июля 2017 г. назначен метотрексат 10 мг/нед (отменил самостоятельно через 2 месяца из-за неэффективности), НПВС (вольтарен 100 мг/сут). В октябре 2017 г. в МНИИ глазных болезней им. Гельмгольца в связи с осложнением переднего увеита левого глаза выполнена операция – модифицированная синустрабекулэктомия, задняя трепанация склеры, назначены ГКС в каплях и инъекциях. Учитывая частое использование локальной терапии ГКС в связи с рецидивами увеита, на фоне чего развились осложнения (вторичная глаукома, катаракта). В январе 2018 г. начата терапия циклоспорином 200 мг/сут. В марте 2019 г. усилилась боль воспалительного ритма в ШОП, ГОП, боль в области тазобедренных суставов, в связи с чем госпитализирован в 2-е ревматологическое отделение.
Объективно при поступлении: псориатическая бляшка в области левого локтевого сустава диаметром 0,5 см.
Боль при пальпации остистых отростков ШОП и ГОП. Ограничение отведения тазобедренных суставов. Трохантерит справа. Позвоночные индексы: ротация ШОП по 65° в обе стороны, расстояние козелок–стена – 13 см, экскурсия грудной клетки – 4 см, модифицированный тест Шобера – 4 см, боковые наклоны в ПОП справа – 12 см, слева – 11 см, расстояние между лодыжками – 98 см. BASDAI – 4,2, ASDAS-СРБ – 2,2, BASFI – 2,6.
В анализах крови: СОЭ – 11 мм/ч, С-реактивный белок (СРБ) – 0,7 мг/л. По данным рентгенографии костей таза, двусторонний сакроилиит 4-й ст. по Келлгрену, двусторонний коксит 2-й ст. по BASRI-hip.
Решением консилиума рекомендовано продолжить в качестве базисного препарата прием циклоспорина 200 мг/сут. При неэффективности проводимой терапии целесообразно начать принимать секукинумаб в дозе 150 мг/мес.
Клинический пример 2
Пациент Р. 43 лет поступил во 2-е ревматологическое отделение в августе 2018 г. с диагнозом «анкилозирующий спондилит, поздняя стадия (анкилоз крестцово-подвздошных суставов, синдесмофиты во всех отделах позвоночника), активность высокая, с внеаксиальными (артриты, энтезиты) и внесуставными проявлениями (псориатическое поражение ногтей, кожи ладоней). ФН-3. Состояние после эндопротезирования тазобедренных суставов».
Из анамнеза известно, что болеет с 20 лет. Началось заболевание с боли воспалительного характера в ПОП, далее присоединились рецидивирующие артриты коленных, лучезапястных суставов, дистальных межфаланговых суставов кистей. Диагноз АС установлен по месту жительства в 2001 г., принимал различные НПВС в терапевтических дозах с постепенной потерей эффекта, сульфасалазин 2 г/сут в течение 1 года, отмененный в связи с непереносимостью (тошнота) и неэффективностью, гидроксихлорохин 200 мг/сут в течение 6 месяцев (отменен в связи с неэффективностью), метотрексат по 10 мг/нед, который принимал по 2017 г. (повышение дозы более 10 мг/нед сопровождалось тошнотой; отмена препарата в связи с неэффективностью). Ежегодно проводились неоднократные внутрисуставные и паравертебральные введения ГКС. С 2006 г. в связи с высокой активностью АС и неэффективностью предшествовавшей терапии пациенту назначен ИНФ в дозе 5 мг/кг – 500 мг каждые 8 недель с эффектом, однако периодически в связи с хорошим клиническим эффектом по месту жительства снижали дозу до 300 мг (табл. 2).
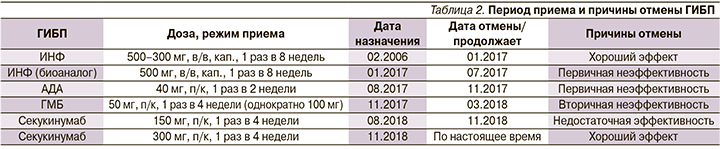
В 2015 г. в январе проведено было тотальное эндопротезирование левого тазобедренного сустава, в декабре 2015 г. – правого тазобедренного сустава. С января 2017 г. переведен на биоаналог ИНФ (фламмэгис) в дозе 500 мг, однако на его фоне обострения стали наступать каждую 3-ю неделю после инфузии, далее препарат был отменен. В августе 2017 г. была инициирована терапия АДА 40 мг, п/к, однако эффекта по истечении 12 недель достигнуто не было, препарат был отменен. Ухудшение с сентября 2017 г. началось с усиления болей воспалительного характера в ПОП, рецидива артритов коленных, плечевых, лучезапястных, голеностопных суставов, повышение СОЭ до 53 мм/ч, СРБ до 192 мг/мл.
В ноябре 2017 г. переведен на ГМБ 50 мг/мес, эффект которого сохранялся до марта 2018 г. (в июле 2018 г. была введена двойная доза ГМБ – 100 мг, что также эффекта не дало), далее вновь наблюдалось усиление болей воспалительного характера во всех отделах позвоночника, повышение уровня СРБ до 384 мг/л, СОЭ до 96 мм/ч, в связи с чем препарат был отменен.
При поступлении объективно: псориатические высыпания на коже ладоней, ониходистрофия ногтей пальцев кистей, артрит левого коленного сустава, сгибательная контрактура проксимального межфалангового сустава 5-го пальца правой кисти, сгибательная контрактура правого лучезапястного сустава (50° при сгибании), ограничение открывания рта. Выраженный грудной кифоз, боль при перкуссии остистых отростков ГОП и ПОП. Позвоночные индексы: отсутствует ротация ШОП в обе стороны, расстояние козелок-стена – 28 см, экскурсия грудной клетки – 1 см, модифицированный тест Шобера – 1 см, боковые наклоны в ПОП в обе стороны – 0,5 см, расстояние между лодыжками – 90 см.
BASDAI – 7,2, ASDAS-СРБ – 5,6, BASFI – 9,4. В анализах крови: Hb – 98 г/л, СОЭ 60 мм/ч, СРБ – 126 мг/л. По данным компьютерной томографии (КТ) ГОП – анкилоз ГОП.
Решением консилиума инициирована терапия ингибитором ИЛ-17А – секукинумабом в дозе 150 мг, п/к по схеме, однако в связи с наличием подтвержденного дерматологом псориаза кожи и ногтей решено увеличить дозу до 300 мг, п/к. На фоне данной терапии отмечается положительная динамика в виде купирования болей воспалительного характера во всех отделах позвоночника, купирования артритов и снижения острофазовых показателей воспаления крови.
Клинический пример 3
Пациент А. 31 года проходил неоднократное стационарное лечение в клинике НИИР им. В.А. Насоновой с диагнозом «анкилозирующий спондилит, HLA-B27-ассоциированный, поздняя стадия (двусторонний сакроилиит 4-й ст. по Kellgren, множественные синдесмофиты, анкилоз дугоотросчатых суставов в шейном отделе), с внеаксиальными (коксит, артрит, энтезит) и внесуставными проявлениями (рецидивирующий увеит OU), активность высокая, ФК02». Дебют заболевания возник с 12 лет (2000) с коксита слева, затем присоединился артрит правого голеностопного, правого коленного суставов. Наблюдался по месту жительства с диагнозом «реактивный артрит», был назначен курс антибиотиков пенициллинового ряда (бициллин 5) и цефалоспорин (цефазолин), НПВС при болях. В 2001 г. помимо олигоартритов нижних, верхних конечностей возникла боль воспалительного характера в ШОП, высокая лабораторная активность, анемия, паховый лимфаденит, лихорадка. Начал принимать метотрексат в дозе 15 мг/нед и НПВС регулярно, которые принимал в течение 2 лет. В 2003 г. в связи с сохраняющейся высокой активностью заболевания к терапии были добавлены циклоспорин 200 мг/сут и преднизолон 10 мг/сут, которые пациент принимал в течение 6 месяцев без эффекта. Далее присоединилась боль и ограничение движений в ПОП и ГОП, рецидивировали артриты локтевых, коленных суставов с формированием сгибательных контрактур, артрит височно-нижнечелюстных суставов с ограничением открывания рта, ограничением движений в плечевых и тазобедренных суставах. С 2006 г. впервые возник рецидирирующий увеит обоих глаз (по 2–5 обострений в год), требующий локальной терапии ГКС, на фоне чего развились кушингоид, осложненная катаракта OU. В декабре 2008 г. инициирована биологическая терапия ИНФ в дозе 400 мг по схеме (табл. 3).
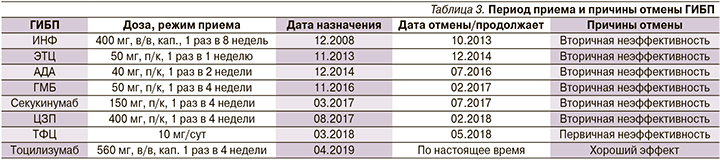
В течение первого года лечения эффект от применения препарата был хорошим, с 2010 г. продолжительность эффекта сократилась до 4 недель, в связи с чем было рекомендовано проведение инфузий через 4–6 недель в полной дозе. Одновременно пациент продолжал регулярно принимать НПВС (диклофенак 150 мг/сут или нимесулид 200 мг/сут). Однако на фоне терапии беспокоили постоянные рецидивы увеита OU, требующие локальной терапии ГКС. В октябре 2013 г. в связи с полной потерей эффекта от ИНФ пациент последовательно принимал 4 препарата ФНО-α и 1 препарат иИЛ-17А с развитием вторичной неэффективности, в связи с чем ГИБП были отменены. Также решением консилиума был назначен ТФЦ в дозе 10 мг/сут в связи с высокой активностью заболевания, однако положительного эффекта достигнуто не было. С ноября 2016 по февраль 2018 г. увеит не рецидивировал, затем в связи с обострениями увеита амбулаторно проводилась локальная терапия ГКС с временным положительным эффектом. В марте 2018 г. пациент госпитализирован во 2-е ревматологическое отделение.
При поступлении объективно: выражен шейно-грудной кифоз, боль при перкуссии остистых отростков всех отделов позвоночника. Ограничение движения во всех отделах позвоночника. Ограничение открывания рта. Сгибательная контрактура локтевых суставов. Дефигурация коленных суставов за счет экссудативно-пролиферативных явлений. Ограничение отведения тазобедренных суставов. Позвоночные индексы: ротация ШОП в обе стороны – 30°, расстояние козелок-стена – 20 см, экскурсия грудной клетки – 2 см, модифицированный тест Шобера – 2 см, боковые наклоны в ПОП справа – 7 см, слева – 8 см, расстояние между лодыжками – 52 см, BASDAI – 8,3, ASDAS-СРБ – 3,8, BASFI – 9,1. В анализах крови: гемоглобин (Hb) – 89 г/л, СОЭ – 140 мм/ч, СРБ – 172 мг/л. По данным рентгенографии костей таза: двусторонний сакроилиит 4-й ст. по Келлгрену, двусторонний коксит 4-й ст. по BASRI-hip.
Решением консилиума начата терапия тоцилизумабом в дозе 8 мг/кг (560 мг) по схеме с хорошим эффектом. Через 2 месяца в анализах крови: Hb – 124 г/л, СОЭ – 36 мм/ч, СРБ – 57,9 мг/л.
Обсуждение
Представлены клинические случаи пациентов, демонстрирующие тяжелое течение АС с высокой клинико-лабораторной активностью, наличием внесуставных проявлений и неэффективностью трех и более биологических препаратов. В настоящее время нет общепринятого алгоритма по ведению пациентов с резистентностью к стандартной терапии. Под первичной неэффективностью ГИБП предполагается недостижение критериев ответа в среднем через 12 недель после начала лечения, а под вторичной неэффективностью – изначальное снижение активности заболевания на фоне приема препарата и дальнейшая потеря эффекта.
Известно, что ряд ГИБП обладают иммуногенностью, т.е. в крови пациентов с такими заболеваниями, как ревматоидный артрит и АС, вырабатываются нейтрализующие антитела (АТП) к моноклональным антителам (МАТ), в частности ингибиторам ФНО-α [3]. То есть АТП участвуют в формировании иммунных комплексов, которые выводят МАТ из организма человека, приводя к снижению эффективности препарата [3, 4]. Есть данные, подтверждающие наличие АТП в сыворотках больных при лечении ИНФ и АДА, т.е. реакция организма человека может возникать на мышиные эпитопы, которые имеются в химерных и гуманизированных МАТ [5], в то время как при лечении ЭТЦ, т.е. гибридном МАТ, выявление АТП, хоть и в маленьком количестве, не влияло не уровень препарата в крови [6]. Однако при рассмотрении представленных в статье клинических наблюдений вторичная неэффективность наблюдалась при лечении как ИНФ, АДА, так и ЭТЦ.
В представленных клинических случаях все пациенты начинали терапию с иФНО-α – ИНФ. В первом случае наблюдалась вторичная неэффективность всех ингибиторов ФНО-α, в среднем через 12 месяцев приема каждого препарата. Помимо сохраняющейся высокой клинико-лабораторной активности заболевания у пациента наблюдался стойкий рецидивирующий увеит OU, который не купировался ГИБП, а также псориаз, в связи с чем больному рекомендовались дополнительно различные схемы базисных препаратов. В третьем клиническом наблюдении стоит отметить, что применение ЭТЦ после ИНФ не привело к достижению стойкого эффекта, т.к. ЭТЦ был отменен через 1,5 года в связи с неэффективностью. В данном случае пациент принимал не только все иФНО-α, но и иИЛ-17А, ингибитор JAK-киназ (отменены в связи со вторичной неэффективностью) и ингибитор ИЛ-6, который принимает по настоящее время.
У больного также имеется внесуставное проявление АС в виде стойкого рецидивирующего увеита OU, что значительно усложняет тактику ведения и прогноз заболевания. Во втором клиническом случае обращает на себя внимание потеря эффекта от применения ИНФ (эффект сохранялся в течение 10 лет) после перехода на биоаналог препарата. Далее наблюдалась первичная неэффективность сходного по структуре МАТ – АДА, и вторичная неэффективность ГМБ. В настоящее время клинико-лабораторный эффект достигнут на терапии ингибитором ИЛ-17А в дозе 300 мг/мес.
В последние годы исследователи активно изучают и предлагают алгоритмы по ведению пациентов с ревматическими заболеваниями (в большей степени с ревматоидным артритом), основанные на оценке иммуногенности и выявлением остаточной концентрации препарата в крови [7]. В 2018 г. были опубликованы обновленные британские рекомендации по ведению больных аксСпА, принимающих биологическую терапию, в т.ч. при первичной и вторичной неэффективности ГИБП [8]. При достижении критериев ответа на лечение пациентам рекомендуется снизить дозу биологического препарата на основании обязательного определения остаточной концентрации ГИБП и уровня АТП в крови. При вторичной неэффективности ингибитора ФНО-α рекомендуется далее назначить препарат с другим строением молекулы – ЭТЦ или секукинумаб. Известно, что одновременный прием ГИБП и метотрексата у пациентов с СпА приводит к меньшей выработке АТП [9] и как следствие – способствует сохранению эффекта терапии. Только в одном из наших наблюдений пациент длительно принимал метотрексат с иФНО-α (более 10 лет). Также большое внимания стоит уделять приверженности пациентов лечению и соблюдению строгого режима интервалов введения и рекомендуемой дозы ГИБП врачами-ревматологами.
Согласно недавно опубликованным обновленным рекомендациям Американской коллегии ревматологов (ACR) по лечению АС и нр-аксСпА, при первичной неэффективности первого иФНО-α следует назначить иИЛ-17А, при вторичной неэффективности первого иФНО-α – второй препарат из группы иФНО-α [10]. Интересно, что американские коллеги уже внесли в рекомендации возможность назначения ТФЦ при неэффективности иФНО-α и/или иИЛ-17А. Также из данного документа следует, что при сочетании активного АС и рецидивирующего увеита из ГИБП предпочтительнее назначать МАТ.
Заключение
Представленные клинические наблюдения демонстрируют пациентов с тяжелым течением АС в виде сохраняющейся высокой клинико-лабораторной активности заболевания, не поддающейся терапии несколькими ГИБП. Всех больных объединяют следующие признаки: мужской пол, ранний дебют заболевания, высокая клинико-лабораторная активность и наличие внесуставных проявлений, таких как увеит и псориаз.
Согласие пациентов. Отсутствует.



