Введение
Несмотря на весьма впечатляющие достижения современной медицины в области лечения инсульта, он остается одной из ведущих причин смертности и инвалидности среди взрослых [1]. В то время как смертность от инсульта снижается, число лиц с его последствиями, в т.ч. и в виде двигательных нарушений, увеличивается из-за роста и старения населения, что делает необходимым создание оптимальных программ реабилитации [2]. Не так давно появившиеся и активно внедряющиеся в реабилитацию новые методы восстановления движений (роботизированные методики, БОС-технологии, ботулинотерапия, виртуальная реальность, «интерфейс–компьютер–мозг» и др.) не все имеют хорошую доказательную базу и вместе с давно существующими традиционными подходами (кинезиотерапия и т.д.), эффективность которых уже доказана, не гарантируют ожидаемого функционального восстановления [3, 4]. Кроме того, надо отметить тот факт, что эффективность реабилитационных программ с различным набором методов у пациентов после инсульта сильно различается.
Существующая ситуация демонстрирует наличие многих неизвестных в реабилитационном процессе. Очевидно, что каждому пациенту необходимо составлять индивидуальный план реабилитации с учетом как неврологического дефицита, так и личностных, социально-бытовых и других аспектов жизнедеятельности [5]. Формирование реабилитационных программ невозможно без полноценной диагностики всего спектра нарушений с использованием соответствующих шкал и методов. Поэтому принципиально важно, чтобы каждый специалист знал, какие шкалы использовать, мог их применить на практике, после чего правильно интерпретировать полученные результаты и назначать необходимые реабилитационные методы [6]. Так, у пациентов с нарушениями движений в виде спастического пареза важно помимо оценки пареза, спастичности и контрактур своевременно выявлять наличие и степень выраженности чувствительных нарушений, которые влияют на тактику проведения реабилитации.
Актуальность проблеме придает и тот факт, что недавний анализ нескольких крупных исследований, оценивающих моторное восстановление после инсульта с применением обучающих технологий, фармакологических и нейромодулирующих подходов по сравнению с традиционными методами реабилитации не показал статистически значимых различий в функциональном восстановлении в исследуемых и контрольных группах пациентов, что может отражать отсутствие очевидной пользы от многих вмешательств или наличие проблем, связанных с разработкой дизайна исследований, отбором пациентов, выбором групп сравнения и конечных точек [6, 7]. Становится все более очевидным, что для получения четких алгоритмов при назначении реабилитационной программы необходимо проведение многих исследований более высокого качества. Поэтому детальный анализ отдельных клинических случаев с хорошим функциональным исходом при проведении необходимых методов обследования и на фоне индивидуально построенной реабилитационной программы до сих пор сохраняет свою ценность.
Клинический пример
Пациентка К. 41 года поступила в неврологическое отделение ФГАУ НМИЦ ЛРЦ Минздрава России 23.01.2020 с диагнозом: цереброваскулярная болезнь, последствия перенесенного нетравматического внутримозгового кровоизлияния в правой гемисфере головного мозга с прорывом крови в боковой желудочек от 24.10.2019 на фоне гипертонической болезни III ст, 3-й ст. для прохождения курса нейрореабилитации с жалобами на нарушение движений в левых конечностях: невозможность самостоятельной ходьбы и самообслуживания, трудности при одевании, приготовлении еды, проведении гигиенических процедур, занятиях спортом и в целом в быту; речевые нарушения – сложности при выговаривании и в подборе слов.
Из анамнеза известно, что пациентка длительное время проживала в Мексике, более 10 лет страдала гипертонической болезнью с максимальным повышением артериального давления (АД) – до 200/100 мм рт.ст. Контроль давления и прием антигипертензивных препаратов осуществлялись нерегулярно. Постоянно занималась спортом (теквондо) и на фоне тренировок неоднократно отмечала повышение АД. Наличие других хронических заболеваний отрицает.
На фоне физической нагрузки (во время тренировки) 24.10.2019 возникло нарушение координации, слабость в левых конечностях, нечеткость речи, рвота с последующей потерей сознания. Пациентка была госпитализирована в стационар, где был уставлен диагноз на основе клинической картины и данных компьютерной томографии (КТ).
Стационарное лечение и этап ранней реабилитации были проведены в Мексике. Наблюдалось частично восстановление речи, нарастание мышечной силы в левых конечностях, расширение навыков самообслуживания, пациентка была вертикализирована и обучена ходьбе с тростью, а затем транспортирована в Москву для продолжения реабилитации.
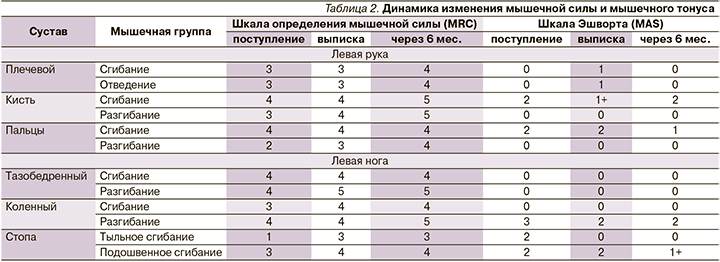
При поступлении в неврологическое отделение ФГАУ НМИЦ ЛРЦ Минздрава России при физикальном осмотре и оценке соматического статуса значимых отклонений выявлено не было. В неврологическом статусе: сознание ясное, ориентирована в пространстве, времени, собственной личности правильно. Память, внимание сохранны. Общемозговые и менингеальные симптомы не выявлены. Черепно-мозговые нервы интактны за исключением снижения чувствительности на лице слева. Неравномерный спастический левосторонний гемипарез: в верхней конечности 3 балла в проксимальных отделах, 4 балла в мышцах – сгибателях кисти и пальцев, 2 балла в мышцах – разгибателях пальцев; в нижней конечности: 4 балла в проксимальных отделах, 2 балла в тыльных сгибателях стопы. Повышение мышечного тонуса по шкале Эшворта по спастическому типу в мышцах – сгибателях локтевого сустава до 2 баллов, мышцах – сгибателях кисти и разгибателях колена до 3 баллов, в мышцах – сгибателях пальцев стопы и подошвенных сгибателях стопы до 2 баллов. Отмечено повышение сухожильных и периостальных рефлексов с рук и ног слева. Патологические стопные знаки слева (симптом Бабинского). Левосторонняя гемигипестезия, более выраженная в дистальных отделах (укол ощущался как прикосновение). Выраженное нарушение суставно-мышечного чувства в левых конечностях, больше в дистальных отделах (в крупных суставах узнавала движение, но иногда путалась). Координаторные пробы слева выполняла с мимопопаданием.
В позе Ромберга неустойчива. Функции тазовых органов контролировала. Вертикализирована. Ходьба с опорой на трость с использованием зрительного контроля.
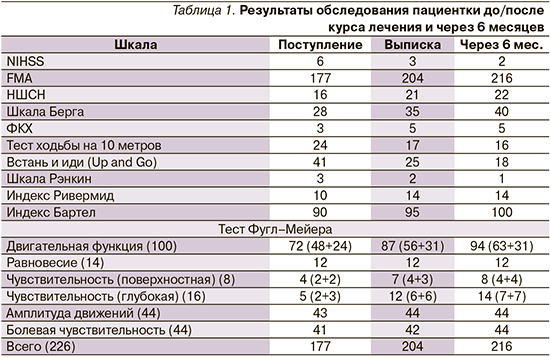
Степень тяжести неврологического дефицита по шкале Инсульта Национального института здоровья (NIHSS) составила 6 баллов (норма – 0 баллов). Общий балл в оценке двигательных функций паретичных конечностей по тесту Фугл–Мейера (FMA) – 177 баллов (норма – 226) (табл. 1). Для определения степени нарушения глубокой чувствительности использована Ноттингемская шкала сенсорных расстройств (оценка кинестетических ощущений), данные которой представлены в табл. 2.
Когнитивная и психическая сферы оценены с использованием теста MoCA, показавшего когнитивную норму 28 из 30 баллов, и госпитальной шкалы HADS – Т4, Д2.
Для исследования нарушений равновесия и функции ходьбы использовались следующие тесты: шкала Берга – 28 баллов, шкала «функциональные категории ходьбы» – 3 балла (для нуждающихся в вербальной поддержке), 10-метровый тест ходьбы – 23 секунды, Тест «Встань и Иди» (Up and Go) – 41 секунда.
 С целью оценки функциональной независимости использовались шкала Рэнкина – оценка функциональных исходов у больных, перенесших инсульт – 3 балла; индекс мобильности Ривермид – 10 (ходьба по комнате без применения вспомогательных средств); индекс активности повседневной жизни Бартела – 90 баллов.
С целью оценки функциональной независимости использовались шкала Рэнкина – оценка функциональных исходов у больных, перенесших инсульт – 3 балла; индекс мобильности Ривермид – 10 (ходьба по комнате без применения вспомогательных средств); индекс активности повседневной жизни Бартела – 90 баллов.
Проведенные лабораторные анализы (общий и биохимический анализы крови, коагулограмма, общий анализ мочи) не показали значимых отклонений от нормы.
Данные инструментальных исследований: на МРТ головного мозга от 18.01.2020 выявлены кистозно-глиозные изменения в области таламуса справа. Множественные очаги глиоза в белом веществе больших полушарий мозга. Умеренно выраженная смешанная гидроцефалия (рис. 1).
КТ-ангиография интра- и экстракраниальных сосудов от 23.01.2020: минимальный атеросклероз. Повышенная извитость внутренней сонной артерии (ВСА), левой позвоночной артерии. КТ-данные за наличие локальной аневризмы в правой ВСА интракраниально на фоне изгиба не выявлены.
Эхо-КГ от 24.01.2920: без значимых изменений.
Стресс ЭХО от 31.01.2020: проба отрицательная. При проведении отмечено резкое повышение цифр АД до 190/100 мм рт.ст.
СМАД от 24.01.2020: эпизоды повышения цифр АД макс. до 179/90 мм рт.ст.
ХМ ЭКГ от 24.01.2020: синусовый ритм, единичные желудочковые и наджелудочковые (с 1 блокированной) экстрасистолы. Вариабельная депрессия сегмента ST до 1,3 мм в зависимости от частоты сердечных сокращений.
Инструментальная оценка проприоцепции с помощью регистрации суставных углов пассивных и копирующих активных движений рук и ног в тестах, проведенных под зрительным контролем (ГО) и с закрытыми глазами (ГЗ). Результаты оценки представлены в разделе «Методика оценки проприоцептивной чувствительности и мониторинг результатов».
Исходя из данных неврологического осмотра и тестирования был выявлен спектр проблем пациентки:
- нарушение функции верхней и нижней конечностей вследствие снижения мышечной силы, повышения мышечного тонуса, снижения поверхностной и глубокой чувствительности;
- нарушение функции ходьбы: ходьбы на дальние расстояния, по разным поверхностям и с препятствиями, передвижение в общественных местах вследствие подворота и недостаточности тыльного сгибания стопы;
- нарушение активной функции верхней конечности, а именно: манипулирования предметами левой рукой во время одевания, еды, гигиены, затруднения в самообслуживании и др. из-за трудностей в супинации предплечья, разгибания кисти и пальцев.
Пациентке была назначена реабилитационная программа, которая проводилась с 23.01.2020 по 12.03.2020 (табл. 3).
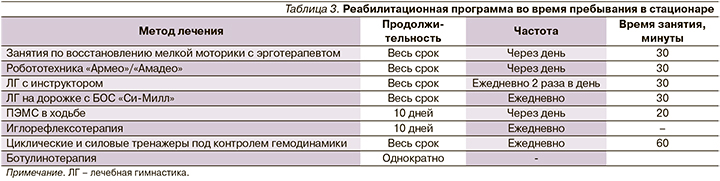
Восстановление активной функции верхней конечности проводилось путем наращивания мышечной силы, улучшения чувствительности и ловкости движений с помощью занятий по восстановлению мелкой моторики с эрготерапевтом в течение 30 минут (через день), занятий на робототехнике «Армео»/«Амадео» 30 минут (через день) и лечебной гимнастики с инструктором по 30 минут 2 раза в день (ежедневно) с использованием зрительного контроля перед зеркалом. Для повышения активности во время занятий с эрготерапевтом и инструктором по лечебной физкультуре подбор заданий проводился индивидуально.
Для улучшения стереотипа ходьбы, повышения устойчивости и скорости ходьбы проводились занятия по наращиванию мышечной силы в нижней конечности, уменьшению чувствительных нарушений и тренировке правильного паттерна ходьбы с помощью лечебной гимнастики на дорожке с БОС «Си-Милл» 30 минут (ежедневно), программируемой электромиостимуляции (ПЭМС) в ходьбе (№ 10) и лечебной гимнастики с инструктором 30 минут 2 раза в день (ежедневно) с использованием зрительного контроля перед зеркалом. Для стимуляции чувствительности в конечностях проведены также 10 сеансов иглорефлексотерапии.
Кроме того, ввиду наличия низкой толерантности к физическим нагрузкам в виде повышения цифр АД во время занятий, резко ограничивающих пациентку в реабилитации, под контролем специалиста по кардиореабилитации проводились тренировки на циклических и силовых тренажерах под контролем гемодинамики по 60 минут (ежедневно).
Методика оценки проприоцептивной чувствительности и мониторинг результатов
Пациентке проводили объективную оценку проприоцептивной чувствительности (ПЧ) движений во всех суставах в паретичных верхней и нижней конечностях. Оценке подлежали те суставы, в которых было выявлено значимое ограничение объема движений, влияющих на функцию конечности: сгибание-разгибание в лучезапястном суставе, пронация–супинация предплечья [8] и в голеностопном суставе – сгибание–разгибание стопы. Обязательным считался критерий отсутствия неврологических и ортопедических нарушений, ограничивающих диапазон пассивных движений в суставах рук и ног. У пациентки во всех суставах верхних и нижних конечностей сохранялся нормальный диапазон пассивных движений.
Испытуемой в положении сидя с закрытыми глазами производили серию варьирующих по амплитуде и скорости пассивных циклических тест-движений, во время выполнения которых она должна была копировать их активными движениями условно-здоровых руки и ноги. Используя систему ProprioSense (ООО «НейроБиоЛаб», Россия) с помощью беспроводных инерционно-магнитометрических сенсоров, регистрировали углы в тестируемом суставе и таком же суставе других конечностей (руки и ноги) (рис. 2).
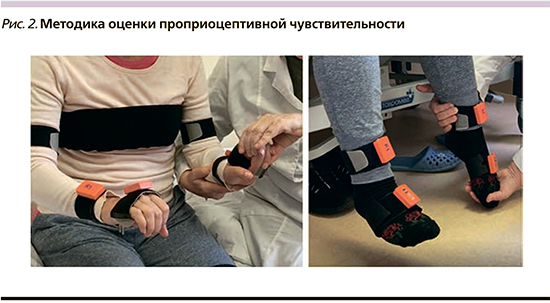
О состоянии ПЧ судили по степени схожести «активных» и «пассивных» движений, оценку которой производили по объективным качественным характеристикам (совпадению движений по локализации, числу и направлению) и четырем количественным показателям: коэффициентам, определяющим схожесть движений по амплитуде (1) и форме (2), а также латентности начала копирования (3) и средней латентности повторных циклических копирующих движений (4). Степень сохранности ПЧ тестируемых движений оценивали по условному критерию нормы (УКН). ПЧ рассматривалась: а) как сохранная, если копирование осуществлялось качественно правильно и по количественным показателям, соответствовавшим нормативным границам, б) как сниженная, если копирование выполнялось качественно верно, но недостаточно точно по количественным показателям, в) как более сильно нарушенная, если копирование происходило с ошибками качественного характера, г) как отсутствующая, если копирования вообще не выполнялось [9].
Чтобы исключить влияние на результаты тестирования когнитивных факторов (способности пациента понять двигательную задачу), а также оценить возможность условно-здоровой руки выполнять эту задачу, перед каждым тестированием с закрытыми глазами пациентке предлагали выполнять копирование под зрительным контролем пассивных движений. Инструментальное исследование ПЧ движений паретичных руки и ноги у пациентки проводилось дважды: при поступлении в клинику и после серии реабилитационных процедур.
При первичном тестировании выявлено, что под зрительным контролем пассивные движения в обследуемых суставах паретичных руки и ноги пациентка практически одновременно и с высокой точностью копировала их другими рукой и ногой (рис. 3, ГО). Все выполненные копирования соответствовали УКН, что свидетельствовало о том, что пациентка хорошо понимала двигательные задачи тестов и способна выполнять их условно-здоровыми рукой и ногой.
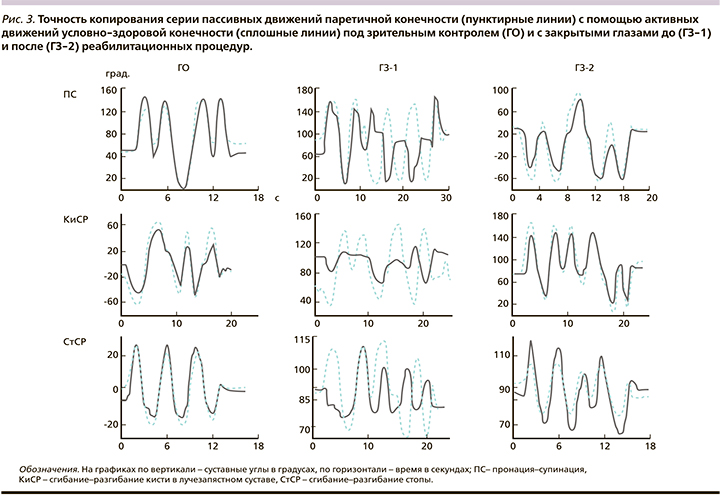
В тестах с закрытыми глазами точность копирования движений резко нарушалась. Все движения были воспроизведены с грубыми ошибками качественного характера: активные и пассивные движения были асинхронными (КиСР), отличались по форме, направлению и числу (ПС, СтСР) (рис. 3, ГЗ-1), что указывало на существенные нарушения проприоцептивного восприятия этих движений.
При повторном обследовании выявлено существенное улучшение точности копирования с закрытыми глазами (рис. 3, ГЗ-2). Все движения были не только воспроизведены качественно правильно, но и соответствовали УКН по количественным показателям. На основании полученных результатов можно заключить, что в результате реабилитационных процедур у пациентки восстановилась проприоцептивная чувствительность в дистальных отделах конечностей.
При хорошей переносимости занятий и, как следует из табл. 1, после прохождения курса реабилитации была отмечена положительная динамика. Наросла мышечная сила в паретичных конечностях. Наибольший эффект был отмечен в увеличении объема движений при разгибании кисти и тыльного сгибания стопы.
Однако на фоне нарастания мышечной силы, спастичность мышцах сгибателях лучезапястного сустава, мышце круглом пронаторе и мышцах подошвенных сгибателях стопы стала значимо ограничивать движения разгибания в лучезапястном суставе, супинации предплечья и разгибания стопы (табл. 2), что затрудняло ряд манипуляций рукой, сказывалось на ходьбе (вследствие подворота стопы) и потребовало проведения ботулинотерапии. Под контролем ультразвука была выполнена инъекция абоботулотоксина типа А (Або-БТА; препарат Диспорт®) в мышцы сгибатели лучезапястного сустава: лучевой сгибатель кисти (m. flexor carpi radialis) – 150 ЕД и локтевой сгибатель кисти (m. flexor carpi ulnaris) – 100 ЕД, мышцу, пронирующую предплечье – круглый пронатор (m. pronator teres) – 150 ЕД, а также в мышцы, участвующие в супинации стопы: икроножную (m. gastrocnemius) – 200 ЕД и заднюю большеберцовую (m. tibialis posterior) – 150 ЕД. Суммарно – 750 ЕД Або-БТА. Оценка мышечного тонуса проведена через 4 недели после инъекции – при выписке и через 6 месяцев, когда пациентка приехала на повторный курс реабилитации. Отмечено снижение мышечного тонуса и уменьшение спастичности, а также улучшение активной функции верхней конечности (стала вовлекать левую руку в выполнение бытовых бимануальных навыков), о чем свидетельствовало увеличение количества баллов по функциональным шкалам; а также уменьшение подворота стопы и как следствие – увеличение скорости ходьбы и устойчивости в ходьбе: стала ходить без трости (см. табл. 1).
Отмечено уменьшение выраженности чувствительных нарушений, что позволило пациентке больше задействовать руку в повседневной жизни (одеваться, готовить, заниматься спортом, держать телефон, книгу, нажимать кнопки в лифте и др.).
Одномоментно с уменьшением выраженности моторных и чувствительных нарушений, нарастанием мышечной силы в верхней конечности (табл. 1), произошел регресс чувствительных нарушений в нижней конечности, что улучшило баланс при ходьбе и повысило ее скорость. Постоянная концентрация на правильной постановке ноги сначала уменьшила скорость ходьбы, но положительно сказалась на устойчивости и на момент окончания курса реабилитации (табл. 1, 2) пациентка стала полностью независима в ходьбе.
Ежедневные тренировки на циклических и силовых тренажерах под контролем кардиореабилитолога позволили нормализовать гемодинамику и дали возможность полноценно заниматься лечебной гимнастикой и постепенно увеличивать нагрузку.
Амбулаторно пациентка продолжила занятия самореабилитацией 3–4 часа в день – лечебной гимнастикой по отработанным методикам: ежедневные тренировки, направленные на увеличение растяжимости мышц паретичных конечностей, а также выполнение функциональных упражнений с большим количеством повторений под контролем инструктора ЛФК. Периодически добавлялись электростимуляция, занятия с ТРХ-петлями, занятия с использованием виртуальной реальности, плавание, танцы, скандинавская ходьба.
Через шесть месяцев (в сентябре 2020 г.) повторно было проведено обследование пациентки с использованием всех вышеперечисленных шкал, результаты которого показали не только сохранение эффекта, полученного на фоне продолженной реабилитации эффекта, но и дальнейшую положительную динамику в восстановлении нарушенных функций конечностей (табл. 2, 3).
На фоне амбулаторно проводимых занятий отмечалось улучшение функции верхней конечности за счет увеличения объема активных движений, что позволило пациентке задействовать левую руку в быту. Она начала носить предметы весом более 2 кг в левой руке, держать поднос обеими руками и опираться на скандинавские палки при ходьбе. Также наблюдалось дальнейший регресс чувствительных нарушений.
Положительная динамика в нижней конечности проявилась в виде практически полного восстановления глубокой чувствительности в голеностопном суставе (стала выполнять все движения с открытыми и закрытыми глазами с незначительными погрешностями в соблюдении углов и скорости повторения пассивных движений), что положительно сказалось на ходьбе. Походка стала устойчивее и увереннее за счет уменьшения подворота стопы и более правильной постановки стопы. Появилась возможность ходьбы на дальние расстояния (более 1 км) и ускорения темпа ходьбы, подъема по лестнице, используя обе ноги для опоры, и ходьбы по пересеченной местности без вспомогательных приспособлений.
Обсуждение
Реабилитация пациентов после инсульта является важной медицинской и социальной проблемой. Среди лиц, выживших после инсульта, примерно 80% имеют двигательные нарушения. В 73–88% нарушение функции верхней конечности возникает уже в остром периоде заболевания, а в 55–75% – в отдаленном. Около 80% пациентов испытывают трудности при ходьбе из-за нарушения функции нижней конечности; 26% становятся полностью зависимыми от окружающих вследствие тяжелых двигательных нарушений [10]. Двигательные нарушения после инсульта ограничивают не только жизнь пациентов, родственников и лиц, осуществляющих уход, а также влекут за собой большие финансовые затраты семьи и общества [11]. Более 40% пациентов после инсульта имеют двигательные нарушения вследствие спастического пареза в конечностях. Снижение мышечной силы вызывает нарушение функции конечностей; спастичность приводит к укорочению мышц и неиспользованию их, является причиной боли, ведет к появлению контрактур и других вторичных осложнений и других проблем; и на коррекцию этих двух факторов в первую очередь должна быть направлена двигательная реабилитация [12]. Кроме того, нарушение чувствительности, главным образом проприоцептивной, возникает у 70% пациентов, перенесших инсульт [13], что требует своевременного выявления и коррекции. Проприоцептивная чувствительность играет решающую роль в управлении движениями и двигательном обучении [14], поэтому ее сохранность рассматривают как важный прогностический показатель возможности восстановления двигательной функции.
Понимание патогенеза возникновения спастического пареза, своевременная и всесторонняя оценка всех его составляющих, использование комплекса шкали определение всего спектра проблем пациента с последующим составлением реабилитационной программы с включением максимально эффективных для каждого конкретного пациента набора методов [15] – залог успешного восстановления, хотя и не гарантирует 100%-ного успеха и функциональной независимости пациента [16].
В представленном клиническом случае у пациентки молодого возраста, перенесшей инсульт, зафиксировано хорошее восстановление двигательных и чувствительных функций конечностей. Такого результата удалось добиться благодаря своевременной и полноценной оценке неврологического дефицита, определению основных проблем, нарушающих нормальную жизнедеятельность пациентки и адекватно составленной реабилитационной программе с набором как традиционных, так и инновационных технологий, а также реализации принципа продолженной самореабилитации на амбулаторном этапе [17]. Включение метода оценки ПЧ привело к добавлению в реабилитационную программу занятий ЛФК под зрительным контролем, использованию БОС-технологий, а использование ботулинотерапии в связи с развитием спастичности в отдельных мышцах также позволило повысить эффективность реабилитационных мероприятий.
Ботулинотерапия является инновационным направлением в реабилитации пациентов со спастичностью. Препараты БТА уже несколько десятилетий с успехом используются с целью снижения спастичности, улучшения пассивной и активной функции верхних и нижних конечностей в нейрореабилитации в разные периоды после инсульта. Особенно перспективным является раннее начало использования ботулинотерапии. Проблема ранней спастичности актуальна для пациентов уже в остром периоде инсульта, поскольку она существенно ограничивает возможности восстановления нарушенных функций и ухудшает реабилитационный прогноз [16]. Вместе с тем универсальных стандартов или клинических алгоритмов ведения таких больных в настоящее время не существует. Принято считать, что ботулинотерапия должна проводиться не ранее чем через 3 месяца от момента развития инсульта больным со стабильными витальными функциями. Выбор «мышц–мишеней» и доз препарата производится индивидуально в зависимости от клинического паттерна [18]. Однако некоторые мультицентровые исследования показали безопасность и эффективность раннего проведения ботулинотерапии. Так одно из них R. Rosales et al. продемонстрировало безопасность и эффективность раннего (от 2 до 12 недель после инсульта) введения ботулотоксина (Або-БТА) больным со спастичностью ≥2 баллов по шкале Эшворта. Было отмечено длительное снижение мышечного тонуса (до 24 недель), что может быть использовано для активных занятий моторным восстановлением конечности [19, 20] и препятствовать дальнейшему развитию симптомов или прогрессированию спастичности. Интересно и то, что ботулинотерапия была эффективна и в более поздние сроки после очагового поражения головного мозга. Так, в двух исследованиях J.M. Gracies et al. было показано статистически значимое снижение мышечного тонуса и увеличение объема активных движений на фоне инъекций БТА (Або-БТА). А при проведении повторных циклов ботулинотерапии отмечено увеличение интервалов между инъекциями и большая удовлетворенность пациентов результатами проведенного лечения. Стоит отметить, что повторные инъекции Або-БТА способствуют улучшению функциональных показателей. Так в исследовании ALL отмечалось улучшение скорости ходьбы на 25%, что позволило пациентам перейти в более высокий функциональный класс ходьбы, позволяющий самостоятельно передвигаться в общественных местах без посторонней помощи, что значительно улучшает качество жизни пациентов [21, 22].
На сегодняшний день уже очевидно, что помимо проведения курсов реабилитации в условиях стационара необходимо ее продолжение амбулаторно. Однако существует сложность обеспечения пациентов со спастическим парезом после инсульта непрерывными комплексными и интенсивными программами реабилитации. В связи с чем возрастает важность вовлечения пациентов в двигательную реабилитацию, проведение самостоятельных занятий кинезиотерапией амбулаторно. Во многих странах мира уже разработаны и внедряются в практику программы двигательной амбулаторной реабилитации. Так, во Франции при поддержке компании Ипсен была создана программа GSC «I-CAN», которая представляет собой специальный ЛФК-комплекс, применяющийся в двигательной реабилитации, разработанный на основе знаний физиологии нервной системы, механизмов развития нейропластичности, принципов моторного контроля и двигательного обучения. Программа включает длительные ежедневные тренировки, направленные на увеличение растяжимости мышц, а также выполнение упражнений с большим количеством повторений, которые снижают ко-контракцию мышц – аномальное вовлечение мышц-агонистов в движение, осуществляемое мышцами-антагонистами.
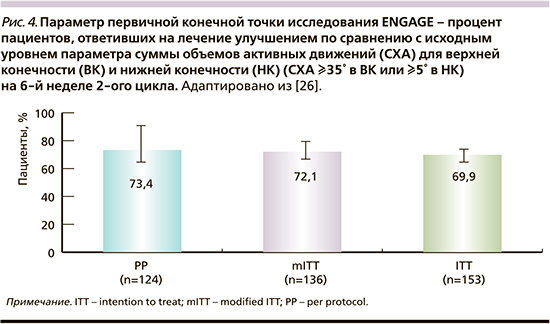
В ряде исследований показано, что совместное применение ботулинотерапии и программы направленной самореабилитации (GSC) позволяет значительно увеличить скорость ходьбы, в т.ч. и пациентам после очагового поражения мозга в позднем восстановительном периоде [24, 25]. Недавно проведенное международное многоцентровое исследование ENGAGE, посвященное оценке эффективности инъекций Або-БТА в мышцы нижней и верхней конечностей, в сочетании с программой, направленной самореабилитации взрослых пациентов со спастическим гемипарезом с оценкой объема активности движений в целевых мышечных группах, наглядно продемонстрировало высокие результаты данной стратегии (рис. 4) [26]. Проведенное исследование показало, что одномоментное применение инъекций Або-БТА в верхние и нижние конечности и проведение индивидуальной программы двигательной реабилитации GSC было ассоциировано со значительным увеличением объема активных движений (CXA), улучшением активной функции конечностей и качества жизни у пациентов с хроническим спастическим гемипарезом по сравнению с исходным уровнем.
Таким образом, можно утверждать, что ботулинотерапия и программы продолженной самореабилитации должны быть обязательными компонентами реабилитационных программ пациентов со спастическими парезами после инсульта. Актуальна и разработка критериев, позволяющих добиваться максимальной персо-нификации ботулинотерапии в структуре общей концепции реабилитации [23].
Выводы
Оценка неврологического дефицита с определением степени выраженности двигательных и чувствительных нарушений, спастичности, а также знание и оценка предикторов ее развития у пациентов со спастическим парезом после инсульта важны для составления таргетной реабилитационной программы.
Ботулинотерапия является современным, высокоэффективным и безопасным методом коррекции спастичности. Включение ее в реабилитационные схемы необходимо для улучшения функции конечности. Методика выявления чувствительных нарушений в конечностях и дальнейших тренировок по ее восстановлению может быть рекомендована для включения в реабилитационные программы данной категории пациентов.
Однако необходимо проведение дальнейших наблюдений и исследований по оценке эффективности и безопасности данного метода.
Источник финансирования. Работа частично поддержана грантом РФФИ 19-015-00264/19.



