Введение
Когнитивные расстройства у пациентов, перенесших ишемический инсульт (ИИ), занимают в общей классификации до 80%. Именно они могут затруднять реабилитацию человека, заметно ухудшая общее качество его жизни, а также увеличивая вероятность развития повторного инфаркта головного мозга [1, 2].
Стоит отметить, что в позднем восстановительном периоде ИИ в процессе восстановления у пациентов при проведении реабилитационных мероприятий заметна разница между формальным восстановлением двигательных функций и когнитивными нарушениями как физического, так и эмоционального характера, которые довольно часто приносят значительные неудобства больным и являются основной мишенью для проведения терапевтических мероприятий [3, 4].
В последние несколько лет особенно часто в реабилитации пациентов, перенесших ИИ, применяется транскраниальная магнитная стимуляция (ТМС), которая, продуцируя электрическое поле, воздействует с помощью высокоинтенсивного магнитного поля на поврежденную центральную нервную систему, стимулируя появление новых синаптических цепей, в т.ч. активируют остаточные нейроны, а также улучшает кровообращение в регионарных сосудах [5–8].
Цель исследования: изучение оценки эффективности транскраниальной магнитной стимуляции в комплексном лечении пациентов с КР в позднем восстановительном периоде ИИ.
Методы
В 2017–2019 гг. было проведено нерандомизированное проспективное исследование на базе неврологического отделения БУЗ ВО «Воронежская городская клиническая больница скорой медицинской помощи № 1, Поликлиника БУЗ ВО «Острогожская районная больница», ООО «Европейская клиника «Сиена-мед», в которое были включены 200 пациентов неврологического профиля, перенесших цереброваскулярную болезнь с острым нарушением мозгового кровообращения (ОНМК) по ишемическому типу, в позднем восстановительном периоде.
Все пациенты были разделены на две группы: I (основную) группу – 100 пациентов (52 мужчины и 48 женщин в возрасте 45–75 лет) и II (контрольную) группу – 100 больных (55 мужчин и 45 женщин в возрасте 45–75 лет).
Через 6 месяцев от момента выписки из стационара начинали лечение когнитивных нарушений у пациентов обеих групп с ИИ в позднем восстановительном периоде. При проведении исследования главными контрольными точками были «исходные данные», «3 месяца» и «6 месяцев» (начальный этап, затем середина лечения и завершение срока наблюдения). Этапы в 1, 2, 4 и 5 месяцев являлись промежуточными и служили для контроля динамики лечебных мероприятий.
Вмешательства, которые проводились в группах наблюдений, включали стандартный комплекс лечебно-реабилитационных мероприятий, применяемых в неврологии (в обеих исследуемых группах комплекс применялся в равной степени). Все лечебные мероприятия проводились по официальным методикам, зарегистрированным в РФ и утвержденным Минздравом РФ, а также Национальной ассоциацией по борьбе с инсультом РФ.
Схема лечения на весь период наблюдения включала комплексную нейрометаболическую медикаментозную терапию+лечебные мероприятия сопутствующей кардиальной патологии, которую получали обе группы пациентов: мемантина гидрохлорид 10 мг/сут в течение 6 месяцев, раствор цитиколина в дозе 1000 мг по 10 мл 1 раз в сутки внутрь в течение 6 месяцев.
При наличии сопутствующей артериальной гипертензии, гипер-, дислипидемии применяли антигипертензивные препараты, статины (выбор, дозировку, кратность применения проводил врач-кардиолог).
Метод ТМС применяли в отношении пациентов основной группы с программой лечебных мероприятий: в 1-й и 2-й месяцы проводили по 20 сеансов, на 3-м месяце был перерыв, в 4-й месяц проведено еще 10 сеансов, на 5-м месяце – перерыв и на 6-м – 10 сеансов ТМС с помощью аппарата «Magstim Super Rapid» (The Magstim Company Ltd., Великобритания).
Эффективность лечения оценивалась с помощью методов количественной оценки дефицита неврологического и ассоциированных с ним состояний с помощью метода интегральных шкал (скандинавская шкала инсульта SSSG – Scandinavian Stroke Study Group, шкала инсульта национального института здоровья NIHSS – National institutes of health stroke scale, шкала Barthel Index, шкала Rankin); количественной оценки основных когнитивных функций с помощью метода нейропсихологического тестирования (тесты для оценки внимания, восприятия, памяти, интеллектуальных функций, нарушений функции речи, шкала MMSE – Mini-mental State Examination).
Критерии включения пациентов в исследование:
- возраст 45–75 лет; наличие диагноза ОНМК по ишемическому типу;
- поздний восстановительный период.
Критерии невключения пациентов в исследование: несоответствие критериям включения.
Критерии исключения пациентов из исследования:
- ОНМК в остром и раннем восстановительном периодах ИИ;
- геморрагический инсульт;
- пациенты с диагнозом деменция, которая диагностирована до первичного ИИ;
- наличие тяжелой соматической патологии в стадиях частичной компенсации или декомпенсации;
- неотложные состояния, требующие экстренной медицинской помощи;
- пациенты с психической патологией, требующие лечения у соответствующего специалиста.
Для статистической обработки полученных данных в результате проведенного исследования, информации и анализа данных было проведено нерандомизированное проспективное исследование, направленное на сравнительную оценку эффективности традиционных методов лечения и новых разработанных схем лечебных мероприятий, направленных на коррекцию синдрома когнитивной дисфункции у пациентов, перенесших ИИ. Статическая обработка полученных данных была выполнена с помощью совокупности программ, применяемых для статистического анализа, а также с помощью Мастера диаграмм в программе Microsoft Excel 2010 г., пакета прикладных программ Statistica 6,0.
Результаты
Оценка исходных среднестатистических значений по всем указанным показателям, которые были получены в исходном состоянии, а также данные, которые получились при внутригрупповом распределении согласно степени тяжести состояния пациентов, не имели каких-либо значимых различий между исследуемыми группами (р=1,000000 во всех регистрируемых случаях статистических сравнений).
Результаты интегрированной оценки когнитивной дисфункции по шкале MMSE в контрольной и основной группах составили соответственно:
- на этапе начала наблюдения: по 15,29±2,55 балла;
- на этапе середины наблюдения: 16,33±2,72 и 17,38±2,90 балла;
- на этапе завершения наблюдения: 17,51±2,91 и 20,02±3,34 балла соответственно.
Статистический анализ выявил отсутствие статистически значимых различий интегрированного показателя когнитивной дисфункции по MMSE на этапе исходных данных (параметрический t-критерий Стьюдента для несвязанных выборок; р=1,000000) и их наличие на середине (р=0,044799) и окончании (р=0,031927) периода наблюдения (параметрический t-критерий Стьюдента для несвязанных выборок). За весь период наблюдения в обеих группах на этапах наблюдения: «исходное», «1-й» и «2-й» месяцы лечения динамика когнитивной дисфункции оставалась без статистически значимых динамических изменений (р>0,05), на этапах наблюдения «3-й», «4-й», «5-й» и «6-й» месяцы лечения их положительные динамические изменения имели место (р>0,05). При этом, согласно данным, они лучше были выражены в основной группе.
Распределение значений интегрированного показателя когнитивной дисфункции по MMSЕ по градациям в обеих группах по основным этапам наблюдения имело следующую картину (рис. 1).
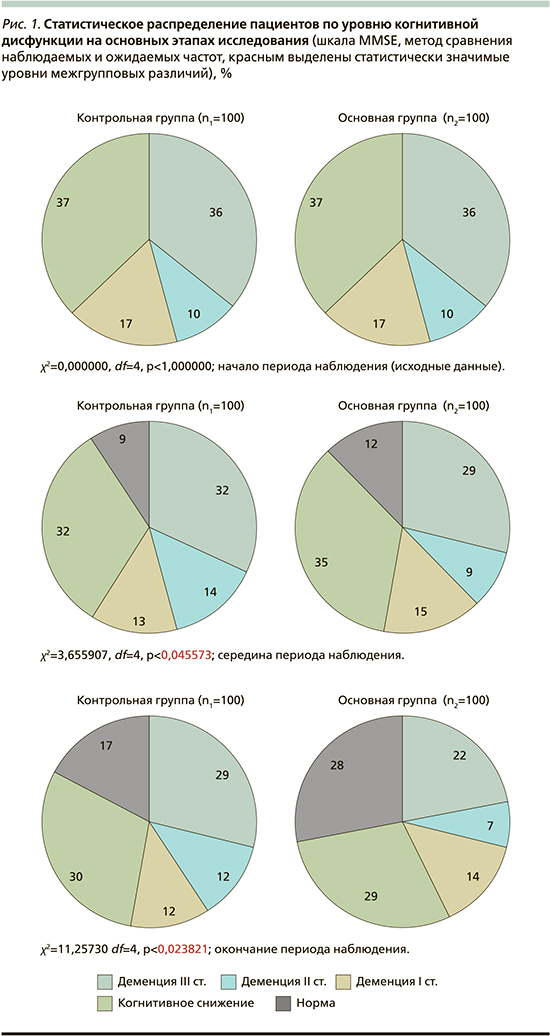
Относительное число пациентов, соответствующих по MMSE состояниям нормы, когнитивного снижения, деменции легкой, умеренной и тяжелой, составило:
1. на этапе начала наблюдения:
- в контрольной группе (n1=100): 0%, 37, 17, 10, 36%;
- в основной группе (n2=100): 0%, 37, 17, 10, 36%;
2. на этапе середины наблюдения:
- в контрольной группе (n1=100): 9%, 32, 13, 14, 32%;
- в основной группе (n2=100): 12%, 35, 15, 9, 29%;
3. на этапе завершения наблюдения:
- в контрольной группе (n1=100): 17%, 30, 12, 12, 29%;
- в основной группе (n2=100): 28%, 29, 14, 7 и 22% соответственно.
Таким образом, выявлено полное совпадение внутригрупповых распределений в начале периода наблюдения и их несовпадение на этапах его середины и окончания. Соответственно, статистический анализ показал в этом случае отсутствие значимых межгрупповых различий на этапе исходных данных (χ2=0,000000, df=4, p<1,000000) и их наличие на этапах середины (χ2=3,655907, df=4, p<0,045573) и окончания (χ2=11,25730, df=4, p<0,023821) периода наблюдения (метод сравнения наблюдаемых и ожидаемых частот, критерий согласия Пирсона χ2).
При анализе состояния статистической «структуры» сравниваемых групп по градациям состояния интегрированного показателя когнитивной дисфункции по MMSE на текущем этапе исследования по сравнению с его началом было установлено, что в контрольной группе (n1=100) имели место следующие изменения:
- на этапе середины периода наблюдения по сравнению с его началом: расширение секторов пациентов «норма» на 9% и «деменция среднетяжелой степени» на 4% на фоне сужения секторов «когнитивное снижение» на 5%, «деменция легкой степени» и «деменция тяжелой степени» на 4 и 4% соответственно; увеличение сектора пациентов с деменцией среднетяжелой степени может быть объяснено переходом пациентов из сектора пациентов с деменцией тяжелой степени, в этом случае это следует рассматривать, как положительное изменение;
- на этапе окончания периода наблюдения по сравнению с его серединой: расширение секторов пациентов «норма» на 8%;
в основной группе (n2=100) наблюдалось:
- на этапе середины периода наблюдения по сравнению с его началом расширение сектора пациентов «норма» на 12% на фоне сужения секторов «когнитивное снижение» на 2%, «деменция легкой степени» на 2%, «деменция среднетяжелой степени» на 1% и «деменция тяжелой степени» на 7% соответственно;
- на этапе окончания периода наблюдения по сравнению с его серединой дальнейшее расширение сектора пациентов «норма» еще на 16% на фоне сужения секторов «когнитивное снижение» на 6%, «деменция легкой степени» на 1%, «деменция среднетяжелой степени» на 2% и «деменция тяжелой степени» на 7% соответственно.
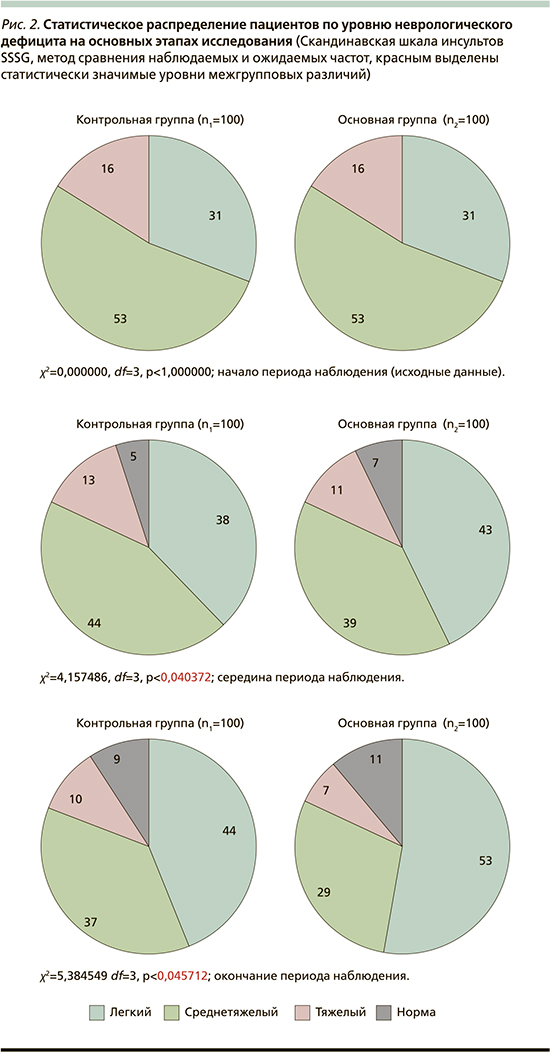
Распределения показателя неврологического дефицита, определяемого по SSSG, по градациям в обеих группах составили (рис. 2) относительное число пациентов, соответствующих состояниям «норма», «легкий», «среднетяжелый» и «тяжелый неврологический дефицит»:
на этапе середины периода наблюдения:
- в контрольной группе (n1=100): 5%, 38, 44 и 13%;
- в основной группе (n2=100): 7%, 43, 39 и 11% соответственно.
Выявлено несовпадение внутригрупповых распределений. Соответственно, статистический анализ показал наличие межгрупповых различий (метод сравнения наблюдаемых и ожидаемых частот, критерий согласия Пирсона χ2=4,157486, df=3, p<0,040372).
на этапе окончания периода наблюдения:
- в контрольной группе (n1=100): 9%, 44, 37 и 10%;
- в основной группе (n2=100): 11%, 53, 29 и 7% соответственно.
Также выявлено несовпадение внутригрупповых распределений. Статистический анализ показал в этом случае наличие межгрупповых различий (метод сравнения наблюдаемых и ожидаемых частот, критерий согласия Пирсона χ2=5,384549, df=3, p<0,045712).
Таким образом, оценка по Скандинавской шкале инсультов показала в основной группе по сравнению с контрольной снижение как «среднестатистического» уровня неврологического дефицита, составляющего 6,3%, так и более адаптивное перераспределение пациентов по степеням его тяжести.
Результаты оценки по баллу Оргогозо в контрольной и основной группах составили 55,9±5,99 и 58,8±6,04 балла.
Статистический анализ выявил наличие межгрупповых различий показателя «уровень неврологического дефицита по баллу Оргогозо» на этапе окончания периода наблюдения (t-критерий Стьюдента для несвязанных выборок; р=0,043999).
Результаты оценки по шкале Rankin в контрольной и основной группах составили 2,7±0,73 и 2,5±0,52 балла.
Статистический анализ выявил наличие межгрупповых различий показателя «уровень неврологического дефицита по шкале Rankin» на этапе окончания периода наблюдения (t-критерий Стьюдента для несвязанных выборок; р=0,043375).
Результаты оценки по Barthel index в контрольной и основной группах составили 59,37±8,94 и 63,12±9,91 балла.
Статистический анализ выявил наличие межгрупповых различий показателя «уровень неврологического дефицита по шкале Barthel index» на этапе окончания периода наблюдения (t-критерий Стьюдента для несвязанных выборок; р=0,042877).
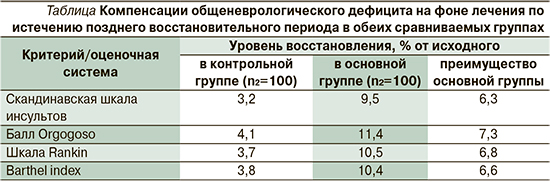
Уровни компенсации общеневрологического дефицита на фоне лечения по истечению позднего восстановительного периода в обеих сравниваемых группах, а также выявленные преимущества основной группы представленные в таблице, свидетельствуют о том, что:
- в обеих сравниваемых группах объективно имеет место некоторое снижение неврологического дефицита, причем распределение его степеней тяжести также меняется как внутри групп (в сторону меньших степеней тяжести), так и между группами (в пользу основной группы);
- сравниваемые группы после завершения периода наблюдения с использованием в них изучаемых подходов к лечению когнитивной дисфункции имеют статистически значимые различия как по параметрам общего неврологического дефицита (SSSG, балл Оргогозо), так и по показателям нарушений качества жизни по уровню нарушения жизнедеятельности (шкала Rankin) и функциональной независимости пациента в повседневной жизни (Barthel index); уровень улучшения в основной группе по сравнению с контрольной составляет от 6,3 до 7,3%.
Обсуждение
Оптимизация лечения ИИ в позднем восстановительном периоде, основанная на включении в его состав ТМС, приводит к улучшению не только частных когнитивных функций: внимания, восприятия, памяти, моторной речи и праксиса (не оказывая никакого существенного влияния на функцию интеллекта), но когнитивного статуса в целом, что подтверждается статистически результатами его интегрированной оценки.
Заметным явилось то, что совершенствование терапии позднего восстановительного периода ИИ на фоне включения в ее состав ТМС по окончании периода наблюдения улучшило не только результаты лечения когнитивной дисфункции, но и общего неврологического дефицита.
Исходя из приведенных данных, уровень улучшения качества жизни пациентов в основной (первой) группе по сравнению с контрольной группой составил от 6,2 до 7,4%.
Научная гипотеза о том, что включение в состав комплексных неврологических лечебных и реабилитационных мероприятий ТМС способствует восстановлению когнитивных функций, что доказано достигнутым уровнем их улучшения по параметрам внимания, восприятия, памяти, моторной речи и праксиса, а также подтверждено статистически значимыми преимуществами основной группы по сравнении с контрольной группой.
Необходимо отметить, что полученные количественные результаты, подтверждающие выдвинутые научные гипотезы, имеют высокий уровень статистической значимости (р<0,05 во всех декларируемых случаях межгрупповых различий).
В аспекте воздействия на восстановление базисных когнитивных функций, а также на общий уровень неврологического дефицита эффективность данной методики комплексного лечения выше по сравнению с «традиционным подходом» лечения.
Заключение
ИИ остается чрезвычайно актуальным медико-социально значимым заболеванием. Результаты лечения его последствий часто остаются неудовлетворительными. При этом известно, что исследования этой проблемы сосредоточены в основном в острой фазе процесса или раннем восстановительном периоде, позднему восстановительному периоду уделяется внимание незаслуженно меньше. Также следует отметить, что в семиотике постинсультных поражений помимо моторных и сенсорных нарушений большое значение имеет синдром когнитивной дисфункции, но его лечение в названном периоде также изучается недостаточно.
Базисная терапия когнитивной дисфункции имеет доказанную эффективность, но эта эффективность может быть потенциально повышенной. В этом смысле в качестве адъювантных методов лечения когнитивных нарушений после ИИ обращает на себя ТМС (вследствие своей доступности, безопасности и доказанности механизмов биологического действия). Однако ее собственная эффективность практически не исследована на уровне позднего восстановительного периода после церебрального ишемического события.
Сложившееся состояние проблемы привело к выдвижению научных гипотез о том, что после перенесенного ИИ в позднем восстановительном периоде включение в состав комплексных лечебно-реабилитационных мероприятий ТМС способствует восстановлению когнитивных функций, эффективность разработанной в настоящем исследовании программы комплексной терапии когнитивных расстройств с использованием ТМС превышает таковую у традиционного лечения.



