Введение
Ревматоидный артрит (РА) – иммуновоспалительное заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом и системным поражением внутренних органов, приводящее к ранней инвалидизации и сокращению продолжительности жизни пациентов [1]. По данным эпидемиологических исследований, в Российской Федерации (РФ) среди лиц трудоспособного возраста распространенность РА достигает 0,5–1,0% населения, или 610 человек на 100 тыс.Ежегодно число больных РА возрастает на 3–4%, а с учетом старения населения очевидно, что доля больных РА в общей численности населения РФ будет расти. При этом, по данным эпидемиологических исследований, до 50% больных становятся инвалидами в течение первых 5 лет от начала болезни [2].
С учетом значительного влияния РА на качество жизни больного можно сделать вывод, согласно которому он затрагивает все сферы жизни: влияет на повседневную деятельность и возможности общения больного. РА ложится тяжелой экономической нагрузкой на систему национального здравоохранения. Расходы на каждого отдельного пациента на протяжении его жизни складываются в значительные экономические потери для общества в целом. Для борьбы с этим заболеванием необходимо долгосрочное и дорогостоящее лечение.
Наиболее значимые достижения в фармакотерапии ревматических заболеваний за последние 15–20 лет связаны с внедрением в схемы лечения генно-инженерных биологических препаратов (ГИБП), в зависимости от класса препарата блокирующих определенный «провоспалительный» цитокин. В последние годы наряду с ГИБП появились таргетные синтетические базисные лекарственные препараты – ингибиторы янус-киназ (JAK). Их уникальный механизм действия связан с обратимым подавлением сигнализации широкого спектра «провоспалительных» цитокинов, что обеспечивает быстрый и стабильный эффект при различных фено- и эндотипах ревматических заболеваний за счет влияния на ведущие патогенетические механизмы, лежащие в основе их развития. Ингибиторы JAK как класс препаратов могут иметь потенциальные преимущества по сравнению с ГИБП. Во-первых, ГИБП блокируют один «провоспалительный» цитокин, патогенетическое значение которого при различных заболеваниях и на разных стадиях иммунопатологического процесса может существенно различаться; во-вторых, подавление эффектов только одного «провоспалительного» цитокина может непредсказуемо влиять на продукцию других «провоспалительных» или «антивоспалительных» цитокинов [3]. Важным достоинством ингибиторов JAK является таблетированная форма препаратов, способствующая лучшей приверженности лечению по сравнению с парентеральным введением ГИБП, которые требуют особых условий для введения, а также условия для транспортировки и хранения.
В многочисленных клинических исследованиях, в т.ч. рандомизированных плацебо-контролируемых (РПКИ) III фазы, в которых наблюдали более чем за 6000 пациентов, показано, что тофацитиниб (ТОФА) – эффективный препарат при раннем и развернутом РА. Препарат ТОФА чаще сравнивался с блокаторами фактора некроза опухоли α и только в некоторых исследованиях – с анти-СD-20-терапией ритуксимабом – РТМ [4–8].
В этой работе мы поставили задачу провести сравнительный анализ по данным реальной клинической практики двух различных схем терапии РА: 1-я – МТ в сочетании с ТОФА и 2-я – МТ в сочетании с РТМ с оценкой скорости достижения низкой активности заболевания, сохранения клинического эффекта в течение года. Две группы были выбраны в связи с широкой распространенностью терапии РТМ в субъектах РФ, ограниченным количеством данных РПКИ о сравнении непосредственной эффективности двух препаратов, а также в связи со значительными различиями в подходе к терапии и разными фармакоэкономическими затратами.
Методы
В исследование были включены 137 пациентов с достоверным диагнозом РА, соответствовавшим критериям ACR 1987 г. или EULR/ACR (European League Against Rheumatism/American College of Rheumatology) 2010 г., которые имели резистентность к стандартным базисным препаратам и были наивными в отношении ГИБП. В обеих группах большинство пациентов были женского пола, среднего возраста, с высокой активностью заболевания, II рентгенологической стадией, умеренным снижением функциональных способностей. Пациенты проходили лечение на базе ФГБНУ НИИР им. В.А. Насоновой и в других регионах РФ (всего 11 регионов), были разделены на 2 группы: 1-я состояла из 83 пациентов, получавших терапию ТОФА (Яквинус) в сочетании с МТ; во 2-ю группу вошли 54 пациента, получавших РТМ (Мабтера) в сочетании с МТ. Медиана длительности заболевания составила 4,2 года и 5 лет соответственно. Клинико-иммунологическая характеристика больных представлена в таблице. На момент включения в исследование у всех пациентов имела место высокая лабораторная активность: среднее значение СОЭ в группах ТОФА и РТМ составило 37 и 41 мм/ч соответственно, медиана уровня С-реактивного белка (СРБ) – 15,6 и 26 мг/л. Бόльшая часть (около 90%) пациентов в двух группах имели серопозитивность по ревматоидному фактору (РФ) и позитивность по антителам к циклическому цитруллинированному пептиду (АЦЦП): 75,9% позитивны по АЦЦП в группе ТОФА и 90,7% – по АЦЦП во 2-й группе.
Пациенты на момент включения в исследование имели неэффективность ранее предшествовавшей терапии базисными противовоспалительными препаратами (БПВП) и были наивными в отношении терапии ГИБП и таргетными синтетическими БПВП (тс-БПВП). В группе ТОФА+МТ у всех (100%) пациентов ранее отмечалась неэффективность терапии МТ, а также других БПВП: лефлуномида в 15,6% случаев, гидроксихлорохина в 14,4%, сульфасалазина в 4,8%; у единичных пациентов в анамнезе была терапия азатиоприном, циклофосфамидом.
В группе РТМ+МТ также у всех (100%) пациентов ранее отмечалась неэффективность терапии МТ: лефлуномидом – у 44,4%, гидроксихлорохином – у 14,8%, сульфасалазином – у 37%, азатиоприном – у 9,2%, у 4 пациентов неэффективность терапии хлорбутином и у 1 – циклоспорином.
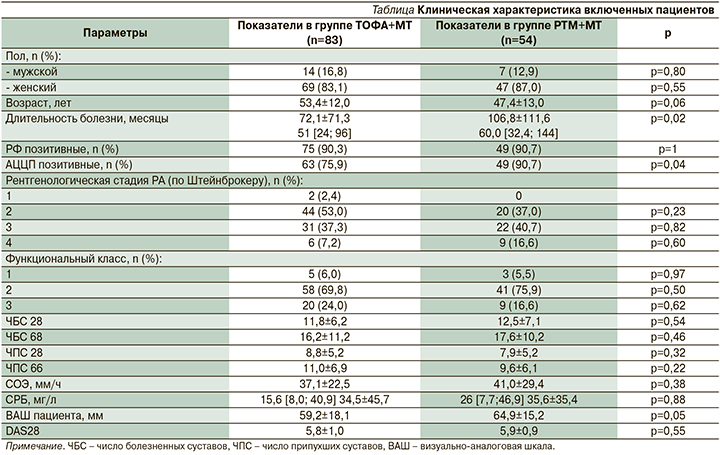
Среди сопутствовавших заболеваний в группах пациентов наиболее часто отмечалась патология со стороны сердечно-сосудистой системы (гипертоническая болезнь), верхних отделов желудочно-кишечного тракта ЖКТ (гастрит), поражение щитовидной железы – ЩЖ (аутоиммунный тиреоидит), патология почек (мочекаменная болезнь) и остеопороз (рис. 1).
В группе пациентов, получавших РТМ, несколькими больными в анамнезе был перенесен туберкулез, а также имела место бόльшая частота встречаемости мастэктомии в анамнезе.
Эффективность терапии оценивалась на 1-м, 3, 6 и 12-м месяцах. На момент включения в исследование средняя недельная доза МТ была 18,7±4,0 и 9,6±1,7 мг в группах ТОФА и РТМ соответственно. В ежедневном приеме глюкокортикостероидов (ГКС) нуждались 33,7% пациентов группы ТОФА, средняя суточная доза составляла 8,0±3,7 мг/сут. В группе РТМ 74,1% пациентов получали постоянную терапию ГКС, средняя суточная доза составляла 6,6±2,6 мг/сут.
Уровни СРБ (верхняя граница нормы 5 мг/л) и РФ (верхняя граница нормы – 15 МЕ/мл) определяли методом иммунонефелометрии на анализаторе BN ProSpec («Siemens», Германия), АЦЦП «Axis Shield Diagnostics» – иммуноферментным методом, Великобритания (верхняя граница нормы – 5 ЕД/мл).
Результаты
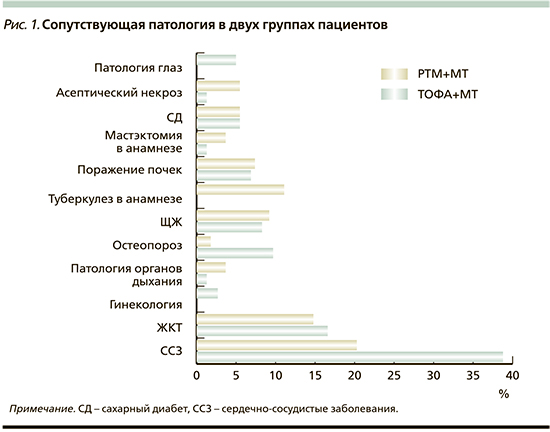
Согласно условиям наблюдения, пациенты обследовались врачом-ревматологом через 1, 3, 6 и 12 месяцев терапии. В этих точках наблюдения была проведена сравнительная оценка эффективности двух схем терапии в отношении лабораторных показателей воспалительной активности (с использованием индекса активности DAS28 – Disease Activity Score 28), а также скорости наступления низкой активности болезни. В обеих группах отмечалось значимое снижение активности болезни: DAS28 в группе пациентов, получавших ТОФА в сочетании с МТ, снизился с 5,8±1,0 до 3,8±1,2 на 3-м месяце терапии и до 3,1±1,1 через 6 месяцев, при этом значимое снижение лабораторных маркеров воспаления отмечено уже на 1-м месяце терапии. В конечной точке в 12 месяцев эффект от проводимой терапии сохранялся, индекс DAS28 составил 3,1±0,8. DAS28 в группе пациентов, получавших РТМ в комбинации с МТ, снизился с 5,9±0,9 до 4,1±1,0 на 3-м месяце терапии и до 3,5±1,2 через 6 месяцев терапии. Через год терапии РТМ средний индекс DAS28 составил 3,3±1,2.
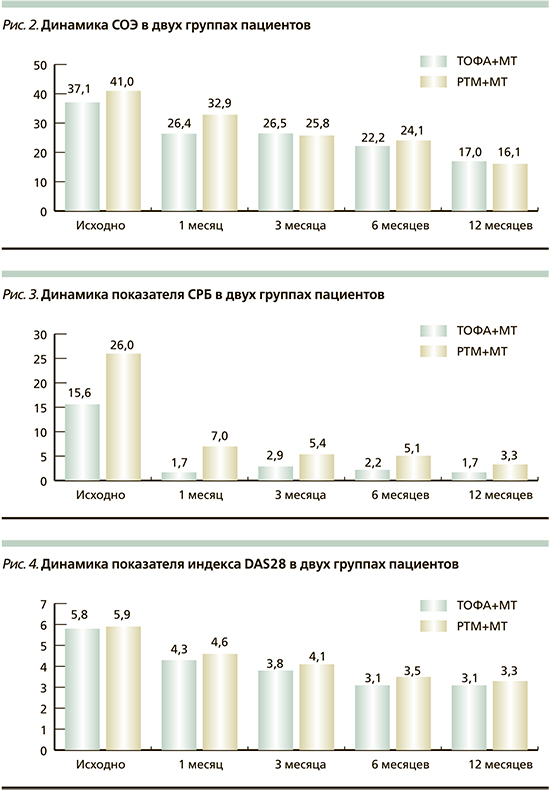
Также отмечалось значительное снижение острофазовых показателей крови в обеих группах: в группе ТОФА+МТ СРБ через месяц терапии снизился с 15,6 (8,0–40,9) до 1,7 (0,5–7,0) мг/л. Низкие значения СРБ сохранялись вплоть до окончания наблюдения: так, медиана показателя СРБ на 6-м месяце терапии составила 2,2 (0,7–6,0) мг/л, на 12-м – 1,7 (0,6–2,5) мг/л. Показатель СОЭ в общем анализе крови снизился с 37,1±22,5 до 26,4±19,7 мм/ч через месяц терапии, имел тенденцию к постепенному снижению до конца 12-го месяца, и составил 17,0±15,1 мм/ч. В группе РТМ+МТ медиана показателя СРБ также снизилась с 26 (7,7–46,9) до 7 (2,9–27,4) мг/л через месяц, на 6-м месяце составила 5,1 (2,2–10,3) мг/л, на 12-м – 3,3 (1,2–12,4). Средний показатель СОЭ снизился с 41±29,4 до 24±14,1 мм/ч на 6-м месяце, далее отмечено снижение до 16±12,3 мм/ч на 12-м месяце терапии. Динамика снижения активности болезни в двух группах была сопоставимой и представлена на рис. 2–4.
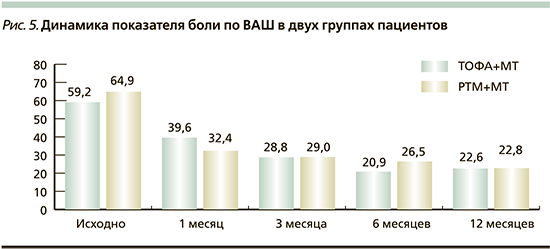
Сравнение субъективной оценки боли пациента по визуально-аналоговой шкале (ВАШ) показало схожий результат в двух группах. В группе ТОФА+МТ среднее значение ВАШ снизилось на 50% через 3 месяца по сравнению с исходным: изначально среднее ВАШ составляло 59,2±18,1 мм, через месяц терапии – 39,6±19,6 мм, а через 6 и 12 месяцев – 20,9±15,4 и 22,6±13,8 мм соответственно. В группе РТМ+МТ среднее значение ВАШ также снизилось на 50% от исходного через 3 месяца терапии: на момент начала терапии ГИБП средний показатель ВАШ составлял 64,9±15,2 мм, через месяц терапии – 32,4±20,1 мм, через 6 и 12 месяцев – 26,5±23,3 и 22,8±21,7 мм соответственно. Подробная диаграмма динамики ВАШ представлена на рис. 5.
На фоне терапии в обеих группах у пациентов отмечено снижение потребности в ежедневном приеме ГКС. Так, в группе ТОФА+МТ на 6-м месяце терапии 26,9% пациентов нуждались в приеме ГКС против 33,7% в начале терапии; средняя суточная доза приема ГКС также снизилась по сравнению с исходными значениями и составила 6,3±3,0 мг/сут. В группе РТМ+МТ 39,5% пациентов в течение 6 месяцев получали терапию ГКС в среднесуточной дозировке 5,5±2,2 мг/сут (исходно 74,1% получали терапию ГКС).
В группе ТОФА пациенты получали 10 мг ТОФА по 5 мг 2 раза в сутки, 11 (13,2%) пациентам потребовалось увеличение дозы ТОФА до 20 мг/сут (по 10 мг 2 раза в сутки). Повышение дозы препарата 2 пациентам потребовалось на 8-й неделе, 8 – на 12-й и 1 пациенту – на 16-й неделе терапии соответственно. Семь (8,4%) пациентов не завершили 12-месячного наблюдения в связи с прекращением терапии (из-за неэффективности, побочных эффектов или отказа от терапии).
В группе РТМ пациентам проводили внутривенные курсы РТМ в дозе 500 мг 1 (5,5%) пациенту, 1000 мг на курс – 34 (62,9%), 2000 мг – 17 (31,4%) пациентам. Премедикация метилпреднизолоном была стандартной – от 125 до 250 мг внутривенно капельно.
Обсуждение
Принимая во внимание актуальность качественной и эффективной терапии РА, увеличение случаев инициации ГИБП в различных федеральных округах РФ крайне актуальным представляется оценка результатов терапии в реальной клинической практике по данным национальных регистров. Создание регистров больных РА и другими воспалительными ревматическими заболеваниями относится к числу важнейших подходов к изучению клинических, научных и социальных проблем ревматологии. Регистры, основанные на реальной клинической практике, помогут дать ответ на многие принципиально важные вопросы, связанные с оптимальным ведением пациентов, страдающих РА.
Результаты представленного наблюдения в реальной клинической практике показали, что терапия препаратами ТОФА и РТМ имеют сравнимую эффективность для пациентов с достоверным диагнозом РА, резистентным к предшествовавшей терапии БПВП и наивным в отношении ГИБП.
При сравнении двух групп пациентов, получавших терапию ТОФА в сочетании с МТ и терапию РТМ в сочетании с МТ, отмечено более быстрое снижение воспалительной активности (СРБ и СОЭ) в группе ТОФА, особенно на 1-м месяце терапии. Также в этой группе быстре снижалась активность болезни по индексу DAS28 и сохранение показателя низкой активности болезни в течение 12-месячного наблюдения. Сохранение эффекта в отношении низких показателей СРБ в группе пациентов, получавших ТОФА с МТ, было более стойким.
Однако в реальной клинической практике динамика снижения боли по индексу ВАШ по результатам представленного наблюдения была лучше у пациентов, получавших РТМ+МТ, что несколько разнится с многочисленными публикациями об эффективном анальгезирующем эффекте ТОФА [9, 10]. Возможно, это связано с тем, что в данных публикациях использовали более специфические опросники для выявления боли пациента, в то время как в нашем исследовании учитывался показатель боли по ВАШ, который исследуется при рутинных наблюдениях ревматолога на приеме и учитывается в индексе активности DAS28. Выраженное снижение боли по ВАШ на 1-м месяце терапии пациентов в группе РТМ мы связываем с обязательной премедикацией ГКС, т.к. действие препарата РТМ, как известно, имеет некоторый отсроченный эффект.
Также обращает на себя внимание, что дозы МТ и ГКС в двух группах различались: так, в группе ТОФА дозы МТ были более высокими, а частота назначения ГКС ниже, что, вероятно, связано с гормонсохраняющим эффектом МТ, а также с наличием коморбидных заболеваний в группе ТОФА (патологии ССЗ, остеопороза), что ограничивает назначение ГКС.
Заключение
С учетом сравнительной эффективности двух препаратов стоит вопрос расчета фармакоэкономических затрат, как прямых, так и косвенных, для выявления экономически выгодной схемы терапии. Ответы на эти и другие вопросы могут дать данные из реальной клинической практики.



