Введение
Глобальная распространенность сахарного диабета (СД), по данным Международной диабетической федерации, в 2019 г. составила 9,3% (463 млн человек) [1, 2]. В России, по результатам исследования NATION, число лиц с СД составляет около 6% населения страны [3]. На долю СД2 приходится более 90% случаев диабета. Хроническая гипергликемия при СД ассоциируется с сосудистыми поражениями почек, глаз, сердца, мозга, нижних конечностей – главной причиной инвалидизации и смертности больных СД [4, 5].
Основой медикаментозной терапии при СД2 служат пероральные сахаро-снижающие препараты (ПССП), выбор которых зависит от доминирующей клинической проблемы и индивидуальных целей [3, 6, 7]. Однако, несмотря на значительное пополнение арсенала врачей современными препаратами, не всем пациентам удается достичь оптимального гликемического контроля и сохранить его в течение длительного времени. При неэффективности ПССП лечение дополняют назначением инсулина [3, 6–8].
Одним из возможных методов достижения индивидуальной цели терапии СД2 является применение лекарственного средства Субетта (НПФ «Материа Медика Холдинг»). Это комплексный препарат, созданный на основе технологически обработанных антител (сверхвысокие разведения) к β-субъединице рецептора инсулина (анти-rINS) и антител к эндотелиальной NO-синтазе (анти-eNOS). Анти-rINS повышают чувствительность рецепторов к эндо- и экзогенному инсулину. Анти-еNOS стимулируют продукцию оксида азота, оказывают эндотелиопротективное действие. Совместное применение двух компонентов сопровождается синергическим действием, что позволяет достигать наилучшего результата лечения. Механизм действия и основные клинические эффекты препарата описаны ранее [9–14].
Цель исследования: оценка эффективности и безопасности препарата Субетта для пациентов с отсутствием оптимального контроля СД2 на фоне лечения базальным инсулином в комбинации с метформином и/или препаратом сульфонилмочевины (ПСМ).
Методы
Многоцентровое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование проводилось в 17 медицинских центрах Российской Федерации с мая 2013 по июнь 2016 г. в соответствии с Правилами надлежащей клинической практики, Хельсинкской декларацией Всемирной медицинской ассоциации и нормативными требованиями. Протокол исследования одобрен локальными и национальным советами по этике, зарегистрирован в Министерстве здравоохранения РФ (разрешение № 41 от 13.06.2012) и в Международной базе ClinicalTrials.gov (NCT01868646).
В исследование отобрали 190 пациентов, у которых гликированный гемоглобин (HbA1c) оставался в пределах 7,0–10,0% на фоне комплексной терапии (базальный инсулин ≥10 ЕД/сут+метформин и/или ПСМ), проводимой в соответствии со стандартами лечения на протяжении ≥3 месяцев до включения в исследование. Перед началом скрининговых процедур пациенты подписали форму информированного согласия.
Пациентов не включали в исследование, если у них имелись острые осложнения СД в течение предшествовавших 3 месяцев, клинически значимые микро- и макроангиопатии, тяжелая сопутствовавшая патология в стадии декомпенсации/обострения, злокачественные новообразования, панкреатэктомия, трансплантация почек, бариатрические хирургические операции в анамнезе, беременность, кормление грудью.
В течение 2 недель скрининга проводили оценку состояния пациента, сбор жалоб и анамнеза, осмотр окулиста, лабораторные исследования (HbA1c, глюкоза плазмы натощак [ГПН], С-пептид, скорость клубочковой фильтрации, микроальбуминурия, биохимический и общий анализы крови, анализ мочи).
Все пациенты были обеспечены индивидуальными калиброванными по плазме глюкометрами «Рош» и тест-полосками для самоконтроля глюкозы крови (СКГК) с целью оценки 7-точечного гликемического профиля (3 измерения перед едой и 3 измерения через 2 часа после еды утром, в обед и вечером, одно измерение в 03.00) и частоты гипогликемических состояний.
По результатам скрининга выяснено, что 42 пациента не соответствовали критериям включения либо у них присутствовали критерии исключения. 148 пациентов с помощью автоматизированной интерактивной системы, основанной на генераторе случайных цифр, были рандомизированы в 2 группы.
Пациенты 1-й группы (группа Субетты, n=76) в дополнение к комплексной терапии (базальный инсулин ≥10 ЕД/сут+метформин и/или ПСМ) получали исследуемый препарат по следующей схеме: 1 таблетка на прием 4 раза в день (не во время приема пищи) в течение 36 недель. Пациенты 2-й группы (группа плацебо, n=72) получали комплексную терапию+плацебо по схеме приема Субетты.
Таблетки плацебо и Субетты имели одинаковый вид и органолептические свойства. Исследуемый препарат поставлялся в коробках, пачках и упаковках, не несущих информации о действующем веществе. Пациенты, исследователи, сотрудники исследовательских центров и команда спонсора проекта не были информированы о назначенной терапии (Субетта или плацебо) до завершения исследования и закрытия базы данных.
В течение исследования пациенты получали препараты сопутствующей терапии за исключением других ПССП (кроме метформина и ПСМ), небиволола, нитратов пролонгированного действия, препаратов для контроля веса, пероральных или внутривенных глюкокортикостероидов.
Пациентам выдавался дневник, в котором они записывали показатели СКГК, дозы базального инсулина и ПССП, препараты сопутствующей терапии, эпизоды гипогликемии и нежелательные явления (НЯ).
В ходе исследования помимо визитов скрининга и рандомизации пациент совершал еще 4 визита в медицинский центр: через 4, 12, 24 и 36 недель лечения. Во время визитов проводились обследование пациента, контроль исследуемой терапии и оценка комплаентности. Через неделю после рандомизации и начала приема исследуемой терапии, а также в промежутках между визитами (на 8±1, 18±1 и 30±1 неделях) врач-исследователь проводил телефонные «визиты» с целью решения вопроса о необходимости внепланового визита в медицинский центр.
В ходе мониторирования дополнительно выявлены 8 пациентов, включенных ошибочно, поскольку соответствовали критериям исключения; их данные исключены из Intention-to-Treat (ITT)-анализа до закрытия базы данных. Таким образом, в ITT-анализ эффективности вошли результаты лечения 140 пациентов, в т.ч. 73 – группы Субетты и 67 – группы плацебо (рис. 1).
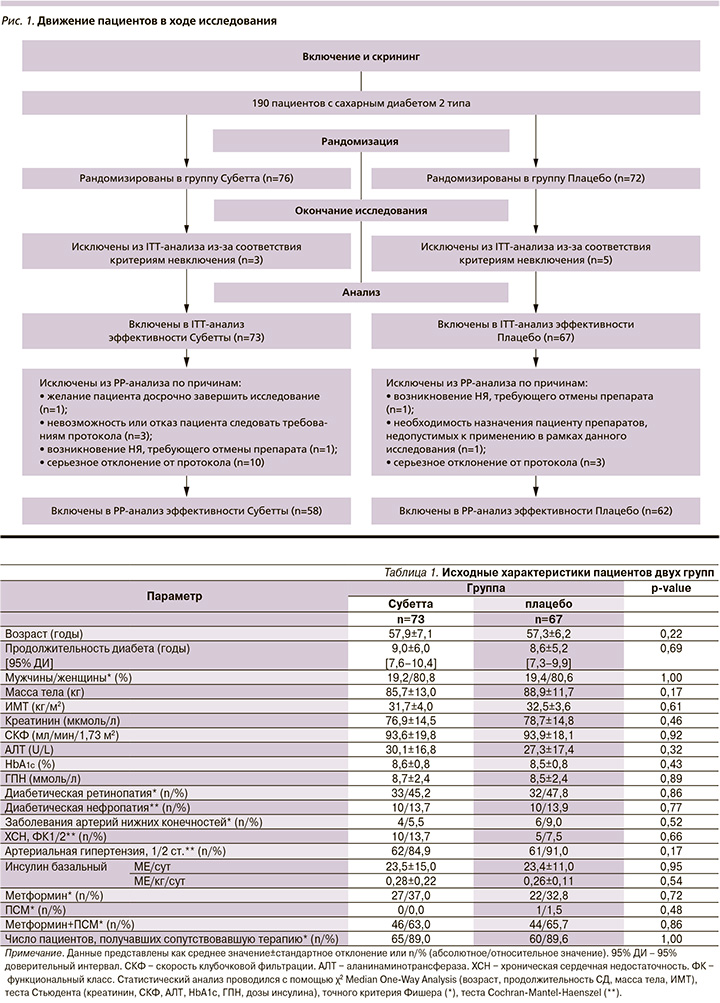
В Per Protocol (PP)-анализ эффективности включили данные всех пациентов, завершивших участие в исследовании в соответствии со всеми процедурами протокола. Для выборки PP проанализированы средние изменения HbA1c и ГПН в процессе лечения по сравнению с исходным значением.
Первичной конечной точкой эффективности терапии было изменение среднего значения HbA1c через 12, 24 и 36 недель лечения по сравнению с исходным значением. Динамику ГПН, показателей 7-точечного профиля СКГК, суточных доз инсулина и ПССП, абсолютного значения массы тела (кг) и индекса массы тела (ИМТ, кг/м2) в течение 36 недель лечения оценивали в качестве вторичных конечных точек.
Данные всех рандомизированных пациентов, получивших хотя бы одну дозу исследуемого препарата, использовались для оценки безопасности терапии (Safety population; n=148), проведенной на основании мониторинга и анализа показателей жизненно важных функций, лабораторных данных, частоты гипогликемий и НЯ.
Все лабораторные исследования выполнялись в центральной лаборатории, куда биологические образцы доставлялись с учетом регламентированных требований по транспортировке. HbA1c определялся методом, сертифицированным в соответствии с National Glycohemoglobin Standardization Program (NGSP) или International Federation of Clinical Chemists (IFCC) и стандартизованным в соответствии с референсными значениями, принятыми в Diabetes Control and Complications Trial (DCCT).
Обработка данных проводилась с использованием статистического пакета SAS-9.4. Для сравнения результатов в двух группах для непрерывных переменных применяли двухвыборочный t-критерий Стъюдента, непараметрический однофакторный анализ медиан (χ2 Median One-Way Analysis); для множественных сравнений использовался адаптивный критерий Хольма (adaptive Holm method; при описании результатов приведено скорректированное по данному методу значение p; величина ошибки первого рода). Для сравнения изменений показателей в двух группах использовали (1) двухфакторный дисперсионный анализ (Mixed Procedure в SAS), где факторами служили факторы Группа [2 уровня] и Визит [4 уровня], и (2) двухфакторный ковариационный анализ (Mixed Procedure в SAS), факторы − Группа и Визит, ковариата − Визит 1. Для сравнения долей (процентов) в двух группах использовали: (1) критерий χ2; (2) модификацию критерия χ2 для множественных сравнений (Cochran-Mantel-Haenszel; CMH χ2); (3) точный критерий Фишера.
Результаты
Пациенты обеих групп не имели различий по демографическим, антропометрическим и исходным клиническим характеристикам, включая возраст, продолжительность СД, уровни HbA1c и ГПН, дозы базального инсулина и ПССП, массу тела и ИМТ, осложнения СД и сопутствующие заболевания (табл. 1).
Большинство пациентов групп Субетта (89,0%) и плацебо (89,6%) получали разрешенную сопутствующую терапию (p=1,00), в т.ч. 86,9% и 85,1% пациентов двух групп принимали препараты для лечения кардиоваскулярных осложнений СД, включая ингибиторы ангиотензинпревращающего фермента, антагонисты ангиотензина II, β-адреноблокаторы, блокаторы кальциевых каналов, диуретики (индапамид и гидрохлоротиазид), антиагреганты, ангиопротекторы, периферические вазодилататоры, статины; 38,4 и 34,3% ‒ препараты, влияющие на кровь и систему кроветворения (включая антитромботические средства), 16,4 и 10,4% ‒ препараты, влияющие на обмен веществ; 9,6 и 13,4% (р=0,60) ‒ гормоны щитовидной железы, 12,3 и 9,0% (p=0,59) ‒ препараты для лечения болезней нервной системы, 8,2 и 7,5% (p=1,00) ‒ антибактериальные средства, 6,8 и 4,9% (р=0,72) − нестероидные противовоспалительные средства (НПВС).
Показатель комплаентности исследуемой терапии составил 99,2±7,2 и 99,1±9,3% в двух группах соответственно.
Среднее значение HbA1c в группе Субетты снизилось от исходного 8,6±0,8% до 8,1±1,0% через 12 недель и оставалось стабильным в течение последующих 24 недель. В группе плацебо среднее значение HbA1c практически не менялось в течение всех 36 недель. Среднее абсолютное значение HbA1c было достоверно ниже через 36 недель применения Субетты по сравнению с плацебо-терапией (p=0,0124).
Таким образом, среднее снижение HbA1с через 12, 24 и 36 недель лечения было значимо больше у пациентов группы Субетта (-0,53±1,06%, -0,54±1,00% и -0,54±1,11% против -0,01±1,06%, -0,07±1,19% и +0,15±1,07% в группе плацебо; p=0,0096, p=0,0107, p=0,0009 соответственно; рис. 2).
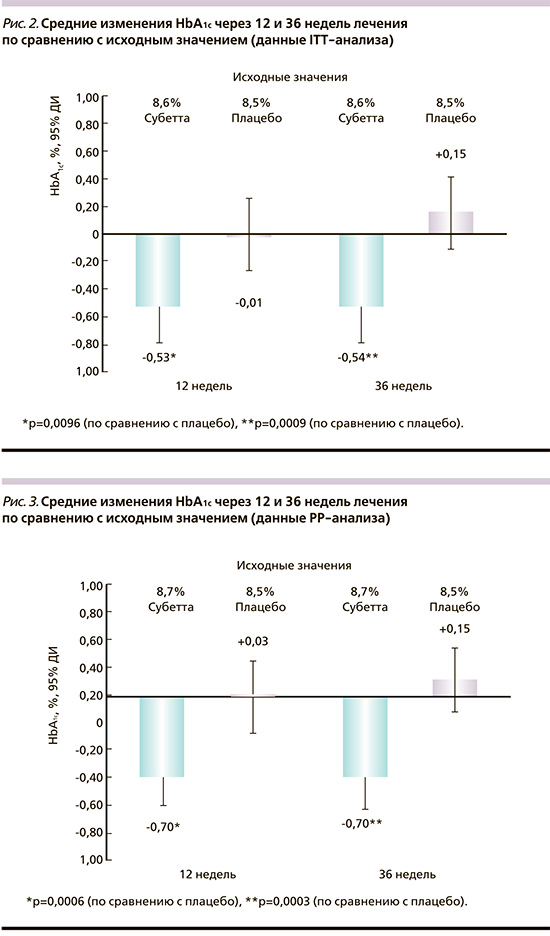
Для пациентов выборки PP также продемонстрировано статистически значимое снижение уровня HbA1c на фоне лечения Субеттой: от исходного 8,7±0,8% до 8,0±1,0% к 12-й неделе; HbA1с оставался стабильным в последующие недели вплоть до окончания лечения. В группе плацебо значение HbA1с практически не изменилось за 3 месяца (8,5±0,8% – исходно, 8,5±1,2% – к 12-й неделе) и оставалось без динамики в течение всех 36 недель.
Таким образом, лечение препаратом Субетта превосходило результаты плацебо-терапии на каждом временном отрезке: снижение HbA1с через 12, 24 и 36 недель составило -0,70±1,04%, -0,65±1,04% и -0,70±1,13% против +0,03±1,09%; -0,07±1,21% и +0,15±1,07% в группе плацебо (р=0,0006, p=0,0056 и p=0,0003 соответственно; рис. 3).
Двухфакторный дисперсионный анализ выявил значимые эффекты по фактору Группа (F1,185=14,27; p=0.0002), фактору Визит (F3,435=5,0; p=0,0020), взаимодействию факторов Группа/Визит (F3,435=5,45; p=0,0011), что также подтверждает достоверно более выраженную, чем в группе плацебо, динамику снижения уровня HbA1с.
Дополнительный анализ показал, что через 36 недель применения препарата Субетта целевых значений HbA1с достигли 19,2% пациентов (против 4,5% в группе плацебо; р=0,009); а в выборке РР – 22,4% (против 4,8%; р=0.006).
ГПН через 4 недели применения Субетты снизилась на -0,5±2,6 ммоль/л (против -0,1±3,2 ммоль/л в группе плацебо; p=0,3362), оставаясь в последующие 24 недели лечения на стабильном уровне. В группе плацебо уровень ГПН, напротив, повысился: +0,9±4,1 ммоль/л через 24 недели (р=0,2778) и +1,0±3,7 ммоль/л через 36 недель (p=0,2778). Результаты двухфакторного ковариационного анализа по факторам следующие: Группа – F1,143=5,27 (p=0,0232), Визит – F3,306=3,82 (p=0,0103) и взаимодействия факторов Группа/Визит – F3,306=0,41 (p=0,7472).
Для PP-выборки также продемонстрировано снижение ГПН в группе Субетты: на -0,6±2,6 ммоль/л (p=0,27) через 4 недели лечения, значения ГПН поддерживались на стабильном уровне последующие 24 недели. У пациентов, получавших плацебо, уровень ГПН, напротив, повышался: +0,9±4,3 ммоль/л через 24 недели (р=0,109); +1,0±3,8 ммоль/л через 36 недель (p=0,062).
Средний суточный уровень гликемии, по данным 7-точечного профиля СКГК, исходно и через 36 недель лечения представлен на рис. 4. В группе Субетты отмечена тенденция к снижению постпрандиальной гликемии по сравнению с исходным состоянием.
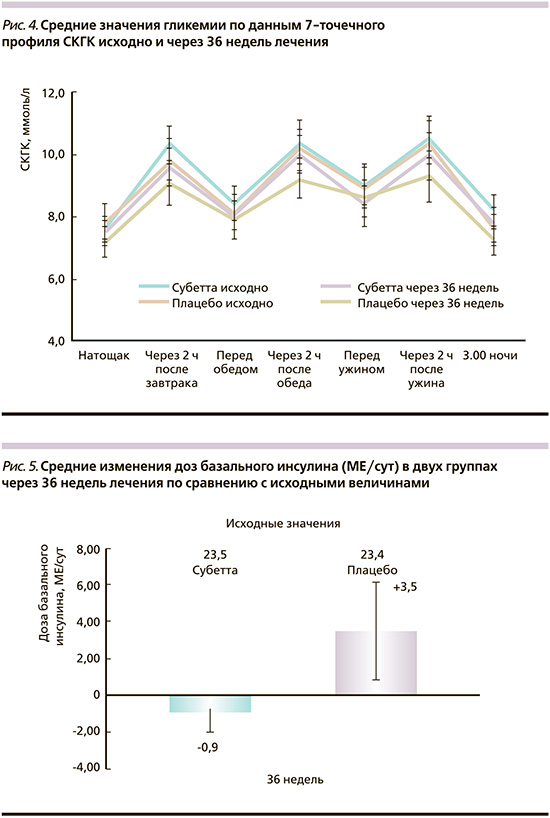
Дозы базального инсулина через 36 недель лечения в группе Субетты были снижены (-0,9±2,4 МЕ/сут), у пациентов группы плацебо, напротив, повышены (+3,5±9,5 МЕ/сут; рис. 5). Однако из-за большого размаха доз внутри групп эти различия в изменении доз инсулина не достигли статистической значимости (р=0,0605). Дозы ПССП чере36 недель не имели различий между группами (p=0,3108).
На фоне применения Субетты концентрация С-пептида практически не менялась (табл. 2), тогда как в группе плацебо выявлено его снижение, о чем свидетельствовал значимый эффект по фактору Визит (p=0,017).

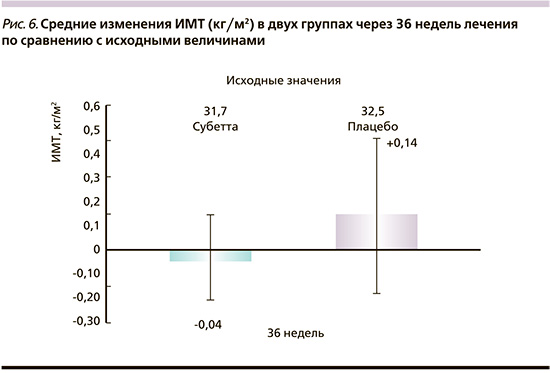
Лечение Субеттой способствовало сохранению стабильного веса пациентов на протяжении всех 36 недель (85,2±13,0 кг к окончанию терапии против исходных 85,4±13,0). В группе плацебо отмечена тенденция к повышению массы тела (89,3±11,9 против исходных 88,9±11,8), что имело маргинальную статистическую значимость (р=0,0580) по сравнению с группой Субетты. ИМТ в группе Субетты также был стабильным (-0,04±0,78 кг/м2 против +0,14±1,33 кг/м2 в группе плацебо; р=0,341; рис. 6).
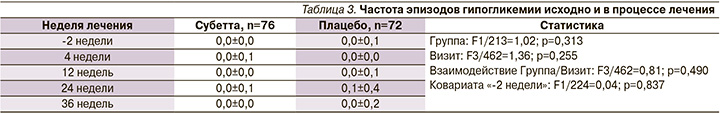
В ходе исследования было зарегистрировано 10 эпизодов симптоматических дневных гипогликемий, в т.ч. 2 − в группе Субетты и 8 ‒ в группе плацебо. Не выявлено ни одного случая тяжелой гипогликемии. Частота эпизодов гипогликемии исходно и в процессе лечения не имела достоверной разницы в двух группах (табл. 3). Не выявлено статистически значимого увеличения частоты гипогликемий в обеих группах.
Препарат Субетта не оказывал отрицательного влияния на показатели жизненно важных функций участников исследования, в т.ч. частоту сердечных сокращений (ЧСС), систолическое (САД) и диастолическое артериальное давление (ДАД). Средние значения САД и ДАД на протяжении всего исследования соответствовали нормальным и хорошо контролируемым показателям. Статистический анализ не выявил различий в значениях ЧСС, САД и ДАД на визитах 1–5 в группах Субетты и плацебо.
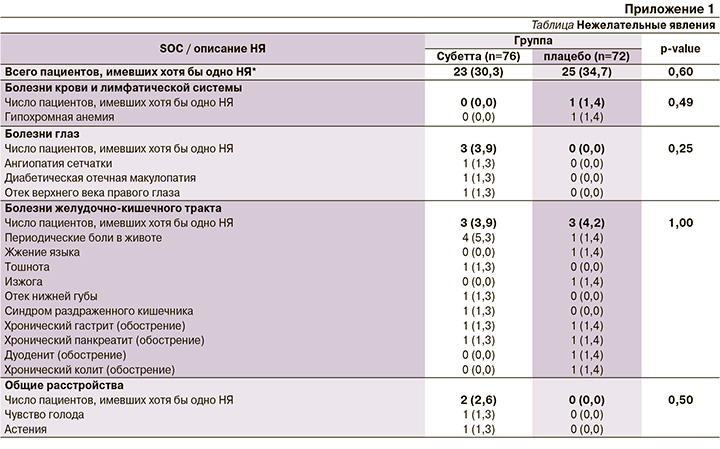
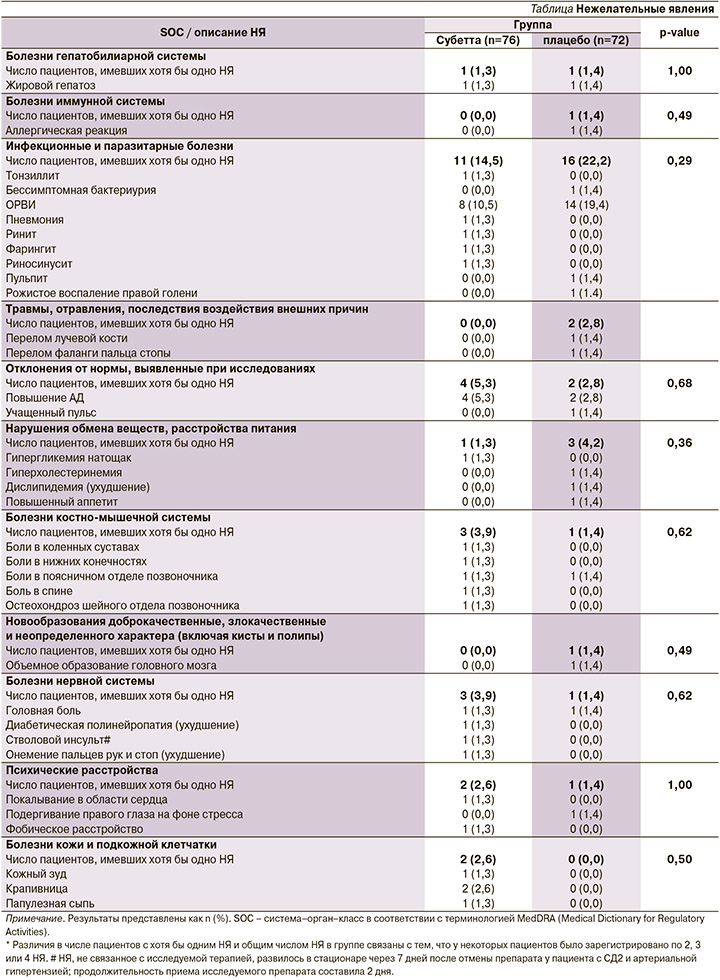
Всего в течение исследования зарегистрировано 49 НЯ у 23 (30,3%) пациентов группы Субетты и 39 НЯ у 25 (34,7%) участников группы плацебо (р=0,60). Число пациентов с НЯ, имевших отношение к тому или иному коду MedDRA (Медицинский словарь терминологии регуляторной деятельности), также не различалось между двумя группами (Приложение 1).
В группе Субетты 24 (49,0%) НЯ были легкой, 24 (49,0%) ‒ средней степеней тяжести, 1 (2,0%) ‒ тяжелые; в группе плацебо – 23 (58,9%), 15 (38,5%) и 1 (2,6%) соответственно. Причинно-следственная связь НЯ с препаратом Субетта, по мнению врачей-исследователей, отсутствовала (n=28; 57,1%), была маловероятной (n=9; 18,4%) или возможной (n=12; 24,5%). Не зарегистрировано ни одного НЯ с достоверной связью с исследуемым препаратом. Частота распределения НЯ в зависимости от степени тяжести (p=0,419) и достоверности причинно-следственной связи с препаратом (p=0,166) не различалась в двух группах.
Биохимический анализ крови не выявил статистически значимых различий или отклонений у пациентов групп Субетта и плацебо в уровнях общего холестерина, липопротеинов высокой и низкой плотности, триглицеридов, а также общего белка, креатинина, аланин- и аспартатаминотрансфераз, прямого и общего билирубина. Показатели общеклинических анализов крови и мочи были нормальными у всех пациентов через 12, 24 и 36 недель лечения.
В ходе исследования не зарегистрировано случаев взаимодействия препарата Субетта с лекарственными средствами различных классов, в т.ч. с инсулинами длительного действия, метформином, ПСМ, а также с ингибиторами АПФ, блокаторами рецепторов ангиотензина, β-адреноблокаторами, блокаторами кальциевых каналов, диуретиками (индапамид и гидрохлоротиазид), антиагрегантами, ангиопротекторами, статинами, препаратами для лечения болезней желудочно-кишечного тракта, НПВС, гормонами щитовидной железы, антибактериальными препаратами.
Обсуждение результатов
В ходе данного исследования показано, что включение препарата Субетта в комплекс терапии пациентов с СД2 является эффективным и безопасным методом оптимизации гликемического контроля. Пациенты, которые первоначально не могли достичь гликемических целей с помощью комбинации базальный инсулин+ПССП, после добавления Субетты смогли снизить уровень HbA1c в течение 12 недель. Значимое по сравнению с плацебо-терапией снижение уровня HbA1c поддерживалось в течение всех 36 недель лечения, что способствовало достижению целевых значений контроля углеводного обмена у 19,2% пациентов.
Динамика ГПН демонстрирует, насколько сложно у больных диабетом поддерживать гликемический контроль на оптимальном уровне. Вместе с тем, следует отметить, что в группе Субетты наблюдалась тенденция к снижению ГПН к 4-й неделе, которая оставалась на стабильном уровне в течение всего периода наблюдения, в то время как в группе плацебо ГПН нарастала в течение всех 36 недель.
Тенденция к снижению доз базального инсулина при значимом улучшении показателей углеводного обмена в группе Субетты, в т.ч. при достижении целевых значений каждым пятым пациентом, также имеет важное значение в лечении диабета.
Применение препарата Субетта способствует сохранению фоновой секреции эндогенного инсулина на стабильном уровне, о чем свидетельствует концентрация С-пептида, которая в группе исследуемого препарата не менялась в течение всех 36 недель исследования (против значимого снижения в группе плацебо). Масса тела и ИМТ у пациентов, получавших Субетту, также оставались на исходном уровне через 36 недель лечения.
На протяжении всего исследования не зарегистрировано ни одного случая тяжелой гипогликемии или НЯ, достоверно связанных с Субеттой.
Препарат не оказывал влияния на биохимические показатели, анализы крови и мочи. За 36 недель лечения Субеттой не было зарегистрировано ни одного случая взаимодействия препарата Субетта с лекарственными средствами различных классов. Пациенты продемонстрировали хорошую приверженность терапии.
По мнению компании-производителя, терапевтическая активность Субетты у пациентов с СД2 объясняется сенситизирующим влиянием препарата на инсулиновые рецепторы, что приводит к повышению их чувствительности к инсулину [9–12, 14]. Известно, что инсулинорезистентность, а также снижение секреции инсулина требуют коррекции схем лечения, в т.ч. увеличения доз инсулина, что повышает риск развития гипогликемии [3, 5, 8]. В ходе настоящего исследования показано, что включение препарата Субетта в комплекс терапии позволяет преодолевать инсулинорезистентность и получать позитивный эффект при тех же дозах базального инсулина и ПССП (метформин и/или ПСМ). Возможными эффектами Субетты является улучшение утилизации глюкозы клеткой и уменьшение вариабельности уровня гликемии [12]. Ранее было показано, что у пациентов с отсутствием оптимального контроля СД2 на фоне лечения метформином в комбинации с ПСМ прием Субетты приводил к снижению уровня HbA1c в течение 12 недель в среднем на 0,8%. Эффект Субетты проявлялся в нормализующем воздействии на суточный гликемический профиль (по данным непрерывного мониторирования глюкозы) и значимом снижении инсулинорезистентности (по данным индекса HOMA-IR) [15]. Включение препарата Субетта в состав базис-болюсной инсулинотерапии пациентов с СД 1 типа способствовало значимой оптимизации гликемического контроля в течение 12 недель без увеличения общей частоты гипогликемий [16].
Эндотелиопротективное действие второго компонента (анти-еNOS) имеет немаловажное значение, поскольку эндотелиальная дисфункция, ассоциированная с инсулинорезистентностью [17, 18], способствует развитию микро- и макроангиопатий при СД. Синергическое действие двух компонентов препарата Субетта, очевидно, может предотвращать прогрессирование кардиоваскулярных осложнений и снижать риск сердечно-сосудистых событий у лиц с СД.
Результаты, полученные в ходе настоящего исследования, демонстрируют терапевтический потенциал препарата Субетта при инсулинорезистентности, что позволяет планировать новые клинические исследования пациентов с нарушениями углеводного обмена.
Заключение
Сочетание препарата Субетта с базальным инсулином и ПССП (метформином и/или ПСМ) является рациональной комбинацией при СД2. У пациентов с отсутствием контроля СД2 на фоне базального инсулина и ПССП в течение не менее 3 месяцев включение препарата Субетта приводит к значимой оптимизации гликемического контроля. Достигнутый за 12 недель уровень HbA1c остается стабильным в последующие 24 недели лечения. Терапевтическая эффективность препарата сочетается с хорошим профилем безопасности и высоким уровнем приверженности пациентов к терапии.
Благодарности
Авторы выражают благодарность участникам исследования, персоналу медицинских центров и исследователям за участие в клиническом исследовании.
Компания ООО «НПФ “МАТЕРИА МЕДИКА ХОЛДИНГ”» (Россия, 127473, Москва, 3-й Самотечный пер., 9) выступила спонсором исследования).
Конфликт интересов
Авторы статьи получили исследовательские гранты от компании ООО «НПФ “МАТЕРИА МЕДИКА ХОЛДИНГ”» на проведение исследования.