Введение
Помимо основной функции, заключающейся в регуляции фосфорно-кальциевого обмена, витамин D (VD) и его рецептор (VDR) оказывают опосредованное влияние более чем на 300 генов, влияющих на клеточный цикл, иммунитет и метаболизм [1]. Доказано, что активная форма витамина D оказывает прямое воздействие на недифференцированные и инактивированные Т-хелперы, Т-регуляторы, активированные Т-клетки и дендритные клетки [1, 2].
Ген VDR находится на коротком плече хромосомы 12 (12q13.1), состоит из 9 экзонов и 8 интронов. Он имеет высокую вариабельность полиморфных последовательностей, возникающих как в кодирующих, так и в некодирующих частях гена, и это ведет к изменениям его функции за счет активации экспрессии гена, реже – к структуре белка. Более чем из 30 известных однонуклеотидных последовательностей наиболее изученные ApaI (rs7975232), BsmI (rs1544410), FokI (rs2228570), TaqI (rs731236) и Cdx2 (rs11568820) [2]. Установлено их влияние на риск развития, тяжесть и течение иммуноопосредованных заболеваний, таких как сахарный диабет и ревматоидный артрит, хронические бронхолегочные и сердечно-сосудистые недуги. Полученные результаты исследований свидетельствуют о необходимости проведения дальнейших изысканий в этой области [2–6].
Цель исследования: определить влияние полиморфизма FOK1 гена VDR на течение и исходы бронхолегочной дисплазии (БЛД) у детей.
Методы
Исследование проведено на базе ГБУЗ АО ОДКБ им. Н.Н. Силищевой, Астрахань, в период с 2016 по 2019 г.
Основную группу составили 80 пациентов с диагнозом БЛД. Группа контроля представлена 93 недоношенными новорожденными, не сформировавшими диагноз БЛД. Все пациенты основной группы обследованы и получали лечение, согласно стандарту оказания медицинской помощи при данном заболевании.
Для выполнения молекулярно-генетического анализа производили выделение тотальной ДНК из цельной крови. Генотипирование полиморфных маркеров изучаемых генов осуществляли с помощью полимеразной цепной реакции (ПЦР) и анализа полиморфизма длины рестрикционных фрагментов (ПДРФ-анализа) У пациентов с различными аллелями и генотипами анализировались следующие параметры: степень тяжести заболевания, длительность респираторной поддержки, гендерный признак, варианты исходов недуга, частота, тяжесть обострений и респираторных инфекций, заинтересованность в базисной терапии, коморбидные состояния, показатели функции внешнего дыхания по данным бронхофонограммы и интерпретация данных компьютерной томограммы легких.
Для сравнения частот аллелей и генотипов и их ассоциации с фенотипом БЛД использовали χ2-критерий Пирсо с поправкой Йетса на непрерывность при числе степеней свободы, равном 1, а также двусторонний точный тест Фишера в случае, если ожидаемое значение хотя бы в одной ячейке таблицы сопряженности было меньше 5.
Об ассоциации фенотипического признака с конкретным генотипом или аллелей судили по величине отношения шансов (Оdds Ratio [OR]).
Результаты
В ходе исследования выявлено, что генотипическая вариабельность полиморфизма FOK1 гена VDR у пациентов представлена таким образом, что наиболее часто идентифицирован генотип F/F – в 65,0% случаев (52 ребенка), в то время как в контрольной группе – лишь в 39,8% (37 детей). Частота встречаемости гетерозиготного генотипа F/f у детей контрольной группы составила 45,2% (42 ребенка), в основной – 30,0% (24 пациента). Гомозиготное состояние мутантного аллеля f гена VDR обнаруженo у здоровых младенцев в 15,0% (14 детей), в то время как среди детей с БЛД – в 5,0% (2 пациента) обследованных (табл. 1).

Таким образом, доказана ассоциация полиморфизма FOK1 гена VDR с реализацией БЛД у детей. Согласно статистическим данным, генотип F/F предрасполагает к развитию заболевания (χ2=10,946; р<0,001, df=1, OШ=2,811, ДИ: 1,513–5,221). Получена ассоциация аллеля F с развитием заболевания (OШ=1,924, ДИ: 1,108–3,342).
Поскольку степень тяжести БЛД имеет основополагающее значение для фенотипической характеристики заболевания и варианта его исхода, мы проанализировали влияние полиморфизма FOK1 гена VDR на данный классификационный критерий. В ходе сравнительного анализа распределения частот аллелей (F, f) и генотипов (F/F, F/f, f/f) выявлено достоверное различие между группами пациентов с легкой, среднетяжелой и тяжелой формами БЛД. Так, в группе детей со средней степенью тяжести преобладали пациенты с генотипом F/f (χ2=7,561, р=0,023, df=2, OШ=3,661, ДИ: 1,317–10,205, табл. 2).
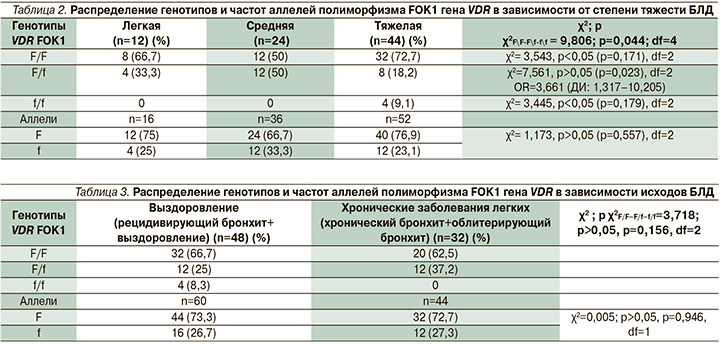
Изучение влияния полиморфизмов FOK1 гена VDR на исходы бронхолегочной дисплазии у детей, а именно частоту выздоровления или формирование хронического бронхолегочного процесса, не выявило статистически значимых различий (табл. 3).
В ходе исследования была выявлена высокая частота поражений нервной системы в виде церебральной ишемии, внутрижеледочковых кровоизлияний I–III степеней, перивентрикулярной лейкомаляции. Сравнительный анализ данных показал, что у гетерозиготных носителей генотипа F/f полиморфного маркера FOK1 гена VDR достоверно чаще имелись тяжелые поражения ЦНС (χ2=15,238; р<0,001, df=1, OШ=9,000, ДИ: 1,638–49,447).
Анализ полученных данных выявил достоверную взаимосвязь гетерозиготного генотипа F/f полиморфного маркера FOK1 гена VDR с частотой ОРВИ (χ2=7,778; p<0,05, р=0,006, df=1), а также наличием первых эпизодов ОРВИ до года (χ2=14,694; p<0,05, р<0,001, df=1).
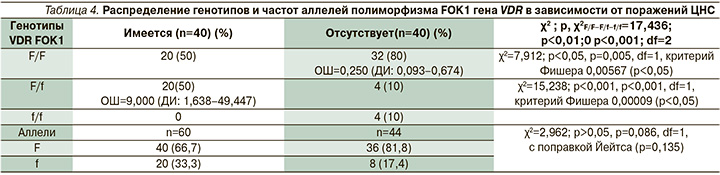
Таким образом, генотип F/f служит предрасполагающим генетическим фактором к раннему старту (до года) и высокой частоте респираторно-вирусных инфекций у детей с БЛД (OШ=5,000, ДИ: 0,923–27,079; табл. 5, 6).
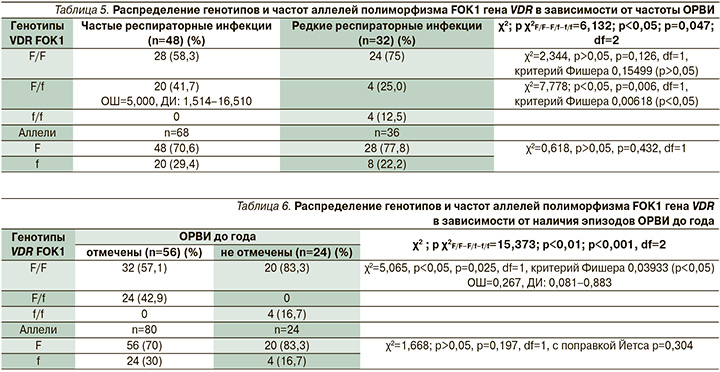
Респираторные инфекции у детей с БЛД сопровождаются развитием бронхообструктивного синдрома (БОС), что требует проведения лечебных мероприятий с включением бронхолитиков и ингаляционных глюкокортикостероидов (ИГКС). В зависимости от частоты и тяжести БОС пациенты получали ингаляционную терапию либо краткосрочным курсом, либо (в случае частых эпизодов) длительно. При поиске ассоциаций генотипов F/F, F/f и f/f с возможностью реализации БОС при обострении БЛД и длительностью использования ИГКС достоверных различий не выявлено (χ2=1,474; р=0,479; χ2=5,519; р=0,064 соответственно) (табл. 7, 8).
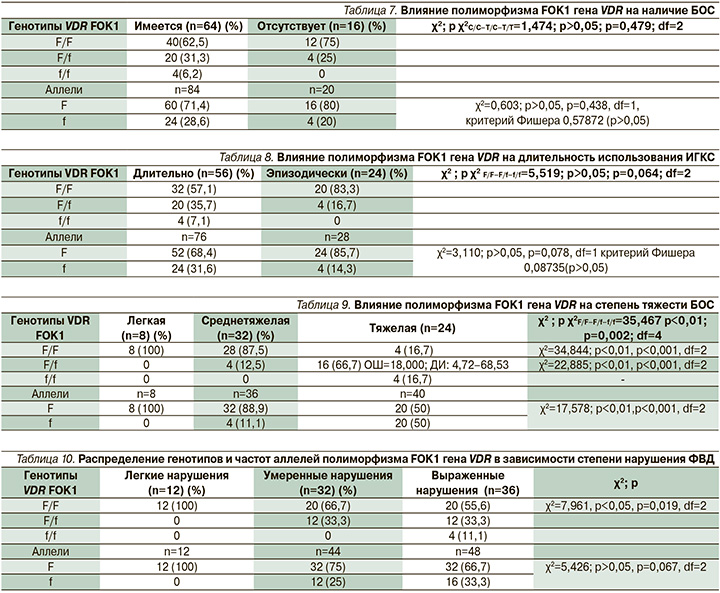
Согласно проведенному статистическому анализу, генотип F/f является предрасполагающим к тяжелому течению БОС во время обострения БЛД (χ2=35,4676; р=0,002, OШ=18,000, ДИ: 4,728–68,533; табл. 9).
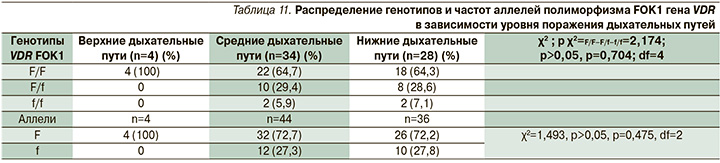
Функциональные методы исследования функции внешнего дыхания (ФВД) служат основополагающим диагностическим инструментом при диагностике степени и характера изменения у пациентов с острой и хронической бронхолегочной патологией. Проведен анализ спектра и выраженности изменений, согласно данным бронхофонограммы. Согласно статистическому анализу, у детей с легкими нарушениями ФВД в 100% (12 детей) идентифицирован генотип F/F, в то время как в группе пациентов с умеренными и выраженными нарушениями генотипы распределились равномерно. Ассоциации генотипов F/F, F/f, f/f и аллелей F и f полиморфизма FOK1 гена VDR с уровнем поражения дыхательных путей, а именно верхних, средних и нижних, выявлено не было (χ2=4,347; p>0,05; р=0,362; df=4) (табл. 10, 11).
При генетической вариабельности полиморфизма FOK1 гена VDR не получено статистически значимых различий по влиянию генотипов на характер микробиоты дыхательных путей у детей с БЛД (табл. 12).

Обсуждение
В ходе исследования выявлена ассоциация полиморфизма FOK1 гена VDR с формированием БЛД у детей. По всей видимости, данная ассоциация связана с моделирующим влиянием полиморфизма на уровень VD, который может оказывать влияние на степень созревания легочной ткани и темпы альвеолярной васкуляризации [10].
В то же время, не было определено влияние полиморфизма FOK1 гена VDR на степень тяжести и варианты исходов БЛД, что требует дальнейшего изучения.
Поражения центральной нервной системы (ЦНС) могут обусловливать тяжесть течения и неблагоприятный исход заболевания, что связано с нарушением регуляции дыхательных паттернов, тонуса бронхиальных сосудов и просвета бронхов, а также изменение секреторной активности бокаловидных клеток по средствам дезрегуляции вегетативной нервной системы. В ходе исследования была выявлена высокая частота поражений нервной системы в виде церебральной ишемии, внутрижеледочковых кровоизлияний I–III степеней, перивентрикулярной лейкомаляции. Сравнительный анализ данных показал, что у гетерозиготных носителей генотипа F/f полиморфного маркера FOK1 гена VDR достоверно чаще имелись тяжелые поражения ЦНС. Согласно данным литературы, в российской популяции пациентов с артериальной гипертензией проведено изучение распределения генотипов FokI гена VDR, и установлено, что у лиц с F/F- и F/f-генотипами заболевание стартовало в более раннем возрасте по сравнению с индивидуумами, имевшими генотип f/f. Описано, что неврологические расстройства, связанные с дефицитом витамина D, включают цереброваскулярные патологии (сосудистая деменция, ишемический инсульт), рассеянный склероз (в т.ч. более высокую частоту рецидивов и большее число поражений, устанавливаемых по МРТ), болезнь Альцгеймера, болезнь Паркинсона, атеросклероз сонных артерий и эпилепсию [3–6]. Возможно, васкулярные изменения, ассоциированные с данным полиморфизмов, служат одной из причин высокой частоты встречаемости поражение ЦНС у недоношенных младенцев с БЛД.
Обострение БЛД, как правило, ассоциировано с присоединением респираторной вирусной инфекции. В то же время частота и тяжесть ОРВИ непосредственно влияют на исход БЛД. Согласно данным многочисленных исследований, ядерный рецептор витамина D оказывает прямое воздействие на недифференцированные и инактивированные Т-хелперы, Т-регуляторы, активированные Т-клетки и дендритные клетки. Приняв это во внимание, мы провели поиск ассоциации полиморфизма FOK1 гена VDR на частоту и старт вирусных инфекций у детей основной группы [1, 7, 8].
В ходе исследования было показано, что генотип F/f служит предрасполагающим генетическим фактором к раннему старту (до года) и высокой частоте респираторно-вирусных инфекций у детей с БЛД. По всей видимости, моделирующее влияние полиморфизма на частоту респираторных заболеваний связана с модификацией защитного эффекта витамина D на клетки макрофагов, «работающих» совместно с клетками эпителия дыхательных путей. В ряде работ показано, что активная форма VD, способная подавлять избыточную воспалительную реакцию на вирусы, может быть подвергнута генетической вариабельности.
По данным литературы, витамин D поддерживает антибактериальный и антивирусный иммунитет в легочной ткани. На фоне дефицита повышаются уровни провоспалительных цитокинов, что существенно снижает эффективность иммунного ответа организма [9]. Однако в проведенном нами исследовании при генетической вариабельности полиморфизма FOK1 гена VDR не получено статистически значимых ассоциаций с вариантами микробиоты дыхательных путей у детей с БЛД.
Заключение
Таким образом, в ходе проведенного исследования доказано, что гомозиготный генотип F/F имеет предрасполагающее значение для формирования БЛД у младенцев. Гетерозиготный генотип F/f полиморфного локуса FOK1 гена VDR ассоциирован с поражениями ЦНС васкулярного характера, частыми эпизодами и ранним стартом вирусных инфекций, сопровождающимися тяжелой формой обструктивного синдрома у детей с БЛД. Полученные результаты раскрывают новые патогенетические механизмы заболевания, указывают на необходимость и перспективу персонифицированного подхода к назначению VD детям с БЛД.
Вклад авторов
Концепция и дизайн исследования – П.Б. Хиштилова, Д.Ф. Сергиенко. Сбор и обработка материала – П.Б. Хиштилова. Статистическая обработка данных – П.Б. Хиштилова. Написание текста – П.Б. Хиштилова, Д.Ф. Сергиенко. Редактирование – Д.Ф. Сергиенко.


