Введение
В настоящее время меланома сохраняет за собой стабильную тенденцию к увеличению показателей заболеваемости во всем мире. В России с 2008 по 2018 г. стандартизированный показатель среднегодового прироста заболеваемости меланомой кожи составил 2,48% на 100 тыс. населения, а за десятилетний период – 28,72%. Кумулятивный риск заболеть на территории Российской Федерации в 2018 г. составил 0,54 против 0,41 в 2008 г. [1]. Существуют научные работы, демонстрирующие на основе анализа прогностической модели дальнейшее увеличение показателей заболеваемости данной онкопатологией среди популяций США, Великобритании, Швеции, Норвегии, Австралии и Новой Зеландии вплоть до 2031 г. в среднем на 3% в год [23].
Наличие вируса иммунодефицита человека (ВИЧ) или синдрома приобретенного иммунного дефицита (СПИД) входит в устоявшийся перечень факторов риска возникновения меланомы ввиду установленной иммуногенности данной злокачественной опухоли [6]. Известно, что иммуносупрессия связана с риском возникновения меланомы, о чем свидетельствует повышение показателей заболеваемости у реципиентов органов после трансплантации, получающих иммунодепрессанты [11], а из клинических наблюдений получены данные о спонтанном регрессе опухоли у некоторых пациентов с первичной меланомой и регрессе, связанном с аутоиммунной депигментацией кожи и витилиго [8, 9].
Согласно мировым статистическим данным, в 2018 г. показатель новых случаев заражения ВИЧ-инфекцией среди взрослых снизился на 16% относительно 2010 г., с 2,1 (1,6–2,7) млн заболевших до 1,7 (1,4–2,3) млн [2]. Однако на территории Европейского континента Россия в 2017 г. возглавила список стран по количеству новых случаев ВИЧ среди граждан – 106 698 новых случаев заражения. К концу 2018 г. общее число зарегистрированных россиян, инфицированных ВИЧ, составило 1 329 331. Территориальными центрами по профилактике и борьбе со СПИД в 2018 г. сообщено о 103 995 новых случаях ВИЧ-инфекции, что на 2,5% меньше, чем в предыдущем году. С 2005 г. регистрировался ежегодный рост заболеваемости ВИЧ-инфекцией в среднем на 10% в год, но в 2018 г. показатель заболеваемости составил 70,8 на 100 тыс. населения, снизившись на 2,6% по сравнению с показателем 2017 г. Однако сохраняется тенденция к увеличению числа больных СПИДом и связанных с ним летальных исходов: так, в 2018 г. в Российской Федерации умерли 280 833 больных ВИЧ-инфекцией (на 2,3% больше, чем в 2017 г.) [3].
Стандартное отношение заболеваемости (SIR, Standard incidence ratio) служит наиболее часто используемым эпидемиологическим показателем оценки риска возникновения злокачественных новообразований при ВИЧ-инфекции [10]. До появления антиретровирусной терапии (АРВТ) данный показатель для меланомы при ВИЧ/СПИД составлял 1,26 (95% доверительный интервал [ДИ] – 1,11–1,43) и 1,28 (95% ДИ – 1,10–1,49) для исследований с учетом этнической принадлежности. Риск развития меланомы у людей с ВИЧ/СПИДом остается повышенным и в эпоху АРВТ с увеличением на 50% по отношению к общей популяции [7].
Сам по себе факт выявления у пациента ВИЧ-инфекции не является абсолютным противопоказанием к проведению любых видов лекарственного лечения, применяемых при меланоме. Ограничением могут служить реакции индивидуальной непереносимости, клинически тяжелое общее состояние пациента, связанное со СПИДом, развитием оппортунистических поражений и инфекций у больных. Также существуют научные работы, описывающие более частое выявление сопутствующих инфекций у ВИЧ-положительных пациентов с лимфопролиферативными злокачественными заболеваниями, чем с солидными опухолями [4].
Однако группа больных с сочетанием диагнозов меланомы и ВИЧ-инфекции может иметь крайне неблагоприятный прогноз в отношении течения онкологического процесса и общей выживаемости, а наличие возможных осложнений обоих заболеваний может препятствовать проведению лечения в адекватном объеме [12].
Особую настороженность у специалистов, занимающихся системным противоопухолевым лечением, вызывает факт проведения АРВТ у пациентов с ВИЧ-инфекцией и диссеминированной меланомой, т.к. существует риск возникновения реакций лекарственного взаимодействия на фоне противоопухолевой терапии. Дифференцировать же истинные осложнения лечения предназначенными для терапии злокачественных опухолей агентами и подобных реакций при множественной фармакотерапии может не представляться возможным. К тому же пациенты данной популяции редко включаются в международные клинические исследования из-за их иммунодефицитного статуса, потенциальных лекарственных взаимодействий и влияния ВИЧ-инфекции на безопасность и активность исследуемых агентов, а следовательно, на частоту осложнений современного системного лечения метастатической меланомы у ВИЧ-положительных пациентов, получающих АРВТ, можно проследить лишь на основании единичных опубликованных клинических случаев из реальной онкологической практики.
По данным национального опроса медицинских онкологов, занимающихся системным противоопухолевым лечением, в США значительная часть (23%) врачей изменит свои рекомендации по лечению распространенного злокачественного заболевания в зависимости от ВИЧ-статуса пациента: 18% не будут использовать стандартные химиотерапевтические препараты, 48% будут применять более низкие дозы и меньшее количество циклов, а 51% прекратят противоопухолевую терапию, если при лечении ВИЧ-инфицированных пациентов возникнут побочные эффекты [14].
Опасения в отношении переносимости системного противоопухолевого лечения пациентов с ВИЧ, получающих АРВТ, приводят к тому, что врачи-онкологи останавливают свой выбор на препаратах с максимально предсказуемыми терапевтическими эффектами и управляемым спектром нежелательных эффектов.
В эпоху активного иммуноонкологического лечения метастатической меланомы для пациентов с наличием мутации BRAF V600, метастатическим поражением головного мозга, интенсивными темпами прогрессирования онкологического процесса, клинически значимыми осложнениями заболевания приоритетное значение приобретает применение режимов комбинированной таргетной терапии. Для ВИЧ-положительных пациентов с диссеминированными формами меланомы, учитывая возможное более агрессивное течение заболевания, рассмотрение комбинированных режимов с использованием ингибиторов тирозинкиназы, становится еще более актуальным.
Для лечения пациентов с неоперабельной или метастатической меланомой кожи при наличии мутации BRAF V600E или V600K в настоящее время одобрены к применению следующие комбинации МЕК- и BRAF-ингибиторов: кобиметиниб (Котеллик) в сочетании с вемурафенибом (Зелбораф) и траметиниб (Мекинист) в комбинации с дабрафенибом (Тафинлар). Совместное применение ингибиторов МЕК и BRAF приводит к двойной блокаде МАРК-киназного пути, что потенцирует ингибирование опухолевого роста, препятствует или замедляет развитие приобретенной резистентности, блокирует парадоксальную активацию пути MAPK [15–18]. Профиль токсичности комбинированных режимов таргетной терапии продемонстрировал удовлетворительную переносимость и управляемый характер в рамках проведения международных клинических исследований [5, 19]. Однако нами не было обнаружено опубликованных работ, описывающих особенности применения в реальной клинической практике комбинации МЕК- и BRAF-ингибиторов пациентами с метастатической формой BRAF-положительной меланомы в сочетании с АРВТ, проводимой по причине наличия ВИЧ-инфекции.
Поэтому хотим представить наш клинический опыт применения комбинированного таргетного режима вемурафениб+кобиметиниб в лечении метастатической меланомы кожи с мутацией BRAF V600E у пациента с наличием ВИЧ-инфекции, получающего АРВТ.
Клинический случай
Пациентка З. 52 лет больна с июня 2014 г., когда отметила появление кровоточивости из пигментного невуса кожи в области левой лопатки. 15.08.2014 было выполнено широкое иссечение опухоли кожи левой лопаточной области. Морфологически верифицирована эпителиоидно-клеточная меланома кожи с изъязвлением, стадия pT4bNxM0. Рекомендовано динамическое наблюдение. Адъювантную терапию не получала. В 2014 г. также была диагностирована ВИЧ-инфекция, стадия 4А, начата АРВТ.
В конце лета 2018 г. выявлены метастазы меланомы в регионарных лимфатических узлах. Висцеральных метастазов диагностировано не было.
В августе 2018 г. выполнена подмышечно-подключично-лопаточная лимфодиссекция слева. Рекомендовано дальнейшее динамическое наблюдение.
Контрольное обследование в конце июля 2019 г. выявило метастатический процесс в легких, мягких тканях волосистой части головы, грудной клетки, брюшной полости и малого таза.
В августе 2019 г. после предъявления жалоб на появление головных болей и слабости по данным МРТ головного мозга от 21.08.2019 обнаружено не менее трех метастазов в веществе головного мозга. Уровень лактатдегидрогеназы (ЛДГ) находился в пределах референсных значений.
По данным молекулярно-генетического исследования, выявлена мутация BRAF V600E.
На момент прогрессирования меланомы пациентка получала следующие антиретровирусные препараты: ритонавир, абакавир, ламивудин и дарунавир.
Количество клеток CD4 Т-хелперов периферической крови в сентябре 2019 г. сохранялось на уровне 352 кл/мкл, а количественное определение РНК HIV-1 показывало отрицательный результат.
После согласования с лечащим врачом-инфекционистом со 02.09.2019 начата комбинированная таргетная терапия вемурафенибом и кобиметинибом в стандартных терапевтических дозах: вемурафениб – 960 мг×2 раза в сутки, кобиметиниб – 60 мг×1 раз в сутки.
Через 10 дней от начала противоопухолевого лечения пациентка отметила появление крупнопятнистой розовой сыпи 2-й степени тяжести, купированной отменой таргетной терапии сроком на 6 дней. Однако уже через 14 дней с момента возобновления системного противоопухолевого лечения клинически отмечены частичный регресс всех образований в мягких тканях головы и туловища, улучшение общего самочувствия, исчезновение слабости и головных болей.
18.09.2019 проведена стереотаксическая лучевая терапия на область метастазов в головном мозге, после чего пациентка получала с противоотечной целью дексаметазон 8 мг/сут пер-орально с постепенным снижением дозы, на фоне чего развился синдром Кушинга.
В конце сентября 2019 г. отмечено повышение уровня ЛДГ в 2 раза выше верхней границы нормы – 437 ЕД/л.
С 01.10.2019 появились жалобы на отеки нижних конечностей в области голеней, преимущественно слева, пигментацию кожи нижних конечностей, мелкоточечную геморрагическую сыпь по типу васкулита (рис. 1), трещины на коже голеней и тыльной поверхности кистей, потерю чувствительности кожи голеней обеих нижних конечностей, эпизодическую лихорадку тела до 38°С в вечернее время суток.
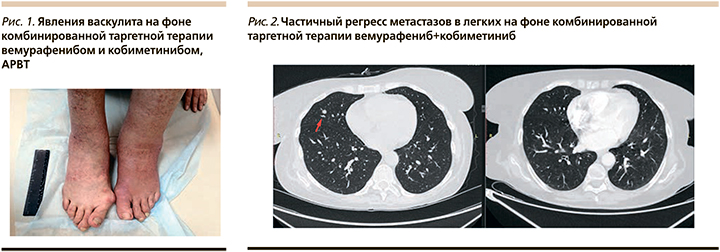
После исключения инфекционной природы изменений по результатам консультации лечащего врача-инфекциониста и общего хирурга состояние было купировано отменой обоих таргетных препаратов на 7 дней и назначением системной антигистаминной терапии.
С 07.10.2019 по рекомендации лечащего врача-инфекциониста выполнена замена АРВТ (долутегравир, тенофовир, ламивудин), на фоне которой отмечались периодические носовые кровотечения до ноября 2019 г.
Комбинированная таргетная терапия вемурафенибом и кобиметинибом была продолжена в полных дозах.
По данным МРТ головного мозга от 06.01.2020, были выявлены новые, ранее не определяемые церебральные метастазы малых размеров на фоне уровня ЛДГ в пределах референсных значений.
С 14.01.2020 пациентка начала предъявлять жалобы на нарушение сна, боли в мышцах верхних и нижних конечностей, что, по данным консультации врача-невролога, было расценено как явление токсической полинейропатии.
30.01.2020 был проведен повторный сеанс стереотаксической лучевой терапии на область ранее не определяемых метастазов в головном мозге с последующей противоотечной терапией дексаметазоном 12 мг/сут перорально с последующим медленным снижением дозы до марта 2020 г.
По данным контрольного обследования в феврале 2020 г. по сравнению с данными от июля 2019 г. выявлен частичный регресс метастазов в легких без появления новых очагов (рис. 2).
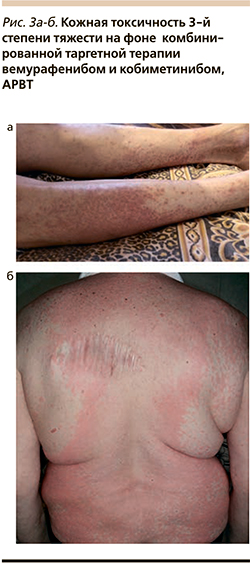 С 26.02.2020 на фоне продолжающейся после облучения метастазов в головном мозге терапии дексаметазоном в дозе 2 мг/сут отмечено появление кожной токсичности 3-й степени тяжести с развитием отека Квинке (рис. 3а, 3б). Состояние было купировано в условиях круглосуточного стационара с 28.02.2020 по 02.03.2020
С 26.02.2020 на фоне продолжающейся после облучения метастазов в головном мозге терапии дексаметазоном в дозе 2 мг/сут отмечено появление кожной токсичности 3-й степени тяжести с развитием отека Квинке (рис. 3а, 3б). Состояние было купировано в условиях круглосуточного стационара с 28.02.2020 по 02.03.2020
Прервана таргетная терапия, проведена системная десенсибилизирующая терапия антигистаминными препаратами, дексаметазоном в дозе до 20 мг/сут с постепенным снижением дозы до апреля 2020 г.
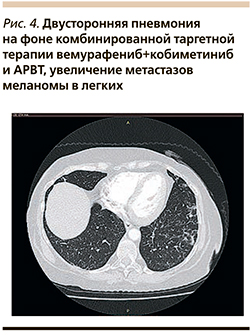
По данным плановой компьютерной томографии органов грудной клетки от 10.04.2020 диагностирована двусторонняя пневмония без клинической симптоматики. С учетом условий пандемии новой коронавирусной инфекции COVID-19 дважды с интервалом в 7 дней был получен отрицательный тест методом ПЦР на наличие вируса. Пациентка эмпирически получала антибактериальную и противогрибковую терапию в течение 10 дней в амбулаторных условиях.
По данным рентгенологического контроля от 23.04.2020, не было выявлено отрицательной динамики пневмонии, однако отмечено увеличение метастазов меланомы в легких в рамках стабилизации (рис. 4).
 Кожная токсичность тяжелой степени была трактована как осложнение проводимой комбинированной таргетной терапии с возможными межлекарственными взаимодействиями с АРВТ, что потребовало редукции доз обоих таргетных препаратов до 1-й ступени: вемурафениб – 720 мг×2 раза в сутки, кобиметиниб – 40 мг×1 раз в сутки. Учитывая стабильное общее состояние, отсутствие абсолютных противопоказаний, предполагаемое получение пациенткой пользы от лечения, с 24.04.2020 комбинированная таргетная терапия была продолжена в редуцированных дозах.
Кожная токсичность тяжелой степени была трактована как осложнение проводимой комбинированной таргетной терапии с возможными межлекарственными взаимодействиями с АРВТ, что потребовало редукции доз обоих таргетных препаратов до 1-й ступени: вемурафениб – 720 мг×2 раза в сутки, кобиметиниб – 40 мг×1 раз в сутки. Учитывая стабильное общее состояние, отсутствие абсолютных противопоказаний, предполагаемое получение пациенткой пользы от лечения, с 24.04.2020 комбинированная таргетная терапия была продолжена в редуцированных дозах.
Обсуждение
По мере увеличения продолжительности жизни ВИЧ-инфицированных людей на фоне проведения АРВТ будет расти и число пациентов с ВИЧ и злокачественными опухолями. По имеющимся сегодня научным данным, применение АРВТ не уменьшает риска возникновения ВИЧ-неассоциированных злокачественных опухолей [20]. Поэтому сегодня особую социальную значимость имеет поиск наиболее эффективных и безопасных режимов противоопухолевой терапии для этой категории больных.
Наш клинический опыт демонстрирует возможность проведения эффективной комбинированной таргетной терапии вемурафенибом и кобиметинибом у пациентов с метастатическими формами меланомы кожи, которым проводится АРВТ.
Основным затрудняющим лечебный процесс обстоятельством для нас стали сложности в дифференциальной диагностике между истинными осложнениями таргетной терапии и явлениями множественных лекарственных взаимодействий с препаратами АРВТ. Согласно официальным инструкциям к применению препаратов вемурафениб и кобиметиниб, имеются ограничения их совместного применения с субстратами цитохрома-Р450 (CYP), в особенности мощными индукторами и ингибиторами изоферментов CYP3A4, CYP1A2 [21, 22]. Вемурафениб может увеличивать экспозицию препаратов-субстратов изофермента CYP1A2 и снижать экспозицию препаратов-субстратов изофермента CYP3A4 в плазме крови. Противопоказанием к применению кобиметиниба служит одновременный прием с мощными и умеренными индукторами изофермента CYP3A и мощными ингибиторами изофермента CYP3A. Если одновременного применения с мощным ингибитором изофермента CYP3A нельзя избежать, следует тщательно следить за безопасностью пациентов. В случае кратковременного (≤7 дней) применения мощных ингибиторов изофермента CYP3A следует рассматривать возможность приостановки лечения кобиметинибом во время применения такого ингибитора. Многие препараты АРВТ являются мощными и умеренными ингибиторами изофермента CYP3A. Некоторые препараты, входящие в группу изоферментов CYP3A4, CYP1A2, представлены в таблице.

Мы связываем развитие явлений кожной токсичности и васкулита в первый месяц применения комбинированной таргетной терапии вемурафенибом и кобиметинибом с межлекарственным взаимодействием с двумя препаратами АРВТ (ритонавир, дарунавир), являющимися мощными ингибиторами изофермента CYP3A4 и обладающими узким терапевтическим потенциалом. Последующая коррекция АРВТ способствовала отсутствию токсических явлений в течение 5 месяцев совместного лечения.
Длительное применение дексаметазона не рекомендовано пациентам с ВИЧ-инфекцией ввиду возможных дополнительных иммуносупрессивных явлений и риска развития оппортунистических инфекций. Кроме того, дексаметазон является умеренным индуктором изофермента CYP3A4, что служит ограничением для его совместного применения с кобиметинибом ввиду значительного уменьшения концентрации последнего в плазме крови и снижения терапевтического эффекта. Совместное применение дексаметазона с вемурафенибом также может приводить к снижению экспозиции последнего. Однако достоверно подтвердить связь зарегистрированного увеличения метастазов в легких на фоне длительного применения дексаметазона совместно с комбинацией вемурафениб+кобиметиниб у наблюдаемой пациентки не представляется возможным. Также для нас остаются неясными в подобной клинической ситуации причины развития выраженной кожной токсичности в марте 2020 г. при продолжающейся терапии дексаметазоном. Этиология и возможный патогенез возникновения бессимптомной двусторонней пневмонии требуют дальнейшего изучения.
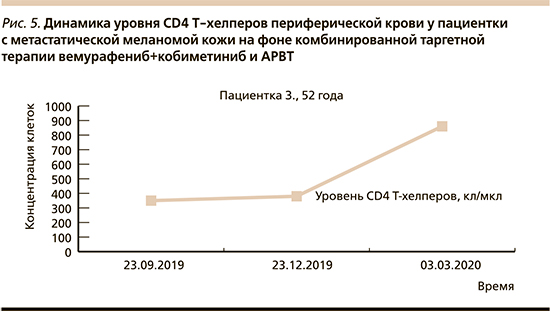
При применении комбинированной таргетной терапии вемурафенибом и кобиметинибом для лечения диссеминированной меланомы кожи в сочетании с АРВТ мы не отметили снижения уровня CD4 Т-хелперов периферической крови у наблюдаемой ВИЧ-положительной пациентки (рис. 5).
С учетом изначальной степени распространения меланомы на момент начала противоопухолевой терапии, полученного эффекта и возможности коррекции токсических эффектов в крайне быстрые сроки обоснованно проведение лечения комбинацией таргетных препаратов вемурафениб+кобиметиниб в рассмотренной нами клинической ситуации. У пациентки сохраняется удовлетворительное общее состояние и эффект стабилизации опухолевого процесса после 8 месяцев лечения.
Заключение
В настоящее время наблюдается сложная эпидемиологическая обстановка в отношении как ВИЧ-инфекции, так и других инфекционных заболеваний, что определяет необходимость освоения врачами-онкологами большого объема информации об этиологии, патогенезе и особенностях лечебного процесса в данной области. С учетом многофакторного характера ВИЧ и онкологических заболеваний, а также потенциального взаимодействия между антиретровирусными и противоопухолевыми препаратами необходимы улучшенная координация лечения и связи между онкологами и специалистами-инфекционистами. Также необходимо накопление клинического опыта совместного применения АРВТ и противоопухолевых препаратов, включение ВИЧ-положительных пациентов в клинические исследования и программы раннего доступа для получения полной информации об эффективности и безопасности лечения данной категории больных.



