Введение
На сегодняшний день перспективным методом лекарственного лечения злокачественных новообразований являются стратегии, основанные на поиске и подавлении «триггерных» мишеней с учетом биологии роста опухоли [1]. К ним относятся следующие ингибиторы:
- рецептора эпидермального фактора роста;
- киназ клеточного цикла;
- сигналов сосудистого эндотелиального фактора роста;
- теломеразы;
- аэробного гликолиза;
- системы репарации ДНК;
- фактора роста фибробластов или c-MET;
- стволовых клеток;
- CTLA4 и PD-1/PD-L1;
- циклооксигеназ и простагландинов;
- проапоптотических ферментов (BH3).
В итоге в арсенале клинического онколога принципиально имеются следующие возможности воздействия на злокачественные клетки: цитостатики, таргетная терапия, иммунотерапия и экспериментальные направления, целью которых служат регуляция метаболизма опухоли и эпигенетическая терапия. В результате подобные методы, безусловно, приводят к увеличению продолжительности жизни. Например, лекарственная терапия современными препаратами увеличивает медиану общей выживаемости больных раком молочной железы (РМЖ) с 32 до 50 месяцев [2],толстой кишки с 5–6 до 30 [3], желудка с 3–5 до 16 [4], легкого с 3,9 до 36 месяцев [5]. С другой стороны, иммунотерапевтические принципы лечения позволяют обсуждать 20%-ную возможность излечения. К сожалению, подобные успехи в большинстве своем характерны для определенной группы больных с учетом специфических предиктивных факторов [6]. В общей популяции подобная тенденция не столь выражена. Это обусловлено многими факторами, к которым относятся особенности кинетики роста, гетерогенность опухолевой популяции, опухолевая эволюция, репопуляция клеток, лекарственная резистентность, микроокружение или опухолевый матрикс, эпигенетические нарушения, тканевая иммуносупрессия, константы гомеостаза (pH, гликемия), стволовые клетки [7]. С целью возможности преодоления подобной резистентности опухолевых клеток разрабатываются новые стратегии терапии. К ним относится метрономная терапия (МТ) злокачественных опухолей. Это один из вариантов dose-dense терапии, в котором химиопрепараты назначаются через определенные короткие промежутки времени (часы, дни, недели) в низких (10–40% от терапевтической) дозах с целью увеличения продолжительности жизни больных неизлечимыми диссеминированными солидными опухолями [8]. Концепция применения метрономной терапии заключается в торможении роста злокачественных клеток, что теоретически снизит вероятность достижения «летального» объема опухоли и тем самым может повлиять на показатели выживаемости (рис. 1).
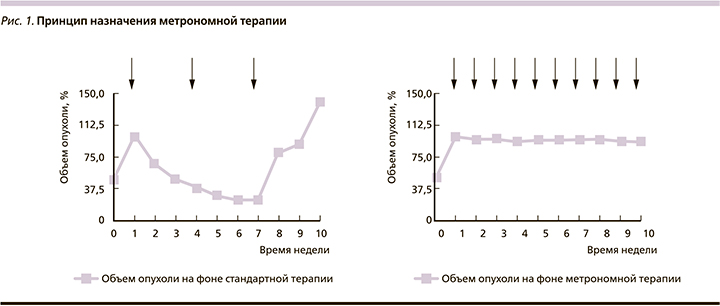
Метрономная терапия: от истоков к современности
История МТ началась с работ J. Folkman, который предположил возможность терапевтического воздействия на опухолевый ангиогенез [9]. В 1991 г. в лаборатории R. Kerbel было показано влияние цитостатиков на сосудистое русло в опухоли. В дальнейшем исследования Klement и Browder продемонстрировали возможность достижения значительного торможения роста опухоли низкими дозами химиопрепаратов на различных преклинических моделях. В то же время Hanahan предложил термин «метрономная терапия» [10].
Механизм действия МТ заключается в снижении пролиферации и ангиогенного потенциала эндотелиоцитов в опухоли, повышении экспрессии тромбоспондина-1, подавлении функции циркулирующих эндотелиальных клеток, блокаде мобилизации клеток-предшественниц эндотелиоцитов из костного мозга, а также в нормализации структуры сосудистой сети и в повышении перфузии опухолевой ткани.
Кроме того, обсуждается значительное влияние низких доз цитостатиков на регуляцию иммунной системы организма в виде повышения иммуногенности и возможности презентации антигенов, на мобилизацию антиген-презентирующих клеток, подавление функции Т-регуляторов и на повышение активности цитотоксических лимфоцитов. Несомнен факт их прямого воздействия на опухолевые клетки [11].
В качестве примера изучено антиангиогенное действие препаратов, связывающих микротрубочки. Оно заключается в повышении динамической нестабильности микротрубочек, нарушении переориентации центра организации микротрубочек, ослаблении сигнала от рецептора сосудистого эндотелиального фактора роста 2-го типа, пониженнии активации интегрина, ингибировании сигнала FAK/паксиллин/AKT, потере Hsp90, ингибировании активации eNOS, нарушении образования фокальных контактов, пониженной пролиферации и поляризации клеток, подавлении миграции клеток, разрушении связи микротрубочка+белок TIP, реорганизации актина в стресс-волокна, ингибировании сигнала Ras/Erk/Net (Elk3), повышении фосфорилирования MLC и сократимости актиномизина, изменении сигнала Rho-GTP-аза, разрушении VE-кадгерина, ингибировании сигнала VE-кадгерин/β-катенин/AKT, ингибировании образования трубочек, повышении проницаемости клеток, в регрессии капиллярных трубочек [12].
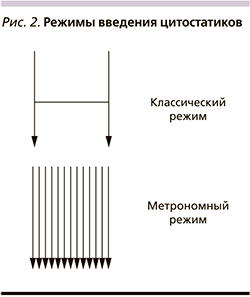 Назначение МТ подразумевает определение оптимальной дозы цитостатика, режима, интервала, времени назначения, а также в последовательности использования препаратов и их комбинаций. На сегодняшний день преклинические исследования демонстрируют эффекты цитостатиков в зависимости от дозы: противоопухолевый и антиангиогенный [13]. Так, например, при метрономном применении винорелбина низкие дозы препарата приводят к подавлению ангиогенеза в опухоли [14]. Что касается режима введения цитостатика, то их непрерывное назначение позволяет влиять на репопуляцию эндотелиоцитов в опухолевой ткани, что, возможно, способствует контролю роста опухоли (рис. 2).
Назначение МТ подразумевает определение оптимальной дозы цитостатика, режима, интервала, времени назначения, а также в последовательности использования препаратов и их комбинаций. На сегодняшний день преклинические исследования демонстрируют эффекты цитостатиков в зависимости от дозы: противоопухолевый и антиангиогенный [13]. Так, например, при метрономном применении винорелбина низкие дозы препарата приводят к подавлению ангиогенеза в опухоли [14]. Что касается режима введения цитостатика, то их непрерывное назначение позволяет влиять на репопуляцию эндотелиоцитов в опухолевой ткани, что, возможно, способствует контролю роста опухоли (рис. 2).
Эффективность МТ продемонстрирована во многих клинических исследованиях. Объективный ответ опухоли на лечение в среднем составлял 19–34% [15]. Мета-анализ 22 исследований метрономного режима при РМЖ, в который были включены 1360 больных, показал клиническую эффективность в 55% случаев, время до прогрессирования 6 месяцев — 56% больных и 2-летнюю общую выживаемость — 40% [15]. Среди особенностей подобных работ можно выделить следующие: в основном исследования I—II фаз, гетерогенность включенных пациентов, эмпирический выбор цитостатиков и режима, использование в качестве оценки эффективности лечения объективного ответа, а не общей выживаемости. В целом для МТ при РМЖ предпочтение отдавалось препаратам с высокой биодоступностью при применении внутрь и возможности частого внутривенного введения цитостатиков. В качестве примера назначение пожилым больным винорелбина внутрь в метрономном режиме приводило к увеличению времени до прогресирования болезни до 9,2 месяца [16].
Эффективность комбинации метрономного режима применения цитостатиков была продемонстрирована в исследовании VICTOR-2. В нем приняли участие 80 больных, из которых у 28 был диагностирован тройной негативный фенотип РМЖ. Капецитабин и винорелбин назначались в 1-й (35 больных) и 2-й линиях (45 больных) лечения. Частота объективного ответа составила 35,5 и 25,6% соответственно. Время до прогрессирования, превысившее 1 год, регистрировалось более чем у 20% больных. При этом клинически значимой токсичности практически не наблюдалось: фебрильная нейтропения была зарегистрирована у 0,4%, а слабость у 0,7% больных [17]. Низкая токсичность при применении метрономного режима применения цитостатиков послужила основанием исследования тройной комбинации препаратов в низких дозах при РМЖ. В исследовании VEX время до прогрессирования на фоне метрономного применения циклофосфамида, капецитабина и винорелбина в первой линии лечения составило 25,1 месяца [18]. Несмотря на активное изучение новых метрономных доз винорелбина, в клинические рекомендации лечения РМЖ в Российской Федерации входят следующие эффективные режимы его применения: 60 мг/м2 внутрь в 1-й, 8-й и 15-й дни; с 22-го дня — 80 мг/м2 1 раз в неделю.
По сравнению со стандартным режимом введения метрономный винорелбин демонстрирует схожую эффективность при более низкой токсичности. В исследовании XeNa объективный ответ опухоли составил 21,4 и 20,8%, клиническая эффективность — 37 и 41%, общая выживаемость — 660 и 701 день соответственно [19].
Заключение
Таким образом, МТ представляет собой новую парадигму лекарственного лечения в связи с интегрирующим воздействием как на опухолевые клетки, так и на их микроокружение. Данный подход демонстрирует клиническую эффективность определенной группы больных, резистентных к стандартной терапии. При этом длительная стабилизация процесса (более 6 месяцев), вероятно, может быть суррогатным маркером увеличения продолжительности жизни. С учетом механизма действия низких доз цитостатиков перспективным считается комбинация препаратов с различными терапевтическими опциями (иммунотерапия, антиангиогенная терапия).
На сегодняшний день подобная стратегия терапии требует изучения предиктивных маркеров. А с целью получения доказательной базы, безусловно, необходимо проведение масштабных рандомизированных исследований.



