Введение
Заболеваемость и смертность от плоскоклеточного рака слизистой оболочки полости рта занимают значимое место в структуре заболеваемости как в мире, так и в России. Анализ структуры заболеваемости в России, ежегодно проводимый МНИОИ им. П.А. Герцена (филиал ФГБУ «НМИЦ радиологии» Минздрава РФ), достоверно показывает, что смертность от злокачественных новообразований органов головы и шеи (в т.ч. и слизистой оболочки полости рта), по данным 2017 г., приближается к 50% от всех впервые выявленных случаев заболевания [1]. Формирование очага плоскоклеточного рака слизистой оболочки полости рта – сложный многоступенчатый процесс, развивающийся под действием как внутренних, так и внешних факторов негативного воздействия. Как известно, к основным внешним негативным факторам его развития относятся табакокурение, злоупотребление алкоголем и неадекватная гигиена полости рта, пагубно влияющие на структуру нормальной слизистой оболочки, особенно у лиц, имеющих генетическую предрасположенность к развитию онкопатологии [2]. Помимо общеизвестных факторов, повышающих риск возникновения плоскоклеточного рака слизистой оболочки полости рта, а также известных предопухолевых заболеваний, имеется целый каскад факторов, таких как воспаление, иммунологическое окружение и вирусные инфекции [3], которые могут служить возможным и важным звеном в патогенезе злокачественных заболеваний. А в ряде случаев при сочетанном воздействии неблагоприятных факторов как внутренней, так и внешней среды могут потенцировать развитие 15–20% злокачественных опухолей, в т.ч. и плоскоклеточного рака слизистой оболочки полости рта [4].
Основной целью исследования было выявление ДНК вирусов простого герпеса I и II типов (ВПГ-I, -II), цитомегаловируса (ЦМВ), вируса Эпштейна–Барр (ЭБВ) и вирусов папилломы человека 6-го, 11, 16 и 18-го типов (ВПЧ-6, -11, ВПЧ-16, ВПЧ-18) в очагах плоскоклеточного рака слизистой оболочки полости с последующим определением прогностической роли выявленных вирусов относительно показателей выживаемости больных.
Методы
Для достижения цели проведено проспективное исследование, объектом которого стали 116 пациентов с впервые верифицированным диагнозом «плоскоклеточный рак слизистой оболочки полости рта». Все больные впервые обратились в СПбГБУЗ «Городской клинический онкологический диспансер» с 2012 по 2013 г. для проведения диагностических и лечебных процедур. Общий период наблюдения составил 78,5 месяцев, срез информации о выживаемости пациентов произведен 17.07.2019.
Критерии включения больных в исследование:
- Добровольное информированное согласие для участия в исследовании.
- Возраст, превышающий 18 лет.
- Гистологическое подтверждение диагноза «плоскоклеточный рак слизистой оболочки полости рта».
Критерии невключения больных в исследование:
1. Зарегистрированные отдаленные метастазы плоскоклеточного рака слизистой оболочки полости рта или наличие второй злокачественной опухоли.
Исследуемую группу пациентов составили 39 (33,6%) женщин и 77 (66,4%) мужчин, их средний возраст – 60,80±0,96 года (95% доверительный интервал [ДИ]: 58,90–62,70).
У 49 (42,2%) больных локализация первичного опухолевого очага была в области передней и средней третей языка, у 32 (27,6%) – слизистая оболочка дна полости рта. Слизистая оболочка альвеолярной части нижней челюсти первично была поражена у 8 (6,9%) больных, щеки – у 7 (6,0%). Реже поражалась слизистая оболочка передней небной дужки и крылочелюстной складки (3 [2,6%] больных). Слизистая оболочка альвеолярного отростка верхней челюсти, ретромолярной области и твердого неба первично была поражена у 2 (1,7%) больных, слизистая оболочка мягкого неба и нижней губы – у 1 (0,9%) соответственно.
Начальные стадии болезни (0, I и II) были зарегистрированы у 24 (20,7%) больных (1,7%, 5,2 и 13,8% соответственно). У 18 (15,5%) больных первично была диагностирована III стадия заболевания, у более чем половины больных (68 [58,6%]) первично зарегистрирована IVА-стадия. У 6 (5,2%) больных первичная опухоль была нерезектабельной (T4b) или поражение регионарных лимфатических узлов было более 6 см (N3; IVB-стадия).
Гистологическое исследование позволило выявить, что у 35 (30,2%) больных дифференцировка опухоли была высокой (G1), у 34 (29,3%) – умеренной (GII), у 13 (11,2%) – низкой (GIII). Практически в трети всех случаев (34 [29,3%]) степень дифференцировки не определялась.
В 51 (44,0%) случае при гистологическом исследовании был выявлен плоскоклеточный рак с ороговением, в 29 (25,0%) ороговение отсутствовало, в 5 (4,3%) случаях ороговение трактовалось как частичное, а в 31 (26,7%) образце факт ороговения не оценивался.
Под местной инфильтрационной анестезией у больных плоскоклеточным раком слизистой оболочки полости рта производили забор опухолевой ткани размером 0,5х0,5 см. Затем образец фиксировали в растворе этилендиаминтетрауксусной кислоты (ЭДТА), после чего замораживали при t -20 °С.
Детекцию ДНК вирусов осуществляли при помощи полимеразной цепной реакции (ПЦР) в реальном времени (в лаборатории молекулярной диагностики ГБОУ ВО ПСПбГМУ им. И.П. Павлова). Качественную детекцию осуществляли с помощью наборов, использованных согласно инструкциям фирм-производителей. Чувствительность ПЦР-методов составила 102 генокопий в одной пробе.
Переменные, отражающие признаки, были проанализированы с использованием описательной статистики. Количественные переменные первоначально были оценены на нормальность распределения с помощью теста Шапиро–Уилка. Во всех случаях распределение было нормальным, поэтому их описание производилось с помощью среднего выборочного и ошибки среднего (M±m). Сравнение групп испытуемых по частоте встречаемости признака проводили с использованием z-критерия. Основными конечными точками исследования стали общая выживаемость (ОВ) пациентов, рассчитанная как период времени в месяцах от момента верификации плоскоклеточного рака слизистой оболочки полости рта до момента смерти пациента от любой причины; выживаемость без прогрессирования (ВБП), рассчитанная как время от момента начала лечения плоскоклеточного рака слизистой оболочки полости рта до момента регистрации прогрессирования заболевания (локо-регионального или отдаленного). Показатели выживаемости оценивались с помощью построения кривых по методу Каплана–Майера, сравнения кривых выживаемости с использованием log-rank-теста и построения регрессионной модели Кокса. Все показатели рассчитывались с двусторонним 95% ДИ и значением двустороннего «р». Статистическая обработка производилась с помощью пакета прикладных программы MedCalc® (ver. 19.0.7).
Результаты
В ходе анализа выявлено, что у 54 (46,6%) больных плоскоклеточным раком слизистой оболочки полости рта вирусная ДНК в структуре опухоли отсутствовала. У остальных достоверно чаще выявлялась ДНК вируса ЭБВ – 40 (34,5%) (р<0,0001). Все рассматриваемые типы ДНК вирусов папилломы человека (6, 11, 16 и 18) были выявлены в 48 (41,4%) случаев (p<0,0001), а по рассматриваемым подтипам: ВПЧ-6, 11–16 (13,8%) (p=0,005), ВПЧ-16–12 (10,3%) (p=0,001), ВПЧ-18–20 (17,2%) (р<0,0001). ДНК вирусов простого герпеса I и II типов и ЦМВ были ассоциированы с очагам плоскоклеточного рака значительно реже: ВПГ-I, -II – только у 2 (1,7%) пациентов, ЦМВ – у 5 (4,3%).
Проведенный анализ показателей выживаемости пациентов позволил определить, что медиана ОВ больных, в структуре опухоли которых удалось выявить ДНК рассматриваемых типов вирусов, составила 18,0 месяцев (95% ДИ: 13,5–32,5), медиана ОВ больных, в структуре опухоли которых ДНК вирусов не было, составила 14,5 месяцев (95% ДИ: 10,0–17,0: log-rank test; p=0,28). А вот медиана ВБП больных, в опухоли которых была выявлена вирусная ДНК, составила 12,0 месяцев (95% ДИ: 9,0–17,0) и превысила на 4,0 месяца медиану ВБП больных, у которых вирусная ДНК не была определена, где она составила 8,0 месяцев (95% ДИ: 5,0–12,0; р=0,31). Для оценки прогностической ценности ассоциации плоскоклеточного рака слизистой оболочки полости рта с ДНК рассматриваемых типов вирусов был проведен однофакторный анализ сравнения кривых выживаемости, результаты которого представлены в табл. 1.
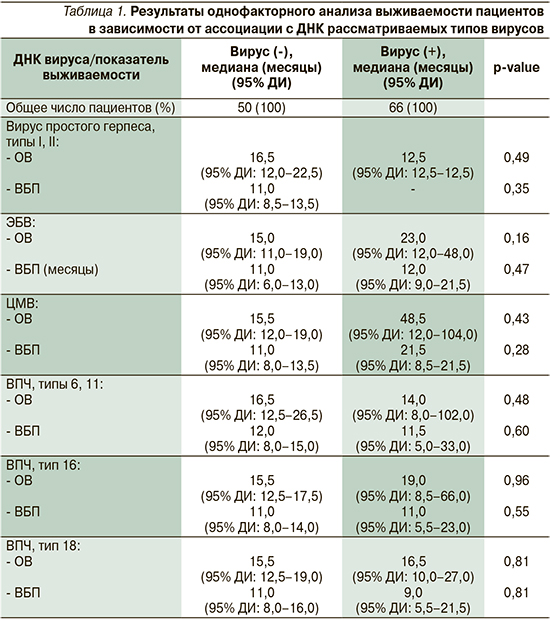
Проведенный однофакторный анализ влияния ассоциации ДНК рассматриваемых типов вирусов не выявил достоверной прогностической значимости ни одного из изучаемых вирусов. Однако необходимо отметить однозначную тенденцию к увеличению показателя ОВ в группе пациентов, опухоль которых была ассоциирована с ДНК ЭБВ, где она составила 23,0 месяца (95% ДИ: 12,0–48,0) и на 8,0 месяцев превысила показатель ОВ в группе пациентов вирус-негативных, где она составила 15,0 месяцев (95% ДИ: 11,0–19,0; log-rank test: p=0,16; ОР=0,72, 95% ДИ: 0,47–1,13). Кроме того, необходимо отметить интересную закономерность в отношении выживаемости тех пациентов, в структуре опухоли которых была выявлена ДНК ЦМВ, где показатели и ОВ, и ВБП значительно превышали показатели выживаемости в группе ЦМВ-негативных пациентов. Недостоверность полученных результатов, вероятнее всего, связана с малым количеством позитивных образцов.
Особый интерес представляет анализ выживаемости пациентов не только в зависимости от ДНК выявленного вируса, но и в сочетании с характером лечения, проведенного на инициальном этапе по поводу первичной опухоли. Распределение больных по проведенным комплексам лечебных мероприятий представлено в табл. 2.
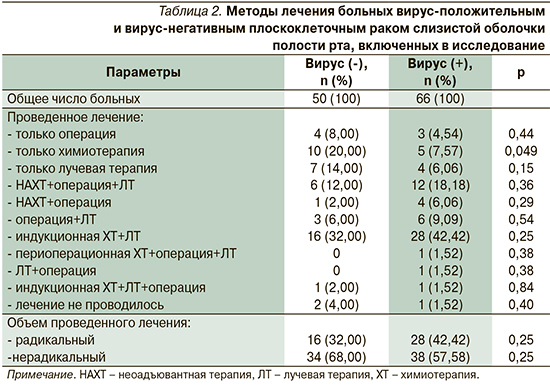
К сожалению, осуществленный нами анализ показал, что радикальному лечению были подвергнуты только 37,9% пациентов, хотя только 5,2% пациентов при первичном обследовании были отнесены к IVВ-стадии заболевания. Безусловно, пациенты, получившие радикальное лечение, имели достоверно более высокие показатели как ОВ: 56,5 (95% ДИ: 17,5–75,5) месяцев против 12,0 (95% ДИ: 10,0–15,0; log-rank test: p<0,0001; ОР=0,38, 95% ДИ: 0,25–0,57), так и ВБП: 51,0 (95% ДИ: 16,0–56,0) месяц против 8,0 (95% ДИ: 6,0–11,0; log-rank test: p<0,0001; ОР=0,38, 95% ДИ: 0,19–0,49). Учтя этот факт, мы проанализировали показатели выживаемости в когортах вирус-позитивных и вирус-негативных пациентов группы нерадикального лечения (рис. 1 и 2).
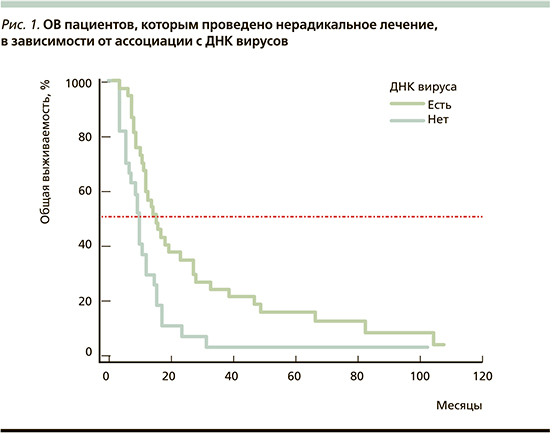
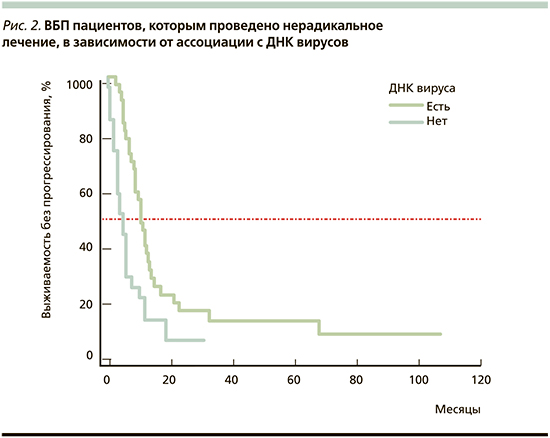
Медиана ОВ вирус-позитивных пациентов, которым было проведено нерадикальное лечение, составила 15,0 месяцев (95% ДИ: 12,0–27,0) и на 5,0 месяцев превысила ОВ в группе нерадикально пролеченных вирус-негативных пациентов: 10,0 месяцев (95% ДИ: 5,5–12,0; log-rank test: p=0,0049; ОР=0,43, 95% ДИ: 0,24–0,77).
Медиана ВБП в группе вирус-позитивных пациентов, которым было проведено нерадикальное лечение, также была достоверно выше и на 6,0 месяцев превысила этот показатель у пациентов, опухоль которых вирусную ДНК не содержала: 11,0 месяцев (95% ДИ: 9,0–13,5) против 5,0 (95% ДИ: 3,0–6,0; log-rank test: p=0,0053; ОР=0,42, 95% ДИ: 0,22–0,77).
Обсуждение
Проведенный анализ достоверно показал, что практически у половины больных плоскоклеточным раком слизистой оболочки полости рта в структуре опухоли определяется ДНК вирусов различных типов. Наиболее частая ассоциация наблюдалась с ДНК ЭБВ, выявленной у 34,48% (40/116). Аналогичное исследование С.А. Кирьянова и соавт. (2019), в котором проведено изучение образцов опухолевой ткани 10 больных плоскоклеточным раком слизистой оболочки полости рта, не выявило ДНК ВПЧ ни в одном из случаев, а детекция ДНК ЭБВ была положительной в 70,0% (7/10) случаев [5].
В отношении ассоциации плоскоклеточного рака слизистой оболочки полости рта с ВПЧ в ходе нашего исследования все изучаемые типы ВПЧ (6, 11, 16, 18) выявлялись в 41,4% (48/116) случаев: ВПЧ-6, -11 – 13,8%, ВПЧ-16 – 10,3%, ВПЧ-18 – 17,2%. Литературные данные, определяющие встречаемость ВПЧ в структуре плоскоклеточного рака, зачастую крайне разнородны. Например, N. Saghravanian et al. (Иран) в 2011 г. проанализировали 21 образец плоскоклеточного рака слизистой оболочки полости рта и выявили, что в очагах плоскоклеточного рака было 14,3% (3/21) ВПЧ-положительных образцов, в которых удалось выявить ДНК ВПЧ [6]. В 2017 г. T. Liu et al. (Китай) в 6 изученных образцах плоскоклеточного рака слизистой оболочки полости рта выявили ДНК ВПЧ 16-го и 18-го типов [7].
Влияние ДНК онкогенных вирусов на выживаемость пациентов, к сожалению, оценена в небольшом количестве исследований. В 2019 г. B.Y. Hernandes et al. выявили ДНК ВПЧ 16-го и 18-го типов у 38 (31,0%) из 122 больных плоскоклеточным раком слизистой оболочки полости рта. Но ни один из рассматриваемых типов вируса не оказал влияния на показатель ОВ пациентов [8]. А в исследовании V.B. Wookey et al. (США, 2019) вирус папилломы человека в структуре неорофарингеального рака органов головы и шеи оказал значимое положительное влияние на показатель ОВ (ОР=0,83, 95% ДИ: 0,74–0,93; p<0,001) [9].
Заключение
Проведенное нами исследование на значительном клиническом материале выявило достоверное положительное влияние ассоциации плоскоклеточного рака слизистой оболочки полости рта с ДНК вирусов простого герпеса I и II типов (ВПГ-I, -II), ЦМВ, (ЭБВ и вирусов папилломы человека 6-го, 11, 16 и 18-го типов, ВПЧ-6, -11, ВПЧ-16, ВПЧ-18) на показатели ОВ и ВБП, особенно в группе пациентов, которым было проведено нерадикальное лечение первичного опухолевого процесса: вирус-позитивные пациенты, получившие лечение по нерадикальной программе, показывали лучшие показатели как ОВ: 15,0 месяцев (95% ДИ: 12,0–27,0) против 10,0 (95% ДИ: 5,5–12,0; р=0,0049), так и ВБП: 11,0 месяцев (95% ДИ: 9,0–13,5) против 5,0 (95% ДИ: 3,0–6,0; р=0,0053).
Однако с учетом столь разнородных результатов как российских, так и зарубежных исследований, посвященных данной проблеме, требуется дальнейшее изучение прогностической роли вирусного фактора в развитии и течении плоскоклеточного рака слизистой оболочки полости рта.
Вклад авторов
Концепция и дизайн исследования – С.И. Кутукова, А.Б. Чухловин, А.И. Яременко. Сбор и обработка материала – С.И. Кутукова, Т.С. Ермакова, Ю.В. Иваськова, А.Я. Разумова. Статистическая обработка данных – С.И. Кутукова. Написание текста – С.И. Кутукова, А.Я. Разумова. Редактирование текста – А.И. Яременко, А.Б. Чухловин.
Источник финансирования
Работа выполнена в рамках Государственного задания Рег. № НИОКТР АААА-А18-118122590034-0.


