Введение
За последние несколько лет разработка новых иммуноонкологических препаратов (ИОП), способных потенцировать противоопухолевую активность иммунной системы, резко изменила подходы к лечению онкологических заболеваний.
В частности, применение ингибиторов контрольных точек иммунного ответа (immune checkpoint inhibitors) привело к выдающимся результатам в лечении ряда злокачественных новообразований [1]. В первую очередь речь идет о таких ингибиторах, как CTLA-4 (ипилимумаб), PD-1 (ниволумаб, пембролизумаб) и PD-L1 (атезолизумаб, дурвалумаб) [2].
С учетом специфического механизма действия ИОП реализация противоопухолевого иммунного ответа имеет ряд особенностей, отличающих его от прямого цитотоксического воздействия химиопрепаратов, в связи с чем необходимо использовать различные системы оценок эффективности модуляторов иммунного синапса.
Однако вместе с инновационным механизмом действия препаратов обнаружены необычные типы ответов на лечение. К ним относятся такие феномены, как псевдо- и гиперпрогрессирование [3]. Псевдопрогрессирование служит проявлением радиологического прогрессирования, включая увеличение имеющейся опухолевой массы и/или появление новых очагов поражения с последующей стабилизацией или уменьшением опухолевой нагрузки при дальнейших рентгенологических визуализациях. Феномен псевдопрогрессирования, вероятно, служит результатом продолжающегося роста опухоли до достижения адекватного иммунного ответа, рекрутирования цитотоксических Т-лимфоцитов и воспалительных реакций в опухолевой среде [4, 5]. По данным литературы, частота развития псевдопрогрессирования составляет примерно 10% при меланоме и 5% при немелкоклеточном раке легкого (НМРЛ) [6].
Такие типы ответов по системе RECIST (Response Evaluation Criteria In Solid Tumors), наиболее широко использующейся методики оценки эффективности терапии, свидетельствуют о прогрессировании процесса и необходимости смены лечебной тактики [7].
В исследовании J.D. Wolchok et al. показано, что у части больных с прогрессированием заболевания на фоне лечения ипилимумабом выживаемость не соответствовала опухолевому ответу и была гораздо длительнее [8]. Именно для выделения этой категории пациентов разработана система IrRC (Immune-Related Response Criteria) – первая из специализированных систем оценки ответа на иммунотерапию [9]. Новизна IrRC проявилась в появлении понятия опухолевой массы и требовании подтверждения прогрессирования заболевания при последующей оценке примерно через 4 недели.
Система оценки IrRC создана в ответ на необходимость оценки эффективности ипилимумаба для пациентов с диссеминированной меланомой в клинических протоколах [10]. Позднее эта система оценки была внедрена в другие исследования в области иммунотерапии по изучению применения новых ИОП при различных злокачественных опухолях.
К отличительным особенностям системы IrRC относится следующее: таргетными очагами, поддающимися измерению, считаются новые очаги – не более 5 на орган до 10 виcцеральных и 5 кожных. Измеряемыми являются очаги размером не менее 5×5 мм. В понятие «неизмеряемые очаги» включены остеобластические очаги, поражение мозговых оболочек, плевральный и перикардиальный выпот, асцит и перитонеальные метастазы, лимфогенный карциноматоз и образования без четких контуров. Введено понятие «опухолевая масса», которая рассчитывается по формуле: опухолевая масса=сумма произведений 2 max перпендикулярных размеров.
Принципиально важно, что появление новых очагов не является прогрессированием. Окончательная оценка ответа опухоли требует подтверждения через 4 недели.
Поэтому нами проведено исследование, целью которого стало сравнение использования систем RECIST 1.1 и IrRC при лечении ипилимумабом и ниволумабом больных диссеминированной неоперабельной формой меланомы кожи, метастатическим почечно-клеточным раком (ПКР) и НМРЛ.
Методы
В исследование включены 67 больных, получавших терапию ипилимумабом и ниволумабом в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России с 2014 по 2019 г.
Основные критерии включения в исследование: морфологически верифицированные диагнозы диссеминированной нерезектабельной формы меланомы кожи, метастатического ПКР и диссеминированного НМРЛ; проведение терапии ипилимумабом или ниволумабом; возможность оценки ответа на лечение по системам RECIST 1.1 и irRC.
Сравниваемые группы больных были сбалансированными по возрасту, стадии заболевания и средней длительности наблюдения (табл. 1). Все пациенты получали раннюю системную противоопухолевую терапию.
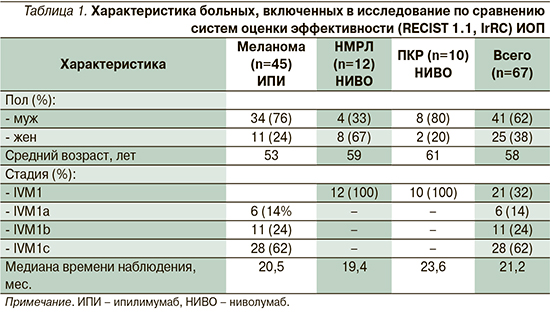
В исследование были включены 45 пациентов с диссеминированной меланомой кожи, получавших ипилимумаб: 34 (76%) – мужского пола, 11 (24%) – женского. Средний возраст составил 53 года, медиана времени наблюдения – 20,5 месяцев. Все больные имели IVM1-стадию заболевания: 6 (14%) – IVM 1a-ст., 11 (24%) – IVM 1b-ст., 28 (62%) – IVM 1b-ст.
Кроме того, в исследование включены 17 пациентов с метастатическим НМРЛ, получавших терапию ниволумабом: 4 (33%) – мужского пола, 8 (67%) – женского. Средний возраст – 59 лет. Медиана времени наблюдения – 19,4 месяца.
В рамках данного исследования проанализированы 10 пациентов с метастатическим ПКР, получавших ниволумаб: 8 (80%) – мужского пола, 2 (20%) – женского. Средний возраст – 61 год. Медиана времени наблюдения – 21,2 месяца.
Объективный ответ оценивался, согласно критериям систем RECIST 1.1 и IrRC, на 8–12-й неделях после начала терапии и далее каждые 8–12 недель в течение лечения и после его окончания [11]. В соответствии с требованиями систем оценки подтверждение эффектов проводилось не ранее чем через 4 недели при выявлении полного или частичного регресса по системе RECIST 1.1 и при выявлении полного регресса, частичного регресса или прогрессирования по системе irRC. В качестве оценки ответа на лечение использовался наилучший результат, достигнутый за время терапии и наблюдения. В случае выявления прогрессирования процесса оценка по системе RECIST 1.1 далее не проводилась.
Результаты
Оценен ответ 67 пациентов на проведенное лечение ингибиторами контрольных точек иммунного ответа с метастатической меланомой, НМРЛ и ПКР. Объективный ответ был достигнут от 4 (9%) пациентов группы диссеминированной меланомы по обеим системам оценки, от 2 (20%) с метастатическим ПКР при оценке по RECIST 1.1 и от 4 (40%) при оценке по IrRC. Больными НМРЛ объективный ответ не был достигнут.
Полный регресс (ПР) по обеим системам выявлен у 1 (2%) пациента группы метастатической меланомы и у 1 (10%) больного с ПКР. ПР группой пациентов с НМРЛ не был достигнут.
Частичный регресс (ЧР) зарегистрирован у 3 (7%) больных метастатической меланомой по обеим системам.
В группе пациентов с ПКР он отмечен у 2 (20%) больных по критериям RECIST 1.1, у 4 (40%) – по критериям IrRC.
Стабилизация заболевания (СЗ) выявлена у 3 (7%) пациентов группы диссеминированной меланомы по системе RECIST 1.1 и у 10 (22%) при оценке по IrRC; у 2 (17%) пациентов с метастатическим НМРЛ по системе RECIST 1.1 и у 5 (42%) по критериям IrRC.
В группе больных ПКР у 5 (50%) пациентов выявлена СЗ по системе RECIST 1.1 и у 4 (40%) по критериям IrRC.
При оценке ПР и прогрессирования заболевания (ПЗ) во всех группах пациентов различия при сравнении эффективности по системам RECIST 1.1 и irRC оказались статистически не значимыми (р=0,670 и p=0,720 соответственно).
При оценке ЧР и СЗ по системам RECIST 1.1 и IrRC также выявлены статистически значимые различия показателей (р=0,490 и p=0,410 соответственно).
Расхождение опухолевых ответов выявлены у 13 пациентов с метастатической меланомой кожи: у 3 – зарегистрирована СЗ по системе RECIST 1.1 против 10 больных по системе irRC (p=0,230); у 2 пациентов с НМРЛ – СЗ по системе RECIST 1.1 против 5 больных по системе IrRC (р=0,420; табл. 2).
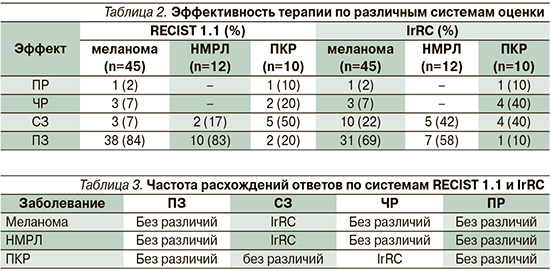
При оценке СЗ и ЧР по двум системам у пациентов с ПКР расхождения опухолевых ответов оказались статистически не значимыми (р=0,540 и р=0,490 соответственно).
Вероятно, полученные результаты связаны с небольшой выборкой пациентов, что свидетельствует о необходимости продолжения исследования на большей группе больных.
Путем использования статистических методов оценки выявлена частота расхождений ответов в группе пациентов с метастатической меланомой кожи, имевших СЗ (9%), также в группе больных НМРЛ, имевших СЗ (15%). Для данной выборки пациентов использование системы IrRC оказалось более достоверным для оценки опухолевого ответа (табл. 3).
В группе пациентов с ПКР при ЧР частота расхождений ответов составила 10%, из этого следует, что для повышения точности определения ответа на иммунотерапию данной когорты больных приоритетнее использование системы IrRC (табл. 3).
Обсуждение
Полученные нами результаты демонстрируют расхождение ответов по двум используемым системам – RECIST 1.1 и IrRC. Возможны две причины несоответствия ответов на лечение по указанным критериям.
Во-первых, в системе RECIST 1.1 использован один размер опухолевого очага, тогда как в системе IrRC их 2.
Другой принципиальной причиной отличий могут быть критерии определения ПЗ. В системе IrRC новый очаг не определяет качественно факта прогрессирования, как это происходит в системе RECIST 1.1. Кроме того, сам факт прогрессирования требует подтверждения при последующей оценке.
В исследовании F.S. Hodi et al. оценивали динамику опухолевых ответов по системам RECIST 1.1 и IrRC от пациентов с меланомой кожи, получавших пембролизумаб. В 12,9% случаев выявлено аналогичное расхождение в оценке терапии (ПЗ по RECIST 1.1 против объективного ответа по IrRC) [12]. Гистологические данные биопсийного материала показали, что увеличение размеров очагов на фоне проводимой терапии обусловлено Т-клеточной инфильтрацией или некрозом, но никак не опухолевой нагрузкой [13]. Поэтому авторы предложили не учитывать новый очаг как неоспоримый признак прогрессирования и обосновали необходимость новой оценки ответа на лечение.
В настоящее время опубликовано небольшое количество работ, затрагивающих проблему оценки эффективности ингибиторов контрольных точек иммунного ответа. К сожалению, до сих пор не существует универсальной системы, отвечающей всем современным требованиям, что подтверждает актуальность обсуждаемой темы.
Заключение
С появлением в арсенале онкологов новых ИОП с принципиально иным механизмом действия возникают и новые проблемы, в первую очередь – по оценке эффективности современной иммунотерапии солидных опухолей.
Понимание специфических механизмов действия ингибиторов контрольных точек иммунного ответа определяет необходимость изменения требований к критериям оценки эффективности лечения. Модификация критериев RECIST 1.1 и разработка IrRC служат эволюционным шагом на пути к дальнейшей оптимизации подхода к оценке эффективности лечения пациентов, получавших иммунотерапию. При рациональной оценке эффективности ИОП сократится число случаев раннего и необоснованного прекращения лечения пациентов современными эффективными препаратами. Полученные нами результаты и актуальность проблемы подтверждают необходимость дальнейших исследований в этом направлении.


