Введение
В последнее время в оперативном акушерстве все чаще при абдоминальном родоразрешении в качестве периоперационной антибиотикопрофилактики (ПАП) используют цефалоспорин III поколения цефтриаксон [1, 2].
Цефтриаксон в отличие от более ранних поколений цефалоспоринов обладает более широким спектром антимикробной активности. Антибиотик in vitro показывает хорошую эффективность в отношении Streptococcus spp., Pneumococcus, Staphylococcus aureus и грамотрицательных бактерий семейства Enterobacteriaceae (Escherichia coli, Proteus spp., Serratia spp., Klebssiella spp., Enterobacter spp., Citrobacter spp.). Цефтриаксон нe действует на метициллинрезистентные стафилококки (MRSA), энтерококки и неферментирующие грамотрицательные бактерии [3, 4], устойчив к действию β-лактамаз грамположительной и грамотрицательной микрофлоры.
Вторым отличием цефтриаксона является значительно более длительный период полувыведения (Т½), что теоретически дает дополнительные преимущества при его использовании. Антибиотик, вводимый с целью профилактики, должен иметь наилучшие показатели фармакокинетики для создания в тканях перед разрезом эффективной бактерицидной концентрации на весь период оперативного вмешательства и в первые 3 часа послеоперационного периода [4].
Период полувыведения цефтриаксона составляет 7–8 часов. Примерно на 85–95% он связывается с белками плазмы [4]. Длительность Т½ антибиотика не имеет решающего значения. Тем не менее этот параметр может влиять на продолжительность поддержания терапевтически активной концентрации препарата в крови и тканях.
Применению цефтриаксона в качестве средства ПАП при абдоминальном родоразрешении посвящены лишь отдельные сообщения [4, 5]. Они свидетельствуют: эффект от предоперационного введения цефтриаксона сопоставим с таковым, оказываемым ингибиторозащищенными аминопенициллинами, и достигает 100%. Споры ведутся только в отношении режима дозирования. Дозы препаратов, используемых для профилактики, должны обеспечивать в крови и околораневых тканях концентрацию, превышающую минимально подавляющую концентрацию (МПК) для наиболее вероятных возбудителей инфекции. Изменения фармакокинетики антибиотиков, наблюдающиеся при беременности, в ряде случаев определяют необходимость коррекции доз и режима их введения по сравнению с небеременными в общехирургической практике [3]. Однако в специальной литературе отсутствует информация о периоперационной фармакокинетике цефтриаксона при абдоминальном родоразрешении.
Для получения наиболее оптимального терапевтического эффекта антибиотика и определения рационального режима его дозирования необходимо оценить не только сывороточные, но и тканевые концентрации в области оперативного вмешательства.
Цель исследования: определение сывороточных концентраций и степени проникновения цефтриаксона в миометрий при ПАП во время кесарева сечения для выбора рационального режима дозирования.
Методы
Обследованы 14 беременных, которым предстояло плановое абдоминальное родоразрешение. Критерии невключения пациенток в исследование: заболевания почек и печени, прием лекарственных препаратов, влияющих на фармакокинетические параметры цефтриаксона, склонность к аллергическим реакциям (наличие гиперчувствительности к изучаемому антибиотику), индекс массы тела <18 и >30 кг/м2. Пациентки были рандомизированы в основную и контрольную группы. Семи пациенткам основной группы перед операцией ПАП проводили цефтриаксоном в дозировке 1,0 г, а семи пациенткам контрольной группы – цефтриаксоном в дозировке 2,0 г. Кесарево сечение выполняли под эпидуральной анестезией. По массо-ростовым показателям, данным анамнеза, паритета, клиренсу креатинина, объему кровопотери и периоперационной инфузии обе группы были сопоставимыми (см. таблицу).

Все беременные дали информированное согласие на участие в исследовании. Схема проведения антибиотикопрофилактики при кесаревом сечении родильницам исследуемых групп была следующей: однократное внутривенное медленное введение цефтриаксона за 30 минут до разреза кожи. В среднем продолжительность абдоминального родоразрешения составляла 35 минут. Забор крови из локтевой вены осуществляли через 15 и 30 минут после предоперационного введения цефтриаксона, затем через 60, 120 и 180 минут после разреза кожи. Полученные образцы центрифугировали (1500 об/мин, 30 минут) и хранили при температуре -20°C до выполнения анализа. Интраоперационно, путем инцизионной биопсии, после извлечения плода забирали ткань миометрия в области разреза на матке.
Фармакокинетические характеристики исследуемого антибиотика изучали с помощью хроматографических и спектрофотометрических методов в НИЛ токсикологии и лекарственного мониторинга НИО биоиндикации ФГБУ «Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова» МЧС России (зав. лабораторией – д-р мед. наук, профессор Г.Г. Родионов). Данные аналитические методики в настоящее время наиболее перспективны для определения концентрации лекарственных средств в биологических жидкостях [6]. Концентрацию цефтриаксона в образцах крови измеряли с помощью метода газовой хроматографии, совмещенной с масс-спектрометрией (Agilent Technologies, США). Чувствительность метода – 0,1 мкг/мл. Цефтриаксон сохранялся в стабильной концентрации не менее 14 дней в замороженной сыворотке крови.
Для сравнительной оценки уровня цефтриаксона в сыворотке крови и миометрии при изучаемых вариантах дозирования в настоящем исследовании использованы MПК наиболее значимых возбудителей послеоперационной инфекции в оперативном акушерстве – энтеробактерий, стафилококков и стрептококков. Они служат причиной развития более половины всех раневых инфекций [7]. Согласно данным, представленным NCCL Standards [8], MПК цефтриаксона для чувствительных («диких штаммов») возбудителей раневой инфекции составляет <8 мкг/мл. Концентрация антибиотика, в 4 раза превышающая МПК для чувствительных («диких штаммов») микроорганизмов, признана наиболее эффективной при проведении ПАП β-лактамными антибиотиками [9, 10], поэтому для дальнейшего анализа в качестве «критического» уровня использован показатель 4×МПК=32 мкг/мл
Результаты
Средние значения концентрации цефтриаксона в сыворотке венозной крови в динамике представлены на рис. 1.
Максимальная концентрация (Сmax) препарата зафиксирована к моменту кожного разреза (через 30 минут после введения антибиотика) и находилась в пределах 118,7±9,1 мкг/мл (основная группа) и 152,4±8,7 мкг/мл (контрольная группа) в сыворотке венозной крови. К концу операции уровень цефтриаксона снижался до 96,5±9,7 мкг/мл (основная группа) и 131,5±9,7 мкг/мл (контрольная группа), что почти в 3,5 раза превышало «критический» уровень. Через 3,5 часа после проведения ПАП уровень цефтриаксона в сыворотке крови оставался достаточно высоким — 66,3±10,7 мкг/мл (основная группа) и 93,5±11,5 мкг/мл (контрольная группа).
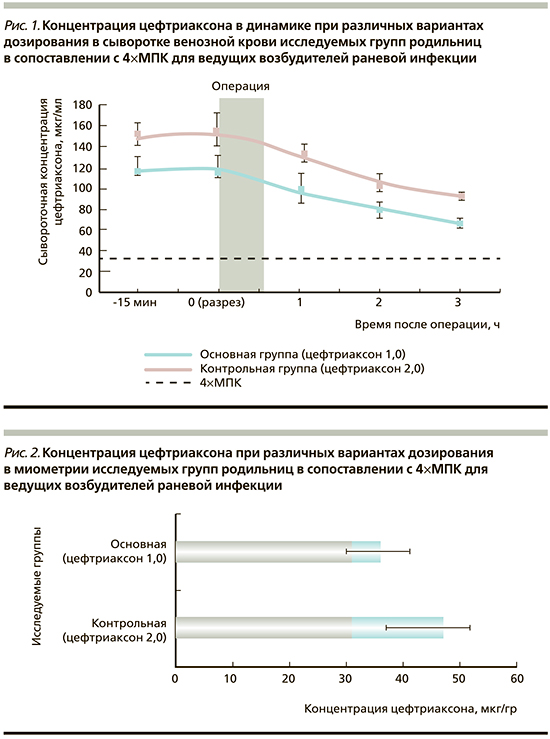
Средние значения концентрации цефтриаксона в миометрии у пациентов исследуемых групп представлены на рис. 2.
Средняя концентрация препарата в миометрии зафиксирована в пределах 36,4±4,7 мкг/г (основная группа) и 47,5±3,2 мкг/г (контрольная группа). Следовательно, концентрация цефтриаксона превысила «критический» уровень 4×MПК у пациентов исследуемых групп, что удовлетворяет принципам эффективной антибактериальной защиты раны.
Обсуждение
Эффективная бактерицидная концентрация цефтриаксона (С >4×MПК) надежно сохранялась во всех группах на протяжении периоперационного периода. Даже при использовании цефтриаксона в дозировке 1,0 через 3 часа после окончания операции и закрытия раны в сыворотке венозной крови концентрация препарата превышала значение 4×MПК, что имеет первостепенное значение при ПАП раневой инфекции, т.к. именно в это время происходит размножение попавших в рану микроорганизмов.
К моменту контаминации тканей (разрез кожи) в основной и контрольной группах в крови достигнута максимальная терапевтическая концентрация цефтриаксона. При этом Сmax в 3,5 раза превышала 4×MПК для предполагаемых возбудителей инфекции в области хирургического вмешательства. Данная высокая концентрация поддерживалась на протяжении всей операции и, что особенно важно, зарегистрирована к моменту наложения швов, когда микробная контаминация достигает максимума.
Исследование показало, что в обеих группах уровень накопления цефтриаксона в миометрии превышает «критический» для наиболее значимых возбудителей. Однако следует отметить, что биопсию миометрия проводили в фиксированное время и не определяли концентрацию в нем препарата в динамике, поэтому истинный уровень пенетрации исследуемого антибиотика в ткани послеродовой матки на данный момент оценить невозможно.
Увеличенная доза цефтриаксона для ПАП перед абдоминальным родоразрешением, как и ожидалось, не производит больший протективный эффект. При данном временном варианте предоперационного введения антибиотика (за 30 минут до разреза кожи) преимуществ в показателях фармакокинетики нет.
Стабильно высокие сывороточные и тканевые концентрации антибиотика на протяжении всего периоперационного периода позволяют говорить об адекватности проведенной профилактики инфекционных осложнений при кесаревом сечении в исследуемых группах. Однако использование меньшей дозировки фармакоэкономически более выгодно.
Заключение
Полученные данные дают основание полагать, что при нормальных значениях индекса массы тела у беременных дозировка цефтриаксона 1,0 г обеспечивает адекватную антимикробную защиту на протяжении всего абдоминального родоразрешения и в первые часы послеоперационного периода. Увеличение дозировки цефтриаксона до 2,0 г не дает фармакокинетических преимуществ.
При обоих режимах дозирования на протяжении минимум 3 часов в крови поддерживалась эффективная бактерицидная концентрация антибиотика (С>4×MПК). Уровень пенетрации в миометрий также превышал «критический» (4×MПК) для наиболее значимых возбудителей. При исследуемых вариантах дозирования цефтриаксона во время кесарева сечения соблюдены все основные условия эффективности ПАП.
Таким образом, у беременных с нормальным индексом массы тела оптимальной дозой цефтриаксона для периоперационной антибиотикопрофилактики при абдоминальном родоразрешении является 1,0 г.



