Актуальность
Акромегалия является хроническим полиорганным заболеванием, негативно влияющим на качество и продолжительность жизни пациента.
В отсутствие контроля смертность при данной патологии в 2–4 раза выше, чем в общей популяции. По данным национальных регистров, распространенность акромегалии и гипофизарного гигантизма составляет от 28 до 137 случаев на 1 млн населения. Как правило, причиной заболевания служат соматотропин-секретирующие опухоли гипофиза, патоморфологическое строение которых определяет секреторную активность, скорость опухолевого роста, особенности клинического течения, чувствительность к предлагаемой терапии и наклонность к рецидивированию [1–3].
Благодаря совершенствованию методов лабораторно-инструментальной диагностики, эндоскопических способов оперативного лечения и успехам фармакотерапии к настоящему времени в целом обозначена и закреплена в международных рекомендациях общая методология лечебного пособия при акромегалии, позволяющая в большинстве случаев достигать либо полной ремиссии заболевания, либо стойкого медикаментозного контроля его активности. Важной предпосылкой достижения такого технологического прорыва стало создание национальных и региональных регистров больных акромегалией, благодаря которым удалось объединить и взять под контроль значительную часть пациентов с целью выяснения эпидемиологических, клинических и психо-социальных особенностей течения заболевания, а также проведения сравнительных мультицентровых клинических исследований, способствующих внедрению в практику наиболее оптимальных схем медицинского пособия и лекарственных препаратов.
Созданный в 2003 г. Московский регистр больных акромегалией и гипофизарным гигантизмом служит примером мультидисциплинарного подхода к решению проблемы ведения редких заболеваний с организацией современной диагностической и лечебной базы, преемственного характера лечения, эффективного лекарственного обеспечения. В настоящее время в Московском регистре числятся 656 пациентов (176 мужчин и 480 женщин) в возрасте от 18 до 90 лет (средний возраст – 59±14 лет). Распространенность данной патологии по обращаемости в Москве составляет 54,2 случая на 1 млн населения (в среднем по России – 31 случай). Средний ежегодный прирост составляет 4,9 случая на 1 млн.
Возрастные особенности акромегалии проявляются более агрессивным течением заболевания и резистентностью к проводимой терапии у пациентов с ранним дебютом заболевания по сравнению с больными старшей возрастной группы, у которых, напротив, наблюдается мягкое течение акромегалии с замедленным ростом гормональноактивной аденомы и минимальными биохимическими нарушениями (микромегалия) [4]. Гендерные различия проявляются значительным доминированием женщин (73 против 27%), число которых превалирует в каждом возрастном диапазоне. У мужчин заболевание характеризуется бόльшим объемом аденомы гипофиза (4,9 против 2,2 см3), относительно ранним возрастом постановки диагноза (45,4 против 49,7 года), более высокими уровнями гормона роста (ГР; 32,6 против 21,3 нг/мл) и инсулиноподобного ростового фактора-1 (ИРФ-1; 696,5 против 630,7 нг/мл; p<0,001).
Среди находящихся на учете пациентов макроаденома гипофиза выявлена у 413 (63%) больных, микроаденома – у 240 (37%), СТГ-эктопированный синдром – у 3 пациентов. В 57 случаях обнаружены полигормональная аденома, секретирующая ГР и пролактин (56 случаев), ГР и ТТГ (1 случай). Синдром МЭН-1 выявлен у 38 пациентов. Среди наиболее часто встречающихся осложнений: узловой (смешанный) зоб (54,5%), артериальная гипертензия (33,5%), симптоматический сахарный диабет (33%), онкологические заболевания (19,2%), полипоз кишечника (10,8%).
Хирургическое лечение предпринято в отношении 410 (62,5%) пациентов: первичное – у 350, вторичное – у 60. Повторное оперативное вмешательство проведено 27 больным. Средний возраст оперированных пациентов составил 44,8±12,8 года. Радикальная аденомэктомия и полная ремиссия заболевания отмечались в 126 (31) случаях. 253 пациентам проведена вторичная медикаментозная и лучевая терапия. В итоге 238 (58%) больными в результате оказанных хирургического и комбинированного пособий достигнут контроль акромегалии.
Медикаментозная терапия (МТ) проведена 484 (74,5%) больным. Первичная МТ – 217 (42 мужчины+175 женщин), вторичная – 267 пациентам (96 мужчин+171 женщина). Использовались аналоги соматостатина первой генерации (ланреотид [252] и октреотид [191]), а также селективный агонист дофамина. Средняя длительность МТ составила 68±48 месяцев. Медикаментозный контроль достигнут 242 больными (49,3%; при первичной МТ – 109, при вторичной – 133). Лучевая терапия проведена 91 пациенту (18 – первичная, 73 – вторичная).
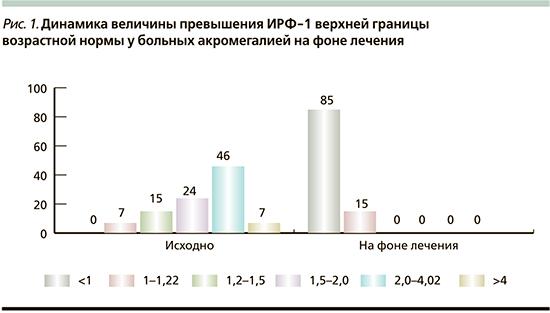
В результате проведенных лечебных мероприятий 69% больных достигли стадии контроля акромегалии. Величина превышения уровня ИРФ-1 выше возрастной нормы (ИРФ-1>ВВН) снизилась с 2,6 (1,2) до 1,1 (0,7) М(s) и достоверно сместилась в сторону более безопасных значений (р=0,001; рис 1).
Обращаясь к теме лекарственного пособия, следует отметить значительный прогресс в фармакотерапии акромегалии, связанный в первую очередь с внедрением в клиническую практику пролонгированных ланреотид- и октреотидсодержащих аналогов соматостатина первой генерации (АС1). Доказано, что продолжительное лечение больных акромегалией препаратом ланреотид (Соматулин Аутожель) обеспечивало стойкое поддержание биохимической ремиссии, уменьшение объема опухоли, снижение выраженности осложнений и повышение качества жизни. В итоге мультицентрового наблюдательного исследования установлено, что на фоне лечения ланреотидом нормализация уровня ИРФ-1 через 12 месяцев лечения достигнута в 71%, через 24 месяца – 74% случаев. Снижение уровня ГР менее 2,5 нг/мл наблюдалось у 83 и 80% пациентов через 12 и 24 месяцев лечения соответственно. Нормализация обоих биохимических показателей зарегистрирована у 51,7 и 42,9% больных соответственно. Авторами отмечена клиническая эффективность и хорошая переносимость АС1, использование которых, согласно международным рекомендациям, получило приоритетное значение [5–7].
Однако, несмотря на достигнутые успехи, в фармакотерапии акромегалии сохраняется проблема адекватного лекарственного пособия, обусловленная наличием множественных патоморфологических вариантов ГР-секретирующих опухолей, отличающихся выраженностью и характером рецепторной экспрессии, влияющих на чувствительность к лекарственным препаратам.
Проведенные клинико-патологоанатомические исследования показали, что каждый тип опухоли имеет характерную патофизиологию, отличающуюся клиническими сценариями опухолевого развития, радиологическими проявлениями и особенностями ведения. Наиболее рельефно это проявляется на примере чувствительности к АС1, преимущественно влияющих на 2-й подтип соматостатиновых рецепторов (ССР), который неодинаково представлен во всех морфологических вариантах соматотропином. Низкая экспрессия или отсутствие данных рецепторов на мембране опухолевых клеток проявляется феноменом частичной или полной резистентности к АС1, встречающимся примерно в 40–50% случаев. Как правило, это наблюдается при наличии слабогранулированных или смешанных аденом, экспрессирующих 5-й подтип ССР, отличающихся ранним дебютом и агрессивным течением [8, 9].
Вследствие малой распространенности специфических предикторов дифференцированной терапии на сегодняшний день в клинической практике превалирует тактика лечения «ex juvantibus» с последующей поправкой на чувствительность, соматический и метаболический статус, что в ряде случаев существенно пролонгирует длительность неэффективного лечебного пособия и задерживает срок наступление биохимической ремиссии [10]. Поэтому не случайно в последние годы стали появляться работы, посвященные поиску клинических, лабораторных и инструментальных предикторов, позволяющих оперативно определять клинико-патологический вариант опухоли и назначать адекватное лечение с учетом рецепторного фенотипа. Среди них: различные варианты острого теста (пробы) с октреотидом, оценка интенсивности МР-сигнала на Т2-взвешенных изображениях, характер экспрессии 2-го и 5-го подтипов ССР при иммуногистохимическом исследовании оперативно удаленного материала [10, 11].
Целью данного исследования стал анализ результатов долговременной первичной и вторичной МТ с выявлением возможных предикторов эффективного лекарственного пособия.
Методы
В работе представлены данные 484 пациентов (139 мужчин, 345 женщин) в среднем возрасте 61±14 лет (возраст диагноза – 49±14 лет), получавших многолетнюю первичную или вторичную МТ аналогами соматостатина первой генерации. Терапевтические возможности включали использование пролонгированного ланреотида (Соматулин Аутожель) в дозе 120 мг подкожно 1 раз в 28–56 дней, а также пролонгированных октреотид-содержащих препаратов (Октреотид-Депо, Октреотид-Лонг) внутримышечно в дозе 10–30 мг 1 раз в 28 дней. Агонист дофамина каберголин использовался в случаях невысокой секреторной активности заболевания, наличия смешанных ГР- и пролактинсекретирующих опухолей, а также при выявлении относительной резистентности к АС1. Доза препарата составляла от 0,5 до 3,5 мг в неделю.
Статистический анализ
Проводился с использованием пакета статиcтических программ «STATISTICA-6.0 (Stat Soft,2001). Нормальность распределения проверялась с помощью критерия Шапиро–Уилка. Меры центральной тенденции и дисперсии количественных признаков представлены в виде среднего арифметического (М) и среднего квадратического отклонений (s). При сравнении двух связанных групп использовался критерий Вилкоксона. Анализ зависимостей проводился с использованием коэффициента ранговой корреляции Спирмена. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты
Первичная МТ (ПМТ) оказана 217 пациентам (42 мужчины, 175 женщин). Основанием назначения ПМТ стали старший паспортный возраст (>60 лет), умеренное повышение уровней ГР и ИРФ-1, отсутствие масс-эффекта, наличие системных нарушений, повышающих риск периоперационной летальности. Средняя длительность лечения составила 68 (49) месяцев.
В результате медикаментозного пособия величина ИРФ-1 >ВВН на фоне лечения снизилась с 2,6 (1,5) до 1,2 (0,7), но оставалась выше физиологических значений, что, по-видимому, обусловлено различием в чувствительности к препарату. Подтверждением служит наличие обратной корреляции умеренной силы между уровнем ИРФ-1 через 3 месяца от начала лечения и финальным уровнем ИРФ-1 на фоне лечения (r=-0,61), что свидетельствует о вкладе рецепторной чувствительности в результативность ПМТ. Для проверки этого предположения выделены 3 целевые подгруппы пациентов в зависимости от процента снижения уровня ИРФ-1 через 3 месяца лечения по сравнению с исходным содержанием (≤30%, 31–69% и ≥70%). В 1-ю подгруппу включены 37 больных (11 мужчин и 26 женщин), во 2-ю – 93 (16 мужчин и 77 женщин), в 3-ю – 38 больных (4 мужчины и 34 женщины). Возрастные, анамнестические, биохимические и результирующие различия представлены в табл. 1.
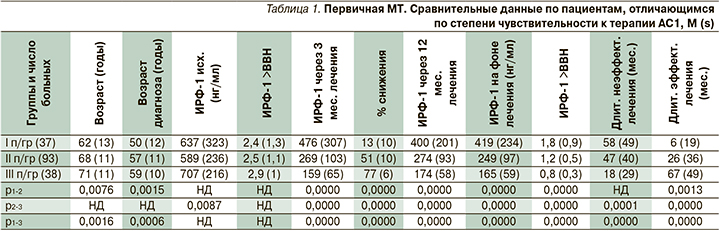
Как следует из табл. 1, за исключением возрастных особенностей, данные подгруппы больных существенно не различались по исходной секреторной и пролиферативной активности соматотропином. Приоритетными статистически значимыми различиями оказались производные от степени чувствительности к АС1. При этом наибольшей резистентностью к лечению с низким терапевтическим исходом отличались пациенты 1-й подгруппы, имевшие наименьший процент снижения уровня ИРФ-1 через 3 месяца от начала использования АС1 (<30%). Напротив, наилучшие результаты от ПМТ со скорым и стойким достижением биохимической ремиссии отмечены в 3-й подгруппе с высоким процентом чувствительности (снижение уровня ИРФ-1 >70% от исходного через 3 месяца лечения; см. рис. 2).
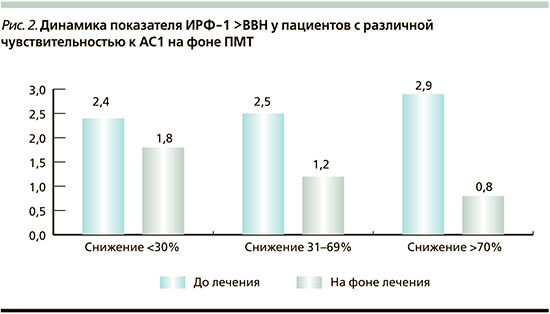
Показательны сравнительные цифры длительности неэффективного (58 [49] против 18 [29] месяцев; р=0,0000) и эффективного (6 [19] против 67 [49] месяцев; р=0,0000) МТ между 1-й и 3-й подгруппами, имевшие не только клиническое, но и фармакоэкономическое значение. Поскольку использовались одни и те же препараты, наблюдаемые различные терапевтические исходы обусловлены в первую очередь различиями в патоморфологическом составе опухолевой ткани с различной выраженностью экспрессии 2-го подтипа ССР. При проведении статистического анализа также отмечается обратная корреляция между процентом снижения уровня ИРФ-1 на 3-м месяце лечения и концентрации ИРФ-1 через 12 месяцев от начала ПМТ (r=-0,57). Таким образом, на этапе лечения можно условно выделить 2 контрольные точки, характеризующие прогноз долговременного использования АС1: уровни ИРФ-1 через 3 и 12 месяцев лечения, которые коррелировали с медикаментозной ремиссией и информировали о перспективности дальнейшего лечения.
Вторичная МТ (ВМТ) проведена 267 пациентам (96 мужчин, 171 женщина) в среднем через 4–5 лет после нерадикального хирургического вмешательства (246) и лучевой терапии (21).
ВМТ (в отличие от ПМТ) назначалась преимущественно пациентам младшей возрастной группы (возраст диагноза – 44 [13] против 56 [11] лет; р=0,0000; паспортный возраст – 56 [12] против 67 [12] лет; p=0,000) с более высокой секреторной и пролиферативной активностью опухолей гипофиза (ГР 29 [47] против 19 [25] нг/мл; p=0,006 , ИРФ-1 651 [307] против 624 [262] нг/мл; p=0,3), объемом опухоли гипофиза (4,6 [6,4] против 1,6 [3,7] см3; p=0,001). Средняя длительность лечения была одинаковой и составила 70 (48) против 70 (47) месяцев. Итоговые усредненные показатели также были сходными: уровень ГР 2,2 (5,0) против 2,8 (3,8) нг/мл (p=0,17); уровень ИРФ-1 257 (164) против 273 (171) нг/мл (p=0,32); величина ИРФ-1>ВВН составила 1,15 (0,7) против 1,26 (0,74; p=0,1).
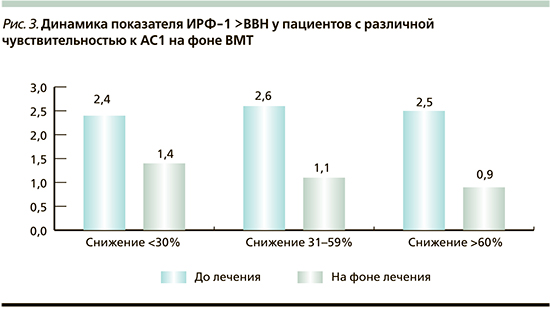
При проведении статистического анализа выявлены корреляционные связи между итоговым уровнем ИРФ-1 на фоне лечения и уровнями ИРФ-1 через 3 и 12 месяцев лечения (r=0,47 и r=0,55), а также между исходным показателем и процентом снижения ИРФ-1 через 3 месяца лечения (r=-0,44; р<0,05). Для уточнения лабораторных предикторов результативности использования АС1 нами были выделены 3 подгруппы больных, различавшихся по величине снижения уровня ИРФ-1 через 3 месяца лечения (≤30%, 31–59% и ≥60%; табл. 2).
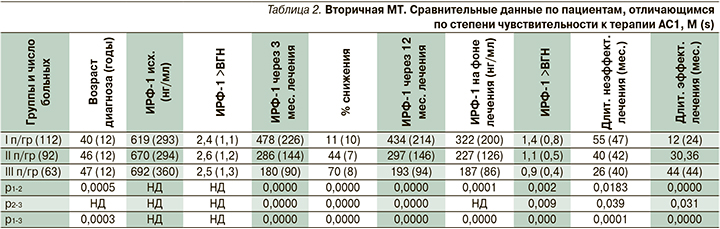
Представленные данные подтверждают наличие различных исходов применения АС1 в зависимости от степени чувствительности к препаратам и указывают на необходимость дифференцированного подхода к фармакотерапии [12]. При сходной длительности лечения наибольшая его эффективность наблюдалась у пациентов 3-й группы (снижение уровня ИРФ-1 через 3 месяца лечения ≥60%). Больных с величиной данного показателя менее 30% многолетнее использование АС1 не привело к биохимической ремиссии (рис. 3).
Если говорить о фармакологической стороне вопроса, то как при ПМТ, так и при ВМТ использовались сходные препараты группы АС1 с преимущественным назначением ланреотида. Как показали клинические наблюдения, оригинальный препарат ланреотид (Соматулин Аутожель) отличался большей эффективностью действия, лучшей переносимостью и степенью свободы пациентов, что выгодно отличало его от октреотид-содержащих генериков. В ряде случаев при непереносимости или резистентности к препарату осуществлялся перевод с пролонгированных форм октреотида на ланреотид (Соматулин® Аутожель®) с достижением клинико-биохимической ремиссии у 71% пациентов и поступательным уменьшением размеров аденомы гипофиза [13–14].
Заключение
Таким образом, представленные данные свидетельствуют: независимо от характера МТ сохраняются сходные проблемы эффективности терапии с применением АС1, обусловленные различиями в рецепторном фенотипе опухолевых клеток. Если при ВМТ при принятии решения можно ориентироваться на данные электронно-микроскопического и иммуногистохимического анализа удаленного материала, то при ПМТ (с целью решения вопроса о лечебной концепции) предлагается использовать результаты диагностического теста с октреотидом и оценку интенсивности сигнала на Т2-взвешенных МР-изображениях. Как следует из полученных данных, при проведении ПМТ и ВМТ чувствительность к АС1, оцениваемая по градиенту снижения уровня ИРФ-1 через 3 и 12 месяцев лечения, служит прогностическим предиктором успешного медицинского пособия. Предполагается, что данные отрезные точки могут использоваться для решения вопроса о сохранении или смене тактики лечения. Дальнейшее совершенствование знаний о биомаркерах, характеризующих генетический статус, внешние и внутренние модифицирующие факторы, морфо-функциональное состояние ГР-секретирующих аденом, открывает перспективы для прогнозирования сценариев опухолевого развития и оказания дифференцированного лечебного пособия при синдроме акромегалии. Разработка данного направления приобретает практическую значимость при внедрении предиктивного и персонализированного подхода к лечению акромегалии [15–17].


