Введение
Сочетание аутоиммунного тиреоидита (АИТ) и сахарного диабета 1 типа (СД1) является самым частым проявлением аутоиммунного полигландулярного синдрома 3-го типа (АПС3). Частота встречаемости АИТ среди детей с СД1 выше, чем в популяции, в 3–5 раз и по данным разных исследований, составляет от 20 до 35% [1–3]. Эти заболевания имеют генетическую общность и связаны через комплексы HLA и MHC [4]. В литературе имеются немногочисленные данные о негативном влиянии АИТ на контроль СД1, включая повышение риска развития гипогликемий, ухудшение липидного профиля пациентов с высокой вероятностью атерогенных осложнений в будущем [1, 5, 6]. Большинство исследований по АПС3 посвящены главным образом изучению эпидемиологии, иммуногенетики и лабораторных аспектов. При обзоре литературы нами найдено только одно исследование, в рамках которого авторы попытались сравнить частоту макро- и микроангиопатии у взрослых пациентов с АПС3, но им не удалось получить достоверных различий из-за немногочисленности выборки [7]. Вместе с тем до настоящего времени в РФ остается дискутабельным вопрос о необходимости скрининга на аутоиммунные заболевания щитовидной железы (ЩЖ) у детей с СД1 [8].
Цель исследования: изучить влияние АИТ независимо от функционального состояния ЩЖ на компенсацию углеводного обмена и развитие микрососудистых осложнений у детей с СД1.
Методы
Дизайн исследования
Проведено одномоментное поперечное исследование. На подготовительном этапе проанализирована архивная документация (журналы госпитализации) 2500 детей, проходивших стационарное лечение в эндокринологическом отделении ГАУЗ СО ОДКБ Екатеринбурга с 1997 по 2017 г. Из 215 историй болезни в соответствии с критериями включения были отобраны и распределены по группам 189 детей: 112 – основная группа и 77 – контрольная (см. рисунок).
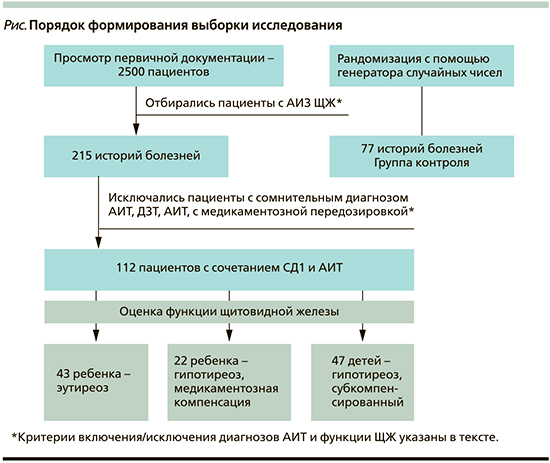
Критерии соответствия
Критерии включения в основную группу: подтвержденный диагноз СД1, подтвержденный диагноз АИТ (критерии диагноза: повышенный уровень антител к тиреопероксидазе [АТ-ТПО: больше 2 верхних пределов референсных значений], выраженное снижение эхогенности ткани и неоднородность структуры при УЗИ ЩЖ). В группу контроля отобраны дети с СД1 с исключенным АИТ, рандомизация была проведена с помощью генератора случайных чисел в Microsoft Excel. 2013. Для оценки влияния функции ЩЖ основная группа была разделена на три подгруппы: 1) 43 ребенка с нормальной функцией ЩЖ (эутиреоз), ТТГ: 0,4–5,0 мМЕ/л; 2) 47 детей с субкомпенсированным гипотиреозом (СКГ) на фоне терапии левотироксином натрия, ТТГ: 5,0–10,0 мМЕ/л; 3) 22 ребенка с медикаментозно компенсированным гипотиреозом (МКГ) на фоне терапии левотироксином натрия, ТТГ: 0,4–5,0 мМЕ/л.
Условия проведения
Исследование проводилось на базе ГАУЗ СО «Областная детская клиническая больница» с ноября 2018 по сентябрь 2019 г. Для анализа использовалась медицинская документация (истории болезни) детей с СД1, находившихся на плановой госпитализации в отделении эндокринологии с целью коррекции дозы инсулина и скрининга хронических осложнений.
Продолжительность исследования
Ноябрь 2018 г. – разработка дизайна исследования, обзор научных публикаций по теме исследования. Декабрь 2018 г. – создание базы данных, работа с реестром пациентов, отработка критериев включения и исключения. Январь–июль 2019 г. – анализ историй болезни детей, заполнение базы. Июль–ноябрь 2019 г. – статистический анализ исследования, интерпретация полученных данных. Ноябрь–декабрь 2019 г. – поиск литературы по возникшим в ходе анализа вопросам, написание статьи.
Описание медицинского вмешательства
Из историй болезни фиксировались данные о манифестации СД1, стаже заболевания, имеющихся осложнениях (диабетические ретинопатия – ДР, нефропатия – ДН, полинейропатия – ДПН и хайропатия), уровень гликированного гемоглобина (HbA1c), антропометрические данные, суточная доза вводимого инсулина (пересчет дозы в ЕД/кг), метод введения инсулина. Также фиксировались показатели функции ЩЖ (уровень ТТГ, наличие АТ ТПО и показатели УЗИ: размеры, эхогенность паренхимы, структура).
Основной исход исследования
Влияние АИТ на компенсацию углеводного обмена у исследуемых детей с СД1. Для оценки этого эффекта использован уровень HbA1c.
Дополнительные исходы исследования
Наличие и частота хронических осложнений СД1 у детей с АПС3 (ДН, ДПН, ДР, хайропатия) в группах, подгруппах.
Анализ в подгруппах
Первично было проведено сравнение между основной группой (СД1+ АИТ) и группой сравнения (только с СД1). Внутри основной группы также происходило деление на подгруппы по полу. Для выявления влияния функции ЩЖ основная группа была поделена на три подгруппы с последующим статистическим анализом.
Статистический анализ
Размер выборки предварительно не рассчитывался. Статистическая обработка данных проводилась с помощью ПО Statistica. 10. Для описания данных использовалась медиана, мерой размаха были выбрана 25-й и 75-й процентили. Для оценки достоверности различий между группами использовались F-критерий Фишера (для таблиц сопряжения 2×2); χ2-критерий Пирсона c поправкой Йетса (для номинальных признаков); U-критерий Манна–Уитни (сравнение основной группы и группы контроля); H-критерий Краскела–Уоллиса (группа контроля и подгруппы по функции ЩЖ) – для количественных. Корреляция между признаками определялась с помощью рангового коэффициента Спирмэна. Достоверными различия считались при критическом значении p<0,05
Результаты
Объекты (участники) исследования
Из архива были отобраны истории 215 детей, проходивших лечение в эндокринологическом отделении ОДКБ № 1 Екатеринбурга на основании критериев включения. При проведении подробного просмотра историй на втором этапе были исключены дети с неаутоиммуным заболеваниием ЩЖ, с сомнительным диагнозом АИТ. Далее было принято решение исключить из исследования 1 случай диффузного токсического зоба и 4 случая АИТ с медикаментозной передозировкой левотироксина (ТТГ<0,1). Всего в основной группе было 112 детей, 77 детей входили в группу сравнения. Половой состав групп: основная группа – 35 мальчиков и 77 девочек, группа сравнения – 31 мальчик и 46 девочек (χ2=0,42, p>0,05).
Для исключения влияния иных факторов группы были сопоставимы по стажу СД1: в основной группе Me=3,65[0;7,03] года, в группе сравнения Me=5,1 [1,75;6,9] года (U=3843, p>0,05). Смещенной получилась подгруппа детей с МКГ, где медиана стажа СД1 составила 6,3 [2,8;12,0] года, в подгруппе детей с эутиреозом Me=4,4 [0,5;6,7] года, в подгруппе СКГ Me=3,0 [0:7,0] года (H=5,98, p=0,047). В основной группе среди детей с сочетанием АИТ и СД1 в 38,4% отмечен эутиреоз, в 42% – СКГ и в 19,6% – МКГ. Показатели в подгруппах по полу и стадии полового развития имеют равное распределение.
Основные результаты исследования
Уровень HbA1c был достоверно выше в основной группе (табл. 1), что свидетельствует о неблагоприятном течении СД1 в группе детей с АИТ. Потребность в инсулине (ЕД/кг/сут) также была выше в основной группе.
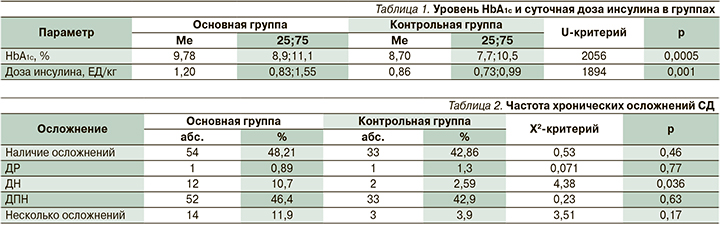
В табл. 2 представлен сравнительный анализ частоты хронических осложнений СД1 между основной группой и группой контроля. Частота осложнений СД в группах не различалась, однако в основной группе достоверно чаще диагностировалась ДН, а также наличие сразу нескольких осложнений.
Дополнительные результаты исследования
Для уточнения влияния непосредственно АИТ на уровень компенсации СД и частоту развития осложнений был проведен анализ в подгруппах в зависимости от функционального состояния ЩЖ при АИТ. Уровень HbA1c и суточная доза инсулина в зависимости от функции ЩЖ представлены в табл. 3. Установлено, что наиболее значимые различия по уровню HbA1c наблюдались между детьми с МКГ и группой контроля (p=0,005). Разница при парном сравнении между группой контроля и подгруппой детей с эутиреозом и СКГ не была достоверной, но отмечена тенденция к более высоким значениям HbA1c (p=0,07). Наибольшая потребность в инсулине отмечалась у детей с компенсацией гипотиреоза, соизмеримые значения имели место в подгруппе детей с эутиреозом и СКГ.
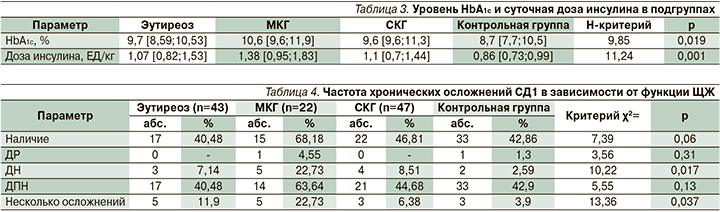
Анализ частоты хронических осложнений СД1 в зависимости от функционального состояния ЩЖ (табл. 4) продемонстрировал превалирующее количество осложнений в подгруппе МКГ – у 2/3 детей подгруппы (n=15). В подгруппах детей с эутиреозом и СКГ частота осложнений СД1 не различалась – 39,5 и 46,8% соответственно (p=0,14). Одновременно несколько осложнений чаще наблюдались в группе детей с компенсированным гипотиреозом (n=5), высокая по сравнению с контролем частота характерна и для группы с эутиреозом – 11,9% (n=5), СКГ – 6,4% (n=3; p=0,037). ДПН с одинаковой высокой частотой встречалась в основной и контрольной группах – 46,4 и 42,9% соответственно. Установлено, что ДПН превалировала у детей с компенсированным гипотиреозом – 63,6% (n=14). Акцентируем внимание на частоте ДН: достоверные различия между основной и контрольной группами с наибольшей частотой у детей с МКГ – 22,7%. Хайропатия выявлялась редко среди обеих групп, однако в 6 раз чаще в группе детей с АИТ (p=0,14).
Также были установлены достоверные различия по наличию осложнений СД при разделении основной группы по полу: у девочек осложнения встречались чаще, чем у мальчиков (59,3% [n=45] и 25,7% [n=9] внутри групп соответственно; p=0,003; χ2=11,7). Кроме того, тенденция к наличию нескольких осложнений имела место у девочек – 16,28% (n=12) по сравнению с 2,78% (n=1) у мальчиков (p=0,04; χ2=12,5). ДПН в большем числе случаев наблюдалась у девочек – 43 (56,6%), чем у мальчиков, – 9 (25%; p=0,007; χ2=10,5). Хайропатия в данном исследовании встречалась только у девочек – 6 (7,8%) человек. ДН развилась у девочек в большем количестве случаев, чем у мальчиков (14,5 против 2,78%; p=0,06; χ2=4,5). Уровень HbA1c находился в сходных диапазонах у девочек и мальчиков: Me=9,76 [8,9;11,08] и Me=9,78 [8,25;11,4] (p=0,6; U=761,5).
В ходе исследования проводился анализ влияния различных факторов (стаж СД, возраст дебюта, уровень HbA1c) на частоту развития осложнений. Установлено, что развитие осложнений ассоциировано с более ранним дебютом СД1 в основной группе. Так, среди детей с осложнениями СД в основной группе медиана дебюта СД1 составила 6,8 года [2,8;10,5], у детей без осложнений – 11,1 [5,3;13,2] года (p<0,006; U=940). Косвенно это подтверждает наличие слабой отрицательной связи между возрастом дебюта СД1 и количеством осложнений (rs=-0,3; p<0,05). Подобной зависимости не отмечено среди детей с хайропатией (p>0,05).
Для всех видов осложнений СД1 выявлена достоверная связь со стажем СД1: так, медиана в группе детей с осложнениями составила 6,5 [4,3;9,2] лет, среди детей без осложнений – 1,3 [0;3,9] года (p=0,001; U=482). Выявлена умеренная прямая корреляционная связь между стажем СД1 и количеством осложнений (rs=0,5; p<0,05). Диабетическая хайропатия была ассоциирована с более высокими значениями HbA1c% по сравнению с основной группой: Me=11,94% [9,9;15,2] (p<0,001; U=543). В контрольной группе осложнения связаны с продолжительным стажем СД1 (Me=6,1 [5,1;8,2] года), но не отмечено достоверной связи с возрастом дебюта СД1. Также не отмечалось различий в распределении осложнений среди мальчиков и девочек группы сравнения (41,3% мальчиков и 45,2% девочек; p>0,05).
Дизайн исследования не предполагал учета нежелательных явлений.
Обсуждение
Таким образом, АИТ в составе АПС3 в сочетании с СД1 негативно сказывается на гликемическом контроле детей, что проявляется и более высокой частотой поздних осложнений СД. Факторами, которые дополнительно способствуют негативному влиянию АИТ на течение АПС3 можно признать стаж СД1 и женский пол.
В ходе исследования не получено достоверных данных о значимом влиянии функционального состояния ЩЖ при АИТ на течение АПС3.
Считается, что только развитие нарушения функции ЩЖ в исходе АИТ может влиять на компенсацию углеводного обмена у больных СД1. Нами предпринята попытка изучить потенциальную роль сочетания двух аутоиммунных заболеваний в составе АПС3 на клиническое течение СД1 у детей, причем независимо от функционального состояния ЩЖ на фоне течения АИТ. В результате исследования установлено, что показатели компенсации углеводного обмена у детей с СД1 и АИТ во всех подгруппах были хуже, чем в группе контроля, а ряд хронических осложнений встречался чаще, чем у пациентов без АИТ. Декомпенсация СД1 и частота диабетической микроангиопатии превалировали в группе детей с медикаментозной компенсацией гипотиреоза. При анализе данной подгруппы установлено, что дети имели самый продолжительный стаж СД1 и самый ранний возраст манифестации, что в свою очередь является известным фактором риска по формированию хронических осложнений СД1. Вместе с тем анализ в подгруппах (в частности, при сравнении группы контроля с подгруппами детей с эутиреозом и СКГ) при сопоставимых показателях длительности СД1 продемонстрировал, что частота поздних осложнений у детей с АИТ независимо от функции ЩЖ все-таки выше.
В связи с этим можно предположить, что ведущий вклад в развитие осложнений СД при АПС3 вносят различные патоиммунные реакции и иммуногенетические особенности, но не гормональные эффекты тиреоидных гормонов.
Также установлено, что ранний дебют АПС3 негативно влияет на компенсацию углеводного обмена, инициируя развитие хронических осложнений СД. Мы подтвердили данные о том, что женский пол ассоциирован с более частым проявлением АПС3. Кроме того, выявлена повышенная частота поздних осложнений СД1 среди девочек основной группы. При этом влияния пола на частоту осложнений в группе сравнения не наблюдалось. В связи с этим женский пол при наличии АПС3 можно выделить как один из факторов неблагоприятного течения СД1. Одной из гипотез, объясняющих более высокую частоту аутоиммунных заболеваний у лиц женского пола, является предположительное влияние эстрогенов на стимуляцию иммунитета при снижении иммуносупрессивного влияния андрогенов на фоне пубертата [9].
Важную роль в развитии микрососудистых осложнений может играть оксидативный стресс, возникающий на фоне дисбаланса в системе «окислители/антиоксиданты». Так, у пациентов с эутиреоидным зобом Хашимото наблюдалось смещение этого баланса в сторону окисления, что проявлялось повышенным содержанием реактивных метаболитов кислорода и снижением антиоксидантного потенциала. Конечные продукты гликирования также были повышены у пациентов с АИТ [10]. Эти продукты служат важным звеном патогенеза макро- и микроваскулярных осложнений СД обоих типов [11]. Причем при сочетании СД1 и АИТ формируется порочный круг, при котором плохой контроль СД1 в результате АИТ будет приводить к еще большему увеличению содержания продуктов гликирования и окисления, также способствуя накоплению провоспалительных цитокинов [12, 13]. Нам не удалось найти исследований, в которых бы определялись оксидативный баланс и уровень конечных продуктов гликирования при сочетании СД1 и АИТ. Вместе с тем проведение подобных исследований, на наш взгляд, достаточно перспективно и позволило бы понять патогенез выявленных нами клинических результатов по ухудшению метаболического контроля и развитию поздних осложнений СД1.
Ограничения исследования
Кроме известных ограничений в дизайне поперечного исследования необходимо отметить, что дети в основную группу набирались методом сплошной выборки, в группу контроля – с помощью рандомизации из большого массива данных. Ограничением данного исследования следует признать то, что смещающей стала подгруппа детей с медикаментозной компенсацией гипотиреоза, в частности, по стажу СД1. Данное ограничение устранялось при разделении основной группы на подгруппы по функции ЩЖ. При сравнении показателей контрольной группы с остальными подгруппами по функции ЩЖ, мы получили достаточно оснований для подтверждения полученных результатов.
Заключение
Дети с сочетанием СД1 и АИТ независимо от функционального состояния ЩЖ являются группой высокого рискапо декомпенсации углеводного обмена и развитию хронических осложнений СД1. Внедрение селективного скрининга АИТ (ТТГ, АТ-ТПО и УЗИ ЩЖ) у детей с СД1 необходимо уже на этапе манифестации СД. Дальнейшее динамическое наблюдение детей с АПС3 независимо от исходного функционального состояния ЩЖ должно проводиться с учетом установленных рисков более тщательно, с ежегодным мониторингом ТТГ и скринингом хронических осложнений.
Участие авторов
Абдуллаев А.Н. – разработка дизайна исследования, базы данных, сбор и обработка первичных данных, проведение статистического анализа, написание статьи.
Литвинова Д.В. – разработка дизайна исследования, сбор и обработка первичных данных, написание статьи.
Рожков Н.И. – разработка дизайна исследования, сбор и обработка первичных данных, написание статьи.
Кияев А.В. – концепция, разработка дизайна исследования, базы данных, сбор и обработка первичных данных, написание статьи.



