Введение
Частота встречаемости диффузного токсического зоба (ДТЗ) во время беременности, по данным разных авторов, варьируется от 0,05 до 3% [1, 2]. Достижение эутиреоидного состояния служит необходимым условием благоприятного исхода беременности у женщин с ДТЗ [1, 3]. Известно, что тиреотоксикоз не является показанием к прерыванию беременности, поскольку существующие методы его консервативного лечения считаются безопасными как для матери, так и для плода. Отсутствие единой точки зрения на выбор оптимальной тактики ведения беременных пациенток с ДТЗ определяют актуальность данного исследования [4, 5].
К специфическим маркерам ДТЗ относятся синтезируемые лимфоцитами антитела к рецепторам тиреотропного гормона (АТ-рТТГ), которые выявляются практически у 100% больных [6, 7]. АТ-рТТГ имитируют функцию ТТГ, связываются с рецепторами ТТГ с последующей стимуляцией тиреоцитов и таким образом усиливают функцию щитовидной железы (ЩЖ), блокируют биологические эффекты ТТГ, повышают риск рецидива тиреотоксикоза, а также, свободно преодолевая плацентарный барьер, стимулируют ЩЖ плода с развитием в 2–3% случаев тиреотоксикоза [8, 9].
В связи с этим весьма актуален, но мало изучен вопрос о степени значимости уровня АТ-рТТГ в сыворотке крови в оценке характера течения ДТЗ.
Таким образом, изучение этих вопросов открывает новые перспективы в разработке алгоритмов мониторинга беременных с ДТЗ с целью достижения и сохранения компенсации тиреотоксикоза, получения благоприятных перинатальных исходов.
Цель исследования: изучение рисков рецидивов тиреотоксикоза и определение частоты акушерских осложнений у беременных женщин с ДТЗ.
Методы
В исследование были включены 120 беременных женщин. Основную группу составила 71 беременная в возрасте от 19 до 37 лет (средней возраст – 27,4±0,5 года) с ДТЗ, две из них были беременны двойней. Продолжительность заболевания варьировалась от нескольких недель до 7 лет.
У 54 женщин ДТЗ был выявлен до беременности. Двадцать четыре женщины в момент наступления беременности получали лечение тиреостатиками. У 30 пациенток имелась ремиссия ДТЗ на этапе планирования беременности после отмены антитиреоидной терапии (от 1 года до 3 лет), но в период с 6-й по 25-ю неделю беременности отмечен рецидив тиреотоксикоза.
У 17 женщин дебют ДТЗ произошел во время беременности.
В контрольную группу были включены 49 беременных в возрасте от 17 до 40 лет (средний возраст – 26,7±0,7 года) без заболеваний ЩЖ и тяжелой соматической патологии. Все женщины контрольной группы получали препараты йодида калия в дозе 0,2 мг в сутки. У всех женщин этой группы беременность закончилась физиологическими родами.
Всем пациенткам с ДТЗ во время беременности проводилась тиреостатическая терапия (ТСТ): 40 женщин основной группы принимали производные имидазола (мерказолил, тирозол), 31 получала производные пропилтиоурацила (пропилтиоурацил, пропицил). Стартовая лечебная доза производных имидазола, принятая как терапевтическая, составила 20 мг/сут. В качестве лечебной (терапевтической) дозы производных пропилтиоурацила использовали 100–200 мг/сут. После устранения основных симптомов тиреотоксикоза антитиреоидная терапия либо полностью отменялась, либо был рекомендован прием тиреостатиков в поддерживающих дозах: производные имидазола – 5, производные пропилтиоурацила ПТУ – 50 мг/сут.
В зависимости от применяемых режимов ТСТ и характера течения ДТЗ беременные женщины основной группы были разделены на три подгруппы (рис. 1).
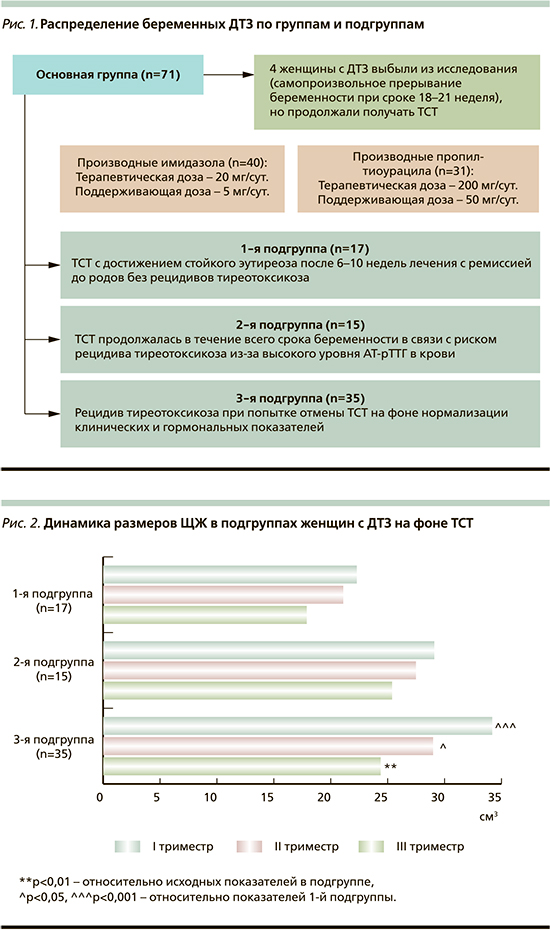
Всем женщинам, включенным в сравнительное открытое проспективное исследование, проведены сбор жалоб и анамнестических данных, а также физикальное, гинекологическое и общеклиническое обследования, исследование функционального состояния ЩЖ. Постановку диагноза ДТЗ и контроль лечения осуществлены на базе ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта». Размеры ЩЖ оценивали методом пальпации по международной классификации ВОЗ [10]. Ультразвуковое исследование ЩЖ всем беременным женщинам выполняли на аппарате Voluson 730, Expert GE. Измерение долей ЩЖ проводили при продольном и поперечном сканировании, объем ЩЖ рассчитывали по формуле J. Brunn [11].
Содержание в сыворотке крови беременных женщин свободного тироксина (свТ4), ТТГ и АТ-рТТГ определяли методом иммуноферментного анализа с использованием стандартных наборов фирмы «Алкор-Био» (Россия) и «DRG diagnostics» (Германия). Референсные интервалы формировались на основании данных контрольной группы.
Статистический анализ полученных результатов проведен с применением стандартных пакетов прикладных программ STATISTICA for WINDOWS (версия 7). Проверку гипотезы о равенстве двух средних проводили с помощью t-критерия Стьюдента. Для углубленной оценки риска события, определения диагностической ценности уровня АТ-рТТГ в крови, а также для исследования характера взаимосвязи между показателями различных групп использованы ROC-анализ, однофакторный дисперсионный анализ (ANOVA) с определением точного критерия Фишера (ТКФ) и корреляционный анализ. Данные в тексте, в таблицах и на графиках представлены в виде М±SD (где М – средняя арифметическая, SD – среднеквадратичное отклонение). Выводы базировались только на статистически значимых различиях.
Достигнутый уровень значимости (p) рассчитывался на всех этапах статистического анализа. Критерием статистической достоверности полученных результатов считали величину p<0,05 [12].
Результаты исследования
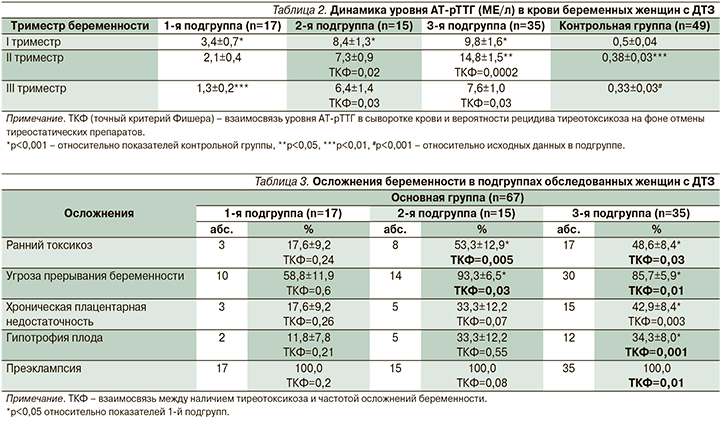
По данным эхографии, объем ЩЖ беременных женщин с ДТЗ в среднем составлял 32,9±2,9 см3, у пациенток контрольной группы – 12,4±0,3 см3 (p<0,001).
На фоне ТСТ наблюдалось уменьшение объема ЩЖ, однако полная нормализация показателей до физиологической нормы отмечена только у женщин 1-й подгруппы (рис. 2).
На фоне ТСТ во всех трех подгруппах пациенток основной группы отмечено достоверное снижение уровня свТ4 до физиологических значений. Полная нормализация содержания свТ4 у беременных 2-й и 3-й подгрупп произошла только в III триместре, тогда как в 1-й подгруппе эутиреоз был достигнут уже ко II триместру беременности. Следует отметить, что в отличие от уровня свТ4 показатели ТТГ в сыворотке крови у всех женщин с ДТЗ не претерпевали заметных изменений и оставались низкими на протяжении всей беременности (табл. 1).

Оценка показателей АТ-рТТГ в сыворотке крови беременных с ДТЗ из разных подгрупп позволила уточнить роль данного показателя в оценке степени активности тиреотоксикоза.
У всех беременных с ДТЗ как на момент начала наблюдения, так и к моменту родов определялся повышенный уровень АТ-рТТГ, который превышал соответствующий результат контрольной группы. Значимое снижение уровня АТ-рТТГ относительно исходных показателей отмечено только в 1-й подгруппе. Клинически и гормонально подтвержденная ремиссия тиреотоксикоза у этих беременных позволила полностью отменить ТСТ уже в начале II триместра. У пациенток 2-й и 3-й подгрупп положительная динамика данного показателя отсутствовала, в связи с чем прием тиреостатиков был продолжен до родоразрешения. Выявлена прямая положительная связь, отражающая высокий риск рецидива тиреотоксикоза на фоне отмены ТСТ в условиях повышенных значений АТ-рТТГ в сыворотке крови беременных во II и III триместрах беременности (табл. 2).
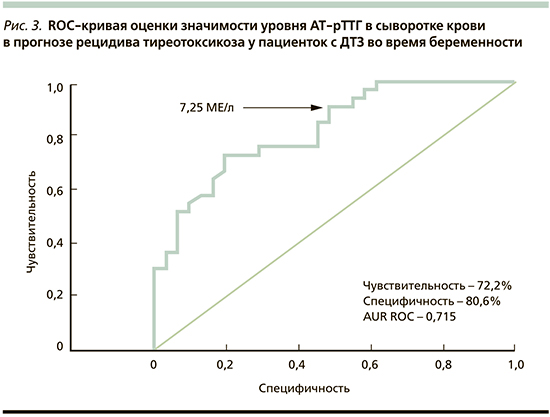
По данным ROC-анализа, определение уровня АТ-рТТГ в крови для оценки характера течения тиреотоксикоза у обследованных женщин с ДТЗ имело чувствительность 72,2% и специфичность 80,6%. Пороговое значение уровня АТ-рТТГ в сыворотке крови для решения вопроса об отмене или сохранении ТСТ составило 7,25 МЕ/л (рис. 3).
Таким образом, основанием снижения дозы тиреостатиков или полной их отмены при достижении эутиреоза возможно считать уровень АТ-рТТГ в сыворотке крови ниже 7,25 МЕ/л, тогда как более высокие показатели будут требовать продолжения ТСТ из-за высокого риска рецидива тиреотоксикоза.
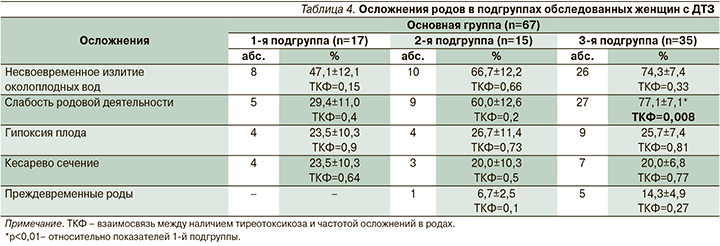
Такие осложнения беременности, как ранний токсикоз, угроза прерывания беременности, преэклампсия, хроническая плацентарная недостаточность, гипотрофия плода, а также слабость родовой деятельности, среди беременных с ДТЗ встречались чаще, чем в контрольной группе. Наиболее благоприятное течение беременности отмечено у пациенток с ранней стойкой ремиссией тиреотоксикоза. Выявлена положительная связь между тяжестью тиреотоксикоза, ассоциированного с повышенным уровнем сывороточных АТ-рТТГ, и частотой акушерских осложнений (табл. 3, 4). Это подтверждает прямое негативное влияние неустраненного тиреотоксикоза на течение беременности у женщин с ДТЗ, ранее описанное другими исследователями [13–15].
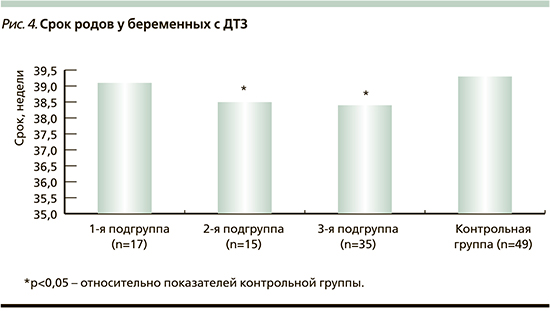
Средний срок родоразрешения у всех беременных с ДТЗ (38,6±0,2 недели) был меньше, чем в контрольной группе (39,2±0,1 недели; p<0,01). Сроки родоразрешения в подгруппах пациенток с ДТЗ представлены на рис. 4.
В общей сложности у обследованных женщин родились 117 детей. От 67 матерей с ДТЗ родились 68 детей, из них – 62 доношенных, среди них одна двойня, и 6 недоношенных, родившихся на сроке 34–36 недель беременности. От 49 матерей контрольной группы родились 49 доношенных детей.
Обсуждение результатов
Современные исследователи придают большое значение тиреостимулирующим аутоантителам, способствующим гиперпродукции тиреоидных гормонов, и считают данный показатель ценным предиктором рецидива тиреотоксикоза при ДТЗ [16]. В ходе нашего исследования был проведен анализ динамики уровня АТ-рТТГ в сыворотке крови пациенток с ДТЗ во время беременности. Благоприятное течение тиреотоксикоза с быстрым его устранением, низким риском рецидива и уменьшением размеров ЩЖ отмечено только у пациенток 1-й подгруппы с низкими показателями АТ-рТТГ. Это подтверждают результаты исследований других авторов о наличии высокого риска рецидива тиреотоксикоза после отмены тиреостатиков в случае повышенного уровня сывороточных АТ-рТТГ, что особенно важно для II и III триместров беременности [16].
Установлено пороговое значение уровня АТ-рТТГ у беременных с ДТЗ для определения тактики лечения. Основанием снижения доз тиреостатиков до поддерживающих или полной их отмены при достижении эутиреоза служит уровень АТ-рТТГ ниже 7,25 МЕ/л. При наличии показателей выше этого уровня требуется продолжение ТСТ из-за высокого риска рецидива тиреотоксикоза. Полученные результаты дают возможность прогнозировать рецидив тиреотоксикоза после курса тиреостатиков и индивидуально определять схему ТСТ у беременных с ДТЗ.
В различных литературных источниках имеются данные о негативном влиянии тиреотоксикоза на течение беременности и родов у женщин с ДТЗ [2, 17]. В ряде работ показано, что высокая частота осложнений беременности может быть ассоциирована с непосредственным влиянием повышенного титра АТ-рТТГ в сыворотке крови женщин [18]. Аналогичные данные были продемонстрированы и в нашем исследовании пациенток 2-й и 3-й подгрупп, у которых на протяжении всей беременности сохранялись высокие значения АТ-рТТГ в крови.
Наиболее часто такие осложнения беременности, как ранний токсикоз, угроза прерывания беременности, преэклампсия, хроническая плацентарная недостаточность и гипотрофия плода, встречались у женщин 2-й и 3-й подгрупп, у которых сохранялся высокий уровень АТ-рТТГ в течение беременности. Наиболее благоприятное течение беременности наблюдалось у женщин 1-й подгруппы, имевших длительную стойкую ремиссию тиреотоксикоза после отмены антитиреоидной терапии. Выявлена прямая положительная связь неустраненного тиреотоксикоза и высокой частоты осложнений беременности у пациенток с ДТЗ. Полученные в исследовании данные о высокой частоте преждевременных родов, несвоевременного излития околоплодных вод, слабости родовой деятельности и гипоксии плода, а также об оперативном родоразрешении у женщин с ДТЗ не противоречат известным результатам [19].
В связи с этим можно сделать вывод: благоприятное течение беременности и родов у пациенток с ДТЗ зависит от степени компенсации основного заболевания и может быть прогнозируемо в случаях стойкой ремиссии тиреотоксикоза, достигнутой ко II триместру беременности на фоне отмены ТСТ. Это относится и к пациенткам, имеющим минимальный риск рецидива тиреотоксикоза, ассоциированного с низкими значениями АТ-рТТГ в сыворотке крови.
В заключение следует подчеркнуть, что наиболее благоприятное течение ДТЗ имел в той подгруппе пациенток, где были более низкие значения АТ-рТТГ. В той же подгруппе отмечены наиболее удачные перинатальные исходы. АТ-рТТГ, сохраняющиеся в высоком титре в сыворотке крови беременных с ДТЗ, оказывают негативное влияние на тироциты, приводя к постоянной стимуляции выработки тиреоидных гормонов. Это способствует сохранению длительного состояния тиреотоксикоза, что не позволяет отменять антитиреоидную терапию на ранних сроках беременности. Таким образом, в группе беременных с повышенным титром АТ-рТТГ при отмене ТСТ имеется высокий риск рецидива тиреотоксикоза, способствующего ухудшению течения беременности и родов, а также состояния новорожденного, что требует продолжительного приема тиреостатиков.
Выводы
- У женщин с ДТЗ с уровнем АТ-рТТГ в сыворотке крови ниже 7,25 МЕ/л отмечено быстрое устранение тиреотоксикоза, отсутствие рецидивов, что стало основанием полной отмены ТСТ в I триместре беременности.
- Отмена тиреостатиков во II и III триместрах беременности приводит к рецидиву тиреотоксикоза у беременных женщин с ДТЗ с уровнем АТ-рТТГ выше 7,25 МЕ/л, что свидетельствует о необходимости продолжения антитиреоидной терапии до родоразрешения.
- У женщин с ДТЗ с высоким уровнем АТ-рТТГ, получавших антитиреоидную терапию в течение всей беременности, выявлена высокая частота осложнений первой половины беременности, у женщин с повышенным показателем антител и рецидивами тиреотоксикоза после отмены лечения отмечена высокая частота осложнений как первой, так и второй половины беременности, слабости родовой деятельности по сравнению с соответствующими показателями у женщин контрольной группы.


