Актуальность
Сердечная недостаточность (СН) является одной из основных причин заболеваемости и смертности в мире [1, 2]. Распространенность СН составляет в среднем около 1–2% среди взрослого населения развитых стран мира, с возрастом увеличиваясь и превышая 10% у лиц старше 70 лет [1, 2].
В Российской Федерации СН диагностируется в среднем в 7–10% случаев [1]. Распространеность СН на территории России в последние 16 лет неуклонно увеличивалась ‒ с 4,9% в 1998 г. до 8,5% в 2014-м [1]. При этом абсолютное число пациентов, имеющих хроническую СН (ХСН), возросло более чем в 2 раза (с 7,18 до 12,35 млн человек), а число лиц с тяжелой СН (III–IV функциональных классов [ФК] по NYHA [New York Heart Association]) ‒ почти в 3 раза (с 1,76 до 4,5 млн человек) [1].
Тенденция к росту заболеваемости СН с увеличением возраста в России соответствует общемировой: за 18 лет средний возраст больных ХСН в РФ увеличился с 64±11,9 (1998) до 72,8±11,9 года (2016) [1].
СН – одна из наиболее распространенных причин госпитализации. Так, в связи с декомпенсацией СН в США ежегодно осуществляется около 5 млн госпитализаций, в Канаде – 106 тыс. [3, 4]. В России ХСН как основная причина госпитализации пациентов с сердечно-сосудистыми заболеваниями (ССЗ) регистрируется у 16,8% больных, при этом декомпенсация ХСН служит причиной госпитализации каждого второго из них (49%) [1].
В целом же диагноз ХСН фигурирует у 92% пациентов с ССЗ, госпитализированных в отделения кардиологического профиля [1].
СН оказывает значительное влияние на продолжительность пребывания пациентов в стационаре, составляющую в среднем 13 дней, а также на прогноз после выписки [3, 5]. Так, в течение первых 30 дней после выписки из стационара повторная госпитализация требуется 31% больных, в течение 90 дней ‒ еще 11%, а к 180-му дню ‒ еще 11% пациентов [1]. СН оказывает влияние и на госпитальную смертность: так, в условиях постоянного стационарного специализированного наблюдения и лечения частота летальных исходов среди больных с СН достигает 15% [3, 5]. С учетом изложенного высокий 6%-ный уровень общей смертности пациентов с ХСН, в 10 раз превышающий уровень в популяции (отношение шансов [OШ]=10,1; р<0,0001), представляется вполне объяснимым [1].
В клинических рекомендациях, регламентирующих диагностику, профилактику и лечение ХСН и острой декомпенсированной СН, сформулированных Обществом специалистов по сердечной недостаточности (ОССН), Российским кардиологическим обществом (РКО) и Российским научным медицинским обществом терапевтов (РНМОТ), СН трактуется как синдром, развивающийся в результате нарушения способности сердца к наполнению и/или опорожнению, протекающий в условиях нарушения баланса вазоконстрикторных и вазодилатирующих нейрогормональных систем, сопровождающийся неадекватной перфузией органов и тканей организма и проявляющийся комплексом симптомов (одышка, слабость, сердцебиение, повышенная утомляемостью и задержка жидкости в организме – отечный синдром) [1].
Этиологическая структура СН разнообразна и включает как ССЗ, так и сопутствующие состояния, способные приводить к ее развитию. Наиболее часто к развитию СН приводят артериальная гипертензия (АГ), ишемическая болезнь сердца (ИБС) и сахарный диабет (СД) [1, 2]. Так, в России на долю АГ в структуре причин СН приходится 95,5%, на долю ИБС – 69,7%, на долю СД – 15,9%; в США наиболее распространенной причиной СН считается ИБС, на долю которой приходится примерно 2/3 случая СН [1,2]. К другим причинам относят миокардиты, кардиомиопатиии, токсическое поражение миокарда различной этиологии, включая действие лекарственных средств (ЛС), обладающих способностью вызывать или усугублять течение СН, в последнем случае СН называют лекарственно-индуцированной.
К ЛС, способствующим развитию СН, относят большинство блокаторов кальциевых каналов (БКК; кроме дигидропиридиновых БКК III поколения и некоторых дигидропиридиновых БКК II поколения, например фелодипина), сахароснижающие препараты (ССП; некоторые ингибиторы фермента дипептидилпептидазы 4 [иДПП-4] и тиазолидиндионы [«глитазоны»] – пиоглитазон и росиглитазон), антиаритмические препараты (дизопирамид, дронедарон, лидокаин, лоркаинид, мексилетин, морацизин, пропафенон, токаинид, флекаинид, энкаинид), антрациклины (доксорубицин), противоопухолевые средства (бевацизумаб, инфликсимаб, лапатиниб, трастузумаб и др.), нестероидные противовоспалительные средства, селективные ингибиторы циклооксигеназы-2, некоторые β-адреноблокаторы [6]. Другие ЛС, которые были отмечены в отдельных случаях в качестве возможной причины развития лекарственно-индуцированной СН, представлены глюкокортикостероидами (преднизолон), агонистами дофаминовых рецепторов (каберголин, перголид, прамипексол, ропинирол), трициклическими антидепрессантами, антипсихотиками (клозапин), противоэпилептическими средствами (карбамазепин), противовирусными препаратами (зидовудин, амантадин), антибактериальными (ампициллин) и противогрибковыми ЛС (интраконазол), включая амфотерицин В, периферическими вазодилататорами (буфломедил, гидралазин, доксазозин), осмотическими диуретиками (маннитол и др.) [6].
Точная общая распространенность лекарственно-индуцированной СН неизвестна, а ее определение сопряжено с объективной трудностью дифференцирования СН, обусловленной ЛС, от многих других факторов, вызывающих этот синдром и, как правило, имеющихся у пациента. В настоящее время в литературе встречаются данные, характеризующие распространенность лекарственно-индуцированной СН относительно отдельных групп ЛС или отдельных представителей этих групп. Так, СН, ассоциированная с приемом антиаритмиков, встречается в 5–10% случаев; на СН, индуцированную с приемом БКК, приходится от 20,5 до 24% случаев, а на β-адреноблокаторы ‒ до 2%, СН, ассоциированная с использованием тех или иных противоопухолевых препаратов, встречается в 2–34% случаев [6].
Необходимо также отметить, что лекарственно-индуцированная СН у пациентов без ранее существовавшей дисфункции левого желудочка (ЛЖ) встречается крайне редко, в большинстве случаев наблюдается усугубление/обострение симптомов СН, обусловленное действием ЛС у лиц с уже установленной СН [6].
Одной из групп ЛС, способствующих развитию или прогрессированию/обострению уже имеющейся СН, является группа противодиабетических препаратов, что делает проблему лекарственно-индуцированной СН для лиц с СД весьма актуальной.
Мы уже упоминали, что СД является одной из наиболее распространенных причинных факторов СН. Распространенность СН среди пациентов с СД 2 типа (СД2) в возрасте до 65 лет значительно превышает аналогичный показатель в общей популяции (в 4 раза у мужчин и в 8 – у женщин) [7, 8]. Известно, что СН со сниженной фракцией выброса (ФВ) ассоциирована с более высокой вероятностью летального исхода и госпитализации больных, имеющих СД (по сравнению с лицами без СД). Пациенты с СД2 и СН характеризуются худшим долгосрочным прогнозом с повышенным риском прогрессирования СН (ОШ=1,17; 95% доверительный интервал [ДИ] – 1,04–1,32) и госпитализации по поводу СН (ОШ=1,19; 95% ДИ – 1,04–1,36); наличие СН удлиняет период стационарного лечения пациентов с СД [9].
Изложенное убедительно показывает необходимость информированности и учета потенциальной возможности ССП способствовать развитию или усугублять течение СН у лиц с СД, изначально характеризующихся повышенными сердечно-сосудистыми рисками. Необходимо, чтобы сахароснижающая терапия помимо достижения оптимального метаболического контроля оказывала как минимум нейтральное влияние на риски развития/декомпенсации СН и сердечно-сосудистых осложнений.
Перечень ССП, ассоциированных с развитием/прогрессированием СН, число случаев развития СН/застойной СН, ассоциированное с приемом того или иного СПП, и возможные механизмы представлены в таблице.
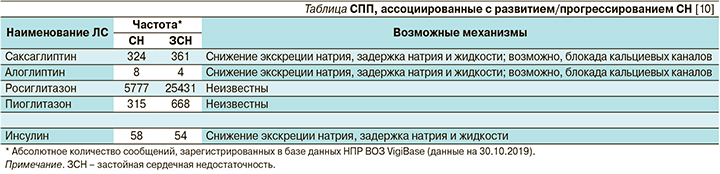
Далее будет рассмотрено влияние отдельных представителей различных групп ССП на развитие/прогрессирование СН.
Инсулин
К настоящему времени известно несколько проспективных клинических исследований, посвященных изучению влияния инсулинотерапии на сердечно-сосудитые события, включая СН, результаты которых имеют противоречивый характер.
В одном из первых подобных исследований G.L. Knatterud et al. [11] изучали влияние сахароснижающих ЛС на риск развития сердечно-сосудистых осложнений у пациентов с СД2. В результате изучения взаимосвязи между инсулинотерапией и риском макрососудистых осложнений выявлено не было. Схожие результаты были получены в британском проспективном исследовании (UK Prospective Diabetes Study Group, UKPDS), где также не было обнаружено связи между инсулинотерапией и макрососудистыми исходами (в т. ч. СН) у пациентов с впервые диагностированным СД2 [12].
В то же время результаты многоцентрового проспективного исследования, направленного на определение рисков и преимуществ интенсивной инсулинотерапии пожилых пациентов с СД2 (n=75) по сравнению с группой лиц, получающих стандартную терапию инсулином (n=78), свидетельствуют о значительном увеличении числа сердечно-сосудистых событий, в т.ч. СН, среди больных, получавших интенсивное лечение инсулином (32 против 20% в группе стандартной терапии) [13]. Однако последующая оценка влияния 2-летней интенсивной инсулинотерапии на функционирование ЛЖ показала отсутствие его влияния на систолическую или диастолическую функции [14].
В исследовании G.A. Nichols et al. [15] обнаружена большая распространенность СН среди пациентов с СД2, получающих инсулинотерапию, а также большая частота ее развития у больных без симптомов СН до начала терапии инсулином. Использовав множественную регрессионную модель, исследователи обнаружили статистически значимую взаимосвязь между инсулинотерапией и распространенностью уже имеющейся СН (OШ=1,47; 95% ДИ – 1,17–1,85), а также между инсулинотерапией и возникновением СН у пациентов без СН на момент начала лечения инсулином (OШ=1,66; 95% ДИ – 1,26–2,20). Авторы сделали заключение: использование инсулина является независимым фактором риска и предиктором развития СН. Однако они подчеркивают наблюдательный нерандомизированный характер данного исследования, что служит его ограничением, не позволяющим доказывать причинно-следственную связь между использованием инсулина и развитием ХСН.
S. Smooke et al. [16], обследовав 554 пациента без/с СД1 или СД2 и СН (ФВ ЛЖ – 24,6±7,4%), установили, что выживаемость в течение года больных с СН без СД (n=422) составила в среднем 89,7%, пациентов с СН и СД (n=89), принимавших пероральные ССП, – 85,8%, в группе больных СД и СН, получавших инсулин (n=43), – 62,1% (p<0,00001). Проведение мультифакторного анализа позволило авторам рассматривать использование инсулина как независимый предиктор смерти в группе больных СН (отношение рисков [ОР]=4,30; 95% ДИ – 1,69–10,94), тогда как использование пероральных ССП подобного влияния на смертность не оказывало (ОР=0,95; 95% ДИ – 0,31–2,93).
S.J. Pocock et al. [17], проанализировав данные 7601 пациента с ХСН, включенного в исследование CHARM (Candesartan in Heart Failure: Assessment of Reduction in Death and morbidity), выявили, что использование инсулина лицами с СД2 (9,3% всех пациентов в CHARM) оказывало негативное влияние на риск общей смертности (ОР=1,25; 95% ДИ – 1,03–1,51), а также риск сердечно-сосудистой смертности или частоту повторных госпитализаций по поводу СН (ОР=1,55; 95% ДИ – 1,29–1,86) по сравнению с пациентами, не использовавшими инсулин (19,1% всех пациентов CHARM).
Имеющиеся литературные данные позволяют говорить о том, что использование инсулина больными СД2 и СН, создает дополнительные риски в отношении развития/прогрессирования СН, что необходимо учитывать.
Препараты сульфонилмочевины (ПСМ)
Данные, свидетельствующие о возможности и характере влияния ПСМ на риск СН, весьма противоречивы.
Так, К.М. Pantalone et al. [18], изучив влияние пероральных противодиабетических ЛС (ПСМ, метформин и пиоглитазон) на сердечно-сосудистые события (ИБС, ЗСН и смертность) у 20450 лиц с СД2, обнаружили неблагоприятный профиль сердечно-сосудистой безопасности ПСМ по сравнению с другими пероральными ССП. Так, метформин был ассоциирован с более низким риском ЗСН (ОР=0,76; 95% ДИ – 0,64–0,91; р=0,003) и смерти (ОР=0,54; 95% ДИ – 0,46–0,64; р<0,001) по сравнению с ПСМ; пиоглитазон по сравнению с ПСМ, также ассоциировался с более низкой смертностью (ОР=0,59; 95% ДИ – 0,43–0,81; р<0,001).
Схожую цель преследовали I. Tzoulaki et al. [19], также изучавшие влияние пероральных ССП (ПСМ, метформин и тиазолидиндионы [ТЗД]) на сердечно-сосудистые события (инфаркт миокарда, ЗСН и смерть от всех причин) у 91 521 пациента с СД2. Результатом исследования также стал вывод о неблагоприятном профиле безопасности ПСМ, основанный на более высоком уровне смерти от всех причин и повышенном риске развития ЗСН при использовании ПСМ по сравнению с метформином.
А исследование J.W. Eriksson et al. [20] показало, что добавление ПСМ к метформину было ассоциировано с более высоким риском неблагоприятных сердечно-сосудистых событий и смерти от всех причин по сравнению с комбинацией метформин+иДПП-4 (ОР=1,17; 95% ДИ – 1,01–1,37; р=0,035 и ОР=1,25; 95% ДИ – 1,02–1,54; р=0,030 соответственно).
С другой стороны, результаты, опубликованные исследователями программ Prospective Diabetes Study (UKPDS) Group и A diabetes outcome progression trial (ADOPT), также не выявили влияния ПСМ на СН [21, 22].
Стратегия использования инсулина и ПСМ лицами с СД и высоким кардиометаболическим риском определена в клинических рекомендациях по СН экспертов ОССН, РКО и РНМОТ 2018 г. [1], согласно которым применение указанных ЛС больными СН возможно только при наличии прямых показаний к лечению СД – невозможности контролировать уровень глюкозы другими способами (класс рекомендаций IIb, уровень доказанности В).
Алгоритмы специализированной медицинской помощи больным СД (9-й выпуск, 2019) [23], сформулированные экспертами Российской ассоциации эндокринологов (РАЭ) и Национального медицинского исследовательского центра эндокринологии (НМИЦ эндокринологии), свидетельствуют о способности инсулина усугублять задержку жидкости с возможностью нарастания явлений ХСН (уровень достоверности доказательств [УДД] 3, уровень убедительности рекомендация [УУР] В). Вследствие потенциальной способности ПСМ усугублять течение ХСН использование данной группы ЛС пациентами с СД и ХСН должно осуществляться с осторожностью (УДД 1, УУР А).
Бигуаниды
Метформин – бигуанидный инсулиносенситайзер, известный ингибирующим действием на глюконеогенез в печени, а также способностью увеличивать чувствительность тканей к инсулину, повышать периферический захват глюкозы, окисление жирных кислот, при этом уменьшая всасывание глюкозы из желудочно-кишечного тракта.
Из-за того, что предшественником метформина был фенформин, продемонстрировавший сильную причинно-следственную связь с лактоацидозом, что послужило причиной отзыва последнего с фармакологического рынка в 1978 г., схожие опасения существовали и в отношении метформина.
Так, в 1996 г. Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration, FDA) сообщило о 47 случаях развития лактоацидоза у пациентов, принимавших метформин. При этом у 91% из них было ≥1 фактора риска лактоацидоза, 64% имели ССЗ, в т. ч. числе 38% – СН. ЗСН была добавлена в список противопоказаний к назначению метформина, в качестве которых традиционно выступала предрасположенность к лактоацидозу, формируемая в условиях почечной недостаточности, заболеваний печени и тяжелых заболеваний легких.
Однако в 2006 г. FDA удалило СН как абсолютное противопоказание к назначению метформина на основании полученных данных двух больших обсервационных исследований и клинических наблюдений, показавших, что риск развития лактоацидоза, ассоциированный с этим препаратом, минимален и не отличался от других ЛС, применяемых пациентами с СН.
В настоящее время доказана безопасность применения метформина на всех стадиях СН с сохраненной или стабильной умеренно сниженной почечной функцией. D.T. Eurich et al. [24] исследовали клинические исходы у лиц с СД2 и СН, сравнивая группу монотерапии метформином с группой монотерапии ПСМ и группой комбинированной терапии (метформин+ СМ). Было обнаружено, что монотерапия метформином ассоциировалась со снижением общей смертности по сравнению с группой ПСМ (ОР=0,70; 95% ДИ – 0,54–0,91) и группой комбинированной терапии (ОР=0,61; 95% ДИ – 0,52–0,72). Показатели общей смертности и госпитализации по всем причинам в группе терапии метформином также были ниже (ОР=0,83; 95% ДИ – 0,70–0,99 и ОР=0,86; 95% ДИ – 0,77–0,96 для групп ПСМ и комбинированной терапии соответственно).
В систематическом обзоре D.T. Eurich et al. [25] показали, что использование метформина в терапии пациентов с СД2 и СН было ассоциировано с уменьшением смертности (скорректированный риск=0,80; 95% ДИ – 0,74–0,87; р<0,001) по сравнению с группой контроля (в основном терапия ПСМ). Аналогичные результаты были зарегистрированы у пациентов с СН и хронической болезнью почек (объединенный скорректированный риск=0,8; 95% ДИ – 0,64–1,02; р=0,08). Также необходимо отметить, что метформин не был ассоциирован с повышенным риском лактоацидоза.
В 2016 г. FDA опубликовало заявление, согласно которому метформин противопоказан к назначению пациентам с СД и СН со сниженной функцией почек (скорость клубочковой фильтрации <30 мл/мин/1,73 м2) [26].
Клинические рекомендации по СН экспертов ОССН, РКО и РНМОТ 2018 г. [1] характеризуют метформин как препарат первого выбора лечения больных СД2 как без СН, которым проводится профилактика ХСН, так и пациентов с ХСН, в т.ч. при низкой ФВ ЛЖ и сочетании ХСН с нарушением функции почек (IIa, B). Эксперты РАЭ и НМИЦ эндокринологии в 9-м выпуске российских алгоритмов по СД [23] характеризуют метформин как безопасный препарат при лечении больных СД и ХСН с сохраненной ФВ, рекомендуя его как возможный препарат выбора пациентов с ХСН и нарушенной ФВ. Однако пациентам с тяжелой почечной и печеночной недостаточностью назначение метформина противопоказано из-за риска развития лактатацидоза (УДД 2, УУР А) [23].
Тиазолидиндионы
ТЗД (глитазоны) представляют собой группу препаратов, относящихся к классу сенситайзеров, т.е. ЛС, повышающих чувствительность периферических тканей к инсулину. Глитазоны достаточно широко используются в терапии пациентов с СД2 в составе комбинированной сахароснижающей терапии [23]. Однако известно, что представители данного класса ЛС обладают способностью задерживать жидкость, провоцируя проявление или усугубляя течение СН [6]. Так, W.H. Tang et al. [27], наблюдая в течение 2,5 лет 111 пациентов с ХСН и СД, выявили, что частота задержки жидкости у больных, принимавших ТЗД (пиоглитазон, росиглитазон, троглитазон) в составе монотерапии или в комбинации с инсулином (46% пациентов) составила 17%. Из них 26% пациентов были госпитализированы для лечения данного состояния, в т. ч. 11% с клинической картиной отека легких.
Механизмы, способствующие задержке жидкости с развитием отечного синдрома и СН у пациентов, получающих ТЗД, к настоящему времени изучены недостаточно. Считается, что прием глитазонов приводит к снижению экскреции натрия, задержке натрия и жидкости, увеличению объема циркулирующей крови с рос-том преднагрузки на миокард [6].
В многоцентровом рандомизированном двойном слепом исследовании S.E. Kahn et al. [22], посвященном изучению прогрессирования исходов СД2, 4360 пациентов были рандомизированы в 3 группы лечения: росиглитазоном (n=1456), метфомином (n=1454) и глибуридом (n=1441). Средняя продолжительность терапии составила 4,0 года в группах росиглитазона и метформина и 3,3 года – в группе глибурида. Было обнаружено, что в группе росиглитазона периферические отеки, отек легких и использование петлевых диуретиков регистрировались статистически значимо чаще (14,1%), чем в группах метформина (8,5%, р<0,001) и глибурида (7,2%, р<0,001). Сердечно-сосудистые события были зарегистрированы у 62 пациентов в группе росиглитазона, 58 – в группе метформина и у 41 – в группе глибурида. При этом в группе росиглитазона отмечалась более высокая частота развития СН. Так, ОР развития ХСН в группе росиглитазона по сравнению с группой метформина составило 1,22 (95% ДИ – 0,66–2,26; р=0,52), а ОР для группы росиглитазона по сравнению с группой глибурида – 2,20 (95% ДИ – 1,01–4,79; р=0,05).
В литературе опубликованы результаты ряда крупных исследований по изучению влияния глитазонов на СН, которые убедительно показали, что использование последних ассоциировалось как с усугублением уже существовавшей СН (ухудшение симптомов), так и с увеличением риска развития СН (новые случаи) [28–32]. Так, в исследование Н.С. Gerstein et al. [28], в котором изучалось профилактическое действие рамиприла и росиглитазона в отношении развития СД (The Diabetes Reduction Assessment with Ramipril and Rosiglitazone Medication, DREAM), были включены 5269 пациентов с повышенным уровнем глюкозы натощак и/или с нарушенной толерантностью к глюкозе, не имевших ССЗ (данное показание не зарегистрировано). Участники были распределены случайным образом в группы росиглитазона (n=2635) или плацебо (n=2634). В результате исследования было выявлено, что СН развилась у большего числа больных группы росиглитазона по сравнению с группой плацебо (0,5 против 0,1%; р=0,01), пациенты группы росиглитазона отличались большим риском развития СН (ОШ=7,03; 95% ДИ – 1,60–30,9; р=0,01) по сравнению с группой плацебо.
В многоцентровом проспективном открытом рандомизированном клиническом исследовании RECORD (Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycaemia in Diabetes) [29] 4447 пациентов с СД2 и ССЗ в анамнезе (инфаркт миокарда, инсульт, стенокардия, ХСН, транзиторная ишемическая атака) сравнивали 2 режима сахароснижающей терапии (росиглитазон+метформин/ПСМ и метформин+ПСМ). Промежуточный анализ спустя 3,75 года терапии показал достоверное увеличение риска развития СН у лиц, получавших росиглитазон (ОШ=2,15; 95% ДИ – 1,30–3,57).
Изучение влияния росиглитазона на динамику симптомов СН у лиц с СД2 осуществлено в исследовании H.J. Dargie et al. [30]. Применение пациентами с СД2 и СН I–II ФК по NYHA (ФВ ЛЖ ≤45%) росиглитазона (n=110) по сравнению с группой плацебо (n=104) в течение 52 недель было ассоциировано с увеличением смертности от всех причин (ОШ=1,5; 95% ДИ – 0,49–4,59), а также частоты госпитализаций по причине СН (ОР=1,30; 95% ДИ – 0,35–4,82).
Применение пиоглитазона (единственного препарата группы ТЗД, представленного в Российской Федерации в настоящее время) также ассоциировано с повышенной частотой развития и/или декомпенсации СН. Так, в проспективном рандомизированном двойном слепом исследовании PROactive (Prospective Pioglitazone Clinical Trial In Macrovascular Events) [31] 5238 пациентов с СД2 и признаками макрососудистых заболеваний (инфаркт миокарда, инсульт, реваскуляризация) изучали влияние пиоглитазона на макрососудистые исходы: пациенты были рандомизированы в группы пиоглитазона (n=2605) или плацебо (n=2633). В результате исследования было установлено, что прием пиоглитазона был ассоциирован с более высокой частотой развития СН (11 против 8% в группе плацебо; р<0,0001).
В 6-месячном рандомизированном двойном слепом многоцентровом исследовании T.D. Giles et al. [32], в котором приняли участие больные СД2 и СН II–III ФК по NYHA (ФВ ЛЖ ≤40%), сравнивали влияние пиоглитазона и глибурида на функцию ЛЖ. Комбинированная первичная конечная точка включала сердечно-сосудистую смерть, госпитализацию или посещение отделения неотложной помощи по причине СН. Было обнаружено, что пациенты, принимавшие пиоглитазон (n=262), первичной конечной точки (13%) достигали раньше и чаще, чем пациенты группы глибурида (8%; р=0,024). Госпитализация или посещение отделения неотложной помощи по причине СН произошло у 30 пациентов группы пиоглитазона и 15 ‒ глибурида.
Известен ряд мета-анализов, объединивших данные основных рандомизированных контролируемых и проспективных исследований, результаты которых также продемонстрировали способность ТЗД усугублять существующую СН и увеличивать риск ее развития [33–36].
Сравнение влияния различных ТЗД (росиглитазона и пиоглитазона) на риск развития серьезных сердечно-сосудистых событий было осуществлено в ретроспективном исследовании D.J. Graham et al. [37]. Анализ риска развития СН у 227 571 пациента, получавших ТЗД, показал, что больший риск был ассоциирован с росиглитазоном по сравнению с пиоглитазоном (ОШ=1,25; 95% ДИ – 1,16–1,34).
Результатом многочисленных исследований по оценке влияния ТЗД на риск развития и прогрессирования/обострения СН стали рекомендации по диабету, предиабету и ССЗ Европейского общества кардиологов (The European Society of Cardiology, ESC) в партнерстве с Европейской ассоциацией по изучению диабета (The European Association for the Study of Diabetes, EASD) [38], позиционирующих ТЗД (росиглитазон и пиоглитазон) как группу ЛС, ассоциированную с повышенным риском развития/прогрессирования СН у пациентов с СД2, не рекомендованную к использованию пациентами с СН или высоким риском ее развития (III, A). Эксперты ОССН, РКО и РНМОТ также не рекомендуют применения ТЗД для лечения СД2 у больных, имеющих высокий риск развития или клинически выраженную ХСН (III, A) [1]. Наконец, эксперты РАЭ и НМИЦ эндокринологии не рекомендуют использование ТЗД в отношении больных ХСН и СД2 (УДД 2, УУР А), что отражено в Алгоритмах специализированной медицинской помощи больным СД (9-й выпуск, 2019) [23].
Ингибиторы дипептидилпептидазы-4
В свете представленных выше данных фокус многих исследований, касающихся ССП, сместился в сторону сердечно-сосудистой безопасности этой группы ЛС: была инициирована масса рандомизированных контролируемых исследований. В поле пристального внимания и изучения попали в т.ч. и препараты группы иДПП-4. В настоящее время эта группа ССП, разработанных на основании современных представлений о физиологии инкретинов, широко используется в составе комбинированной сахароснижающей терапии при СД2 [23] и представлена в числе прочих саксаглиптином, алоглиптином, линаглиптином, вилдаглиптином и ситаглиптином.
Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus —Thrombolysis in Myocardial Infarction 53 (SAVOR-TIMI 53) [39] – первое многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование препаратов группы иДПП-4, в нем оценивались эффективность и сердечно-сосудистая безопасность саксаглиптина для пациентов ≥40 лет с СД2 и ССЗ в анамнезе (n=12 959) или множественными факторами риска ССЗ (n=3 533). Средний срок наблюдения составил 2,1 года. Результаты исследования показали отсутствие значимых различий в группах саксаглиптина (n=8280) и плацебо (n=8212) как по основной комбинированной конечной первичной точке исследования (сердечно-сосудистая смертность, нефатальные инфаркт миокарда и ишемический инсульт; ОР=1,0; 95% ДИ – 0,89–1,12; р=0,99), так и по основной комбинированной конечной вторичной точке (сердечно-сосудистая смертность, нефатальные инфаркт миокарда и ишемический инсульт, госпитализации по поводу нестабильной стенокардии, коронарной реваскуляризации или СН; ОР=1,02; 95% ДИ – 0,94–1,11; р=0,66). Однако за период наблюдения было отмечено развитие 741 случая госпитализации по причине СН у 517 пациентов, при этом в группе саксаглиптина число госпитализаций было больше (289 случаев, 3,5%), чем в группе плацебо (228 случаев, 2,8%), а риск госпитализации по причине СН – выше (ОР=1,27; 95% ДИ – 1,07–1,51; р=0,007), особенно в первые 6 месяцев терапии.
Оценка взаимосвязи между базовыми клиническими характеристиками общей группы пациентов (вне зависимости от лечения) и риском госпитализации по поводу СН показала, что наибольшим риском обладали лица, имевшие предшествовавшую СН (ОР= 2,98; р<0,01), хроническое заболевание почек с СКФ ≤60 мл/мин/1,73 м2 (ОР=1,54; р<0,01) и/или исходный уровень NT-proBNP (предшественник мозгового натрийуретического пептида) >332 пг/мл (ОР=5,47; р<0,01) [40].
Дальнейший анализ результатов исследования был посвящен изучению клинических исходов для лиц с/без предшествовавшей СН [40]. Так, пациенты группы саксаглиптина, исходно имевшие СН, отличались несколько большим по сравнению с плацебо риском развития комбинированных первичной и вторичной конечных точек (ОР=1,13; р=0,32 и 1,06; р=0,5 соответственно), чем лица без СН, получавшие саксаглиптин (ОР=0,97; р=0,68 и 1,01; р=0,87), однако эти различия были статистически не значимы. Риск госпитализации по причине СН у больных группы саксаглиптина был статистически значимо выше в подгруппе пациентов с отсутствием СН на момент рандомизации (ОР=1,32; р=0,02) по сравнению с группой плацебо, а в подгруппе пациентов с наличием СН на момент включения в исследование определялась сходная тенденция (ОР=1,21; р=0,15).
Сердечно-сосудистую безопасность алоглиптина в рамках многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования Examination of Cardiovascular Outcomes with Alogliptin versus Standard of Care (EXAMINE) [41], посвященого изучению влияния алоглиптина на основные сердечно-сосудистые события у пациентов с СД2 (n=5 380), перенесших острый коронарный синдром в течение 15–90 дней до рандомизации, рассмотрели F. Zannad et al. Средний период наблюдения составил 18 месяцев. В результате было обнаружено увеличение частоты госпитализаций по поводу СН в группе алоглиптина (3,9%) по сравнению с группой плацебо (3,3%; ОР=1,19; 95% ДИ – 0,90–1,58; р=0,22). Однако сравнение подгрупп алоглиптина с/без исходно имеющейся СН с плацебо выявило больший риск госпитализации по причине СН у больных, не имевших СН на момент включения в исследование (ОР=1,76; р=0,026), тогда как у пациентов с СН в анамнезе увеличения риска выявлено не было (ОР=1,00; р=0,996).
Изучением безопасности иДПП-4 вилдаглиптина для пациентов с СД-2 и СН (I–III ФК по NYHA) со сниженной ФВ ЛЖ (< 40 мл) занимались, в частности, J.J.V. McMurray et al. [42]. Пациенты (n=254) были рандомизированы в группы вилдаглиптина (n=128) и плацебо (n=126). Наблюдение в течение 52 недель выявило, что по сравнению с плацебо вилдаглиптин не оказывал значительного влияния на ФВ ЛЖ, однако приводил к увеличению объема ЛЖ; причина и клиническое значение этого факта остаются неизвестными. В связи с этим исследователи заявили о необходимости дальнейших исследований в области безопасности иДПП-4 для пациентов с СН и систолической дисфункцией ЛЖ.
Ретроспективный мета-анализ G. McInnes et al. [43], объединивший данные пациентов 40 двойных слепых рандомизированных контролируемых исследований вилдаглиптина III и IV фаз (с проспективной оценкой сердечно-сосудистых характеристик) продолжительностью от 12 до 104 недель, был посвящен изучению сердечно-сосудистой безопасности этого препарата, в т.ч. и риску развития/прогрессирования СН у 17 446 пациентов с СД2.
В результате анализа было обнаружено, что у 41 (0,43%) пациента, принимавшего вилдаглиптин (n=9599), и у 32 (0,45%) пациентов контрольной группы (n=7847) были зарегистрированы случаи СН, ОР развития/прогрессирования СН в группах составил 1,08 (95% ДИ – 0,68–1,70). Был сделан вывод: использование вилдаглиптина не ассоциировано с повышенным риском развития/прогрессирования СН у пациентов с СД2.
Также необходимо отметить, что в отличие от саксаглиптина и алоглиптина отдельных проспективных исследований, направленных на изучение профиля сердечно-сосудистой безопасности вилдаглиптина, к настоящему времени выполнено не было.
Цель многоцентрового рандомизированного плацебо-контролируемого исследования The Cardiovascular and Renal Microvascular Outcome Study With Linagliptin (CARMELINA) [44] заключалась в оценке влияния линаглиптина на исходы ССЗ и заболеваний почек у пациентов с СД2 и высоким риском сердечно-сосудистых и почечных событий. Включенные в исследование пациенты были рандомизированы в группы линаглиптина (n=3 494) или плацебо (n=3485), которые были добавлены к обычной схеме ведения больных. Установлено, что у лиц с СД2, высоким сердечно-сосудистым и почечным риском линаглиптин по сравнению с плацебо не увеличивал сердечно-сосудистый риск в течение периода наблюдения (в среднем 2,2 года). В свете рассматриваемой проблемы важен тот факт, что время до первой госпитализации по поводу СН в группе линаглиптина было сопоставимо с аналогичным показателем в группе плацебо (ОР=0,90; 95% ДИ – 0,74–1,08; р=0,26). Сравнение подгрупп линаглиптина с/без исходной СН с плацебо не выявило отличий в риске госпитализации по причине СН (ОР=0,88; р=0,33 и ОР=0,92; р=0,56 соответственно) [45].
Влияние на сердечно-сосудистые события иДПП-4 ситаглиптина (Янувия) у пациентов с СД2 и ССЗ изучено в исследовании Trial Evaluating Cardiovascular Outcomes with Sitagliptin (TECOS) [46]. В этом рандомизированном двойном-слепом клиническом исследовании 14 671 пациент был рандомизирован в отношении 1:1 в группы ситаглиптина и плацебо. Средний период наблюдения составил 3,0 года. Анализ результатов исследования позволил прийти к следующему выводу: назначение ситаглиптина пациентам с СД2 и ССЗ не оказало влияния на частоту основных сердечно-сосудистых событий, а также не влияло на смертность от всех причин (ОР=1,01; 95% ДИ – 0,90–1,14; р=0,88), сердечно-сосудистую смертность (ОР=1,03; 95% ДИ – 0,89–1,19; р=0,71) или некардиоваскулярную смертность. Терапия ситаглиптином не была ассоциирована с повышенным риском госпитализаций по поводу СН (ОР=1,00; 95% ДИ – 0,83–1,20; р=0,98), а также с достижением комбинированной конечной точки – частота госпитализаций по поводу СН/сердечно-сосудистая смертность (ОР=1,02; 95% ДИ – 0,90–1,15; р=0,74). Полученные данные позволили исследователям сделать вывод о нейтральном действии ситаглиптина (Янувия) в отношении сердечно-сосудистых рисков и СН, а следовательно, о безопасности его использования пациентами с СД2 и наличием ССЗ.
Сравнение подгруппы пациентов, принимавших ситаглиптин и имевших СН до включения в исследование, и всех пациентов группы ситаглиптина с плацебо не выявило значимых различий во влиянии препарата как на риск госпитализации по причине СН (ОР=1,03; р=0,86 для подгруппы ситаглиптина с исходной СН; ОР=1,00; р=0,95 для всей группы ситаглиптина), так и на комбинированную конечную точку – частоту госпитализаций по поводу СН/сердечно-сосудистой смертности (ОР=0,96; р=0,71 для подгруппы ситаглиптина с исходной СН; ОР=1,02; р=0,81 для всей группы ситаглиптина) [47].
Вторичный анализ и сравнение подгрупп пациентов, госпитализированных по причине СН, выделенных из групп ситаглиптина (Янувия) (n=228 из 7 337 пациентов) и плацебо (n=229 из 7 337), показал незначительные различия в СН-ассоциированных исходах в зависимости от базовых характеристик подгрупп. Представители всех подгрупп (с/без исходной СН) в целом характеризовались низким риском госпитализации по причине СН, при этом пациенты с исходной СН I ФК по NYHA имели риск (ОР=1,08), сравнимый с таковым пациентов, не имевших СН исходно (ОР=0,96), еще большая тенденция к снижению риска госпитализации по причине СН была отмечена у больных исходной СН ≥II ФК по NYHA (ОР=0,82; р=0,12 для всех значений ОР) [47].
В мета-анализ D. Liu et al. [48] было включено четыре крупных рандомизированных контролируемых и три наблюдательных исследования больных СД2 (n=157 478), где 76 026 пациентам был назначен иДПП-4 (вилдаглиптин, ситаглиптин, саксаглиптин, алоглиптин, линаглиптин и омариглиптин – не зарегистрирован в Российской Федерации), а 81 452 пациентов были отнесены к контрольной группе. Анализ сердечно-сосудистых исходов показал, что в течение периода наблюдения от 52 до 152 недель показатели первичной конечной точки (сердечно-сосудистая смерть, нефатальный инсульт, нефатальный инфаркт миокарда) существенно не различались в группах с/без использования любого иДПП-4 (ОШ=0,95; 95% ДИ – 0,86–1,04; р=0,26). Существенных различий в группах не отмечалось также в отношении показателей смерти от всех причин (OШ=0,84; 95% ДИ – 0,59–1,18; р=0,31), госпитализаций по поводу сердечно-сосудистых осложнений (OШ=1,02; 95% ДИ – 0,96–1,09; р=0,45) и госпитализаций по поводу СН (OШ=1,05; 95% ДИ – 0,90–1,23; р=0,55).
Многочисленные исследования, посвященные изучению профиля сердечно-сосудистой безопасности иДПП-4, и их результаты легли в основу клинических рекомендаций, регламентирующих использование представителей данной группы, в т.ч. лицами с СД2 и ХСН. Так, эксперты РАЭ и НМИЦ эндокринологии в Алгоритмах специализированной медицинской помощи больным СД (9-й выпуск, 2019) [23] указывают, что иДПП-4 (за исключением саксаглиптина) не увеличивают риск сердечно-сосудистых событий и тяжесть ХСН (УДД 1, УУР А). В свою очередь клинические рекомендации по диабету, предиабету и ССЗ Европейского общества кардиологов (ESC) в партнерстве с Европейской ассоциацией по изучению диабета (EASD) [38] характеризуют иДПП-4 ситаглиптин и линаглиптин как ЛС, обладающие нейтральным эффектом в отношении риска госпитализации по причине СН, которые могут быть использованы для терапии пациентов с СД2 и СН (IIb, B). Ингибитор ДПП-4 саксаглиптин из-за ассоциации с высоким риском госпитализации по причине СН не рекомендован к использованию пациентами с СД2 и высоким риском развития СН, а также пациентами с СД и СН в анамнезе (III, B).
Эксперты ОССН, РКО и РНМОТ в клинических рекомендациях по СН 2018 г. [1] отдают предпочтение использованию у пациентов с СД2 (IIb, B) иДПП-4 ситаглиптину как препарату c нейтральным действием в отношении СН.
К сожалению, механизмы, с помощью которых иДПП-4 (саксаглиптин и алоглиптин) способствуют увеличению риска госпитализации по поводу СН, а также объясняющие различия между разными представителями этой группы ЛС в отношении данной конечной точки, в настоящее время неизвестны, возможно, что продолжающиеся исследования помогут ответить на этот вопрос. В качестве одного из возможных патофизиологических механизмов рассматривается роль ингибирования ДПП-4, участвующего в регуляции ряда пептидов, имеющих отношение к сердечно-сосудистой системе (глюкагоноподобный пептид-1 [glucagon-like peptide-1– GLP-1], желудочный ингибиторный полипептид [gastric inhibitory polypeptide – GIP], мозговой натрийуретический пептид [brain natriuretic peptide – BNP] и стромальный клеточный фактор-1 [stromal cell-derived factor-1 – SDF–1]), тем самым влияя не только на уровень гликемии, но и на уровень артериального давления, липиды крови и функциональное состояние сердечно-сосудистой системы [49, 50]. При этом различия в ассоциациях отдельных представителей группы с повышенным риском развития/прогрессирования СН могут быть связаны с отличиями на уровне молекулярной структуры ЛС (саксаглиптин – это созданный на основе β-аминокислоты пептидомиметический иДПП-4, тогда как алоглиптин представляет собой модифицированный пиримидиндион), с различными фармакологическими характеристиками, такими как разная селективность и мощность действия в отношении ДПП-4, продолжительность действия, особенности метаболизма и путей элиминации, что способно оказывать существенное воздействие на клиническое использование различных представителей группы.
Период полувыведения – один из показателей, характеризующих фармакологическую неоднородность группы. Если у одних иДПП-4 (алоглиптин, линаглиптин, ситаглиптин) он довольно продолжителен, обеспечивая стойкое ингибирование фермента при приеме 1 раз в сутки, то у других (саксаглиптин, вилдаглиптин) – более короткий. Однако ковалентный тип связи саксаглиптина и вилдаглиптина с ферментом (в отличие от нековалентного типа связи, характерного для алоглиптина, линаглиптина и ситаглиптина) обеспечивает более продолжительную по времени связь и соответственно малую кратность приема. Так, несмотря на то что период полувыведения саксаглиптина не превышает 5 часов, использование 1 раз в сутки возможно для данного ЛС.
К особенностям метаболизма и путей элиминации алоглиптина, ситаглиптина относится следующее: они практически не метаболизируются и выводятся почками преимущественно в неизмененном виде. В свою очередь саксаглиптин, метаболизирующийся в печени, образует активный метаболит с вполовину меньшей мощностью действия. То есть после приема саксаглиптина около 24% препарата циркулируют в интактном виде и около 36% – в виде значительно менее активного метаболита. В свою очередь вилдаглиптин, метаболизирующийся за счет цитохром-Р450 – независимого гидролиза и обладающий большей чувствительностью к гидролизу, лишь в 23% циркулирует в виде родительского препарата, а его метаболит вовсе фармакологически не активен. Окончательная элиминация саксаглиптина и вилдаглиптина происходит в почках с выведением как самого препарата, так и его метаболитов.
Экскреция с желчью – основной путь элиминации линаглиптина.
В терапевтических дозах препарат находится преимущественно в связанной с белком форме, что минимизирует его почечный клиренс.
Знание особенностей метаболизма и элиминации имеет значение при учете возможности лекарственных взаимодействий между иДПП-4 и другими ЛС, которые на практике минимальны и в большинстве случаев не требуют корректировки доз препаратов. Однако использование саксаглиптина с мощными ингибиторами CYP3A4/5 способно приводить к повышению концентрации иДПП-4, диктуя необходимость снижения дозы препарата. Совместное использование линаглиптина с индукторами CYP3A4 (рифампицин) способствует снижению концентрации линаглиптина с ожидаемым сохранением его клинической эффективности, которая, однако, будет проявляться не в полной мере.
Кроме того, различия в механизмах выведения отдельных представителей группы иДПП-4 влияют на особенности их практического использования. Так, достижения адекватного терапевтического действия иДПП-4 у пациентов с нарушенной функцией почек требует коррекции доз в той или иной степени представителей группы с преимущественной почечной элиминацией (ало-, сакса-, вилда- и ситаглиптин) в отличие от представителей группы с иным преимущественным путем выведения (линаглиптин). При этом необходимо отметить, что результаты крупномасштабных исследований по оценке безопасности использования иДПП-4 у пациентов с СД2 и заболеваниями почек, показали хорошую переносимость представителей группы у данной когорты пациентов.
Заключение
Современная стратегия лечения СД требует учета как эффективности, так и безопасности осуществляемой сахароснижающей терапии, при этом сердечно-сосудистая безопасность выступает одной из основополагающих целей данной терапии. Очевидно, что ряд ССП ассоциирован с высокими сердечно-сосудистыми рисками, включая риск развития/прогрессирования СН. Несомненно, информированность о потенциальной возможности развития СН при использовании тех или иных ССП поможет существенно расширить возможности практической медицины в сфере контроля за эволюцией СН, позволив в конечном счете влиять на сердечно-сосудистые риски и клинические исходы.
В настоящее время инсулин и ПСМ должны использоваться пациентами с СД2 и СН с осторожностью как препараты, потенциально способные усугублять течение уже имеющейся ХСН. ТЗД, увеличивая риск прогрессирования ХСН, также не рекомендованы к применению пациентами с СД2 и СН. Метформин считается безопасным ЛС при лечении больных СД2 и ХСН с сохраненной ФВ, а также может быть препаратом выбора терапии пациентов СД2 и ХСН с нарушенной ФВ. Ситаглиптин (Янувия) и линаглиптин не увеличивают риска госпитализаций по причине СН у больных СД2 и могут применяться у данной когорты пациентов.


