«Раньше мы рассказывали пациентам об их шансах, и дорога была одинаково плохой. Теперь мы знаем, что каждый четвертый из них переживает 5 лет. Это меняет наше мышление».
Давид Л. Грэм
МD, медицинский директор Института рака Левина, эксперт ASCO
Обоснование
Такое оптимистичное высказывание было подкреплено опубликованными данными 5-летней выживаемости в исследовании 1В-фазы KEYNOTE-001, которая в среднем составила 23,2% при применении пембролизумаба в 1-й линии терапии для распространенного немелкоклеточного рака легкого (НМРЛ). Исследование KEYNOTE-001 стартовало в 2011 г., когда иммунотерапия была только начинающейся и никому не известной опцией в терапии солидных опухолей. Из 550 пациентов, включенных в исследование, 449 получали терапию по поводу диссеминированного процесса в анамнезе, из них 101 больной получал пембролизумаб (Китруда®) в 1-й линии терапии. Все пациенты исходно получали пембролизумаб в дозах 2 мг/кг или 10 мг/кг каждые 3 недели. Именно в ходе KEYNOTE-001 была определена и стала использоваться доза пембролизумаб (Китруда) в 200 мг в/в капельно каждые 3 недели независимо от массы тела. При медиане наблюдения 60,6 месяца 18% пациентов по-прежнему остаются живы. Средняя продолжительность лечения составляла 3,3 месяца.
При анализе долгосрочных результатов исследования стало очевидным, что наилучшие результаты при терапии пембролизумабом были у пациентов, ранее не получавших лечения: около 23% из них живы по прошествии 5 лет, но только 15,5% больных, ранее получавших системную химиотерапию, могут преодолеть этот рубеж. Также в ходе исследования было показано, что высокий уровень экспрессии PD-L1 коррелирует с высоким уровнем выживаемости: так, 29,6% пациентов, ранее не получавших лечения и с экспрессией PD-L1 50% и более, остаются в живых 5 лет и только 15,7% преодолевают этот рубеж при экспрессии PD-L1 менее 50%. Такая же зависимость от уровня PD-L1 прослеживается у предлеченных больных: 25 против 12,6% живы по прошествии 5 лет. У 23% ответивших на терапию пембролизумабом в 1-й линии эффекты сохранялись в среднем 38,9 месяца; у 42% пациентов, получивших пембролизумаб во 2-й и более линиях терапии, медиана длительности ответов составила 16,8 месяца. Иммуноопосредованные нежелательные явления встречались в 17% случаев и чаще всего проявлялись гипотиреозом и пневмонитами. Полученные в исследовании KEYNOTE-001 данные были подкреплены результатами исследования KEYNOTE-024, а также реальной клинической практикой и на сегодняшний день пембролизумаб является стандартом 1-й линии терапии у пациентов с распространенным НМРЛ с экспрессией PD-L1 50% и более [1].
Показание к применению пембролизумаба (Китруда) в качестве 1-й линии терапии при НМРЛ было зарегистрировано в России 18.05.2017, с этого момента стало возможным его назначение больным с гиперэкспрессией PD-L1 (50% и более).
Несмотря на то что эра ингибиторов контрольных точек изменила судьбу пациентов с диссеминированным НМРЛ, у которых в силу поздней обращаемости заболевание диагностируется на поздних стадиях (у 70% пациентов), в терапии пациентов с метастатическим поражением головного мозга остаются нерешенные вопросы [2]. Метастатическое поражение головного мозга традиционно считается плохим прогностическим фактором, и медиана выживаемости пациентов с впервые выявленным заболеванием не превышает 6 месяцев [3, 4]. Клинические исследования последних лет показали, что частота метастазирования в головной мозг при всех видах рака варьирует от 8,5 до 15%, что обусловлено улучшением диагностических возможностей: повсеместное использование лучевых методов магнитно-резонансной томографии (МРТ), компьютерной томографии (КТ) [4, 5]. Наиболее часто поражение головного мозга встречается при НМРЛ и мелкоклеточном раке легкого, раке молочной железы, меланоме, почечно-клеточном раке. У пациентов с метастазами в головной мозг прогноз после установки диагноза вариабелен и зависит от множества факторов, включающих возраст, соматический статус, распространенность болезни, интра- и экстракраниальное поражения, молекулярно-генетический статус первичной опухоли [6]. Для рака легкого, рака молочной железы и меланомы были выявлены специфические факторы прогноза на основании мутационного статуса опухоли [7–9].
Хирургическое вмешательство и лучевая терапия до недавнего времени были основным методом в лечении метастазов в головной мозг, а возможности применения химиотерапии были ограничены ввиду ее низкой интракраниальной активности.
Два знаковых клинических исследования в начале 1990-х гг. показали, что операция и добавление к ней лучевой терапии приводят к увеличению продолжительности жизни больных с метастатическим поражением головного мозга и обеспечивают локальный контроль над метастазами [10, 11]. Использование методов локального воздействия на очаги опухоли в головном мозге – стереотаксическая радиохирургия (Stereotactic Radiosurgery, SRS), или радиационной терапии в виде облучения всего головного мозга (Whole Brain Radiotherapy, WBRT) также повлияли на продолжительность жизни пациентов, однако имели тяжелые осложнения (инсульт, радиационный некроз, когнитивный дефицит). В настоящее время, несмотря на нежелательные явления, локальная лучевая терапия остается стандартом в лечении пациентов с множественным метастатическим поражением головного мозга [12]. В последние годы были проведены ретроспективные исследования применения ингибиторов контрольных точек в терапии опухолей, которые чаще всего метастазируют в головной мозг, а также отдельно изучена когорта пациентов с поражением головного мозга [13]. В табл. 1 представлены данные клинических исследований по изучению эффективности иммуноонкологических препаратов при лечении пациентов с поражением головного мозга.
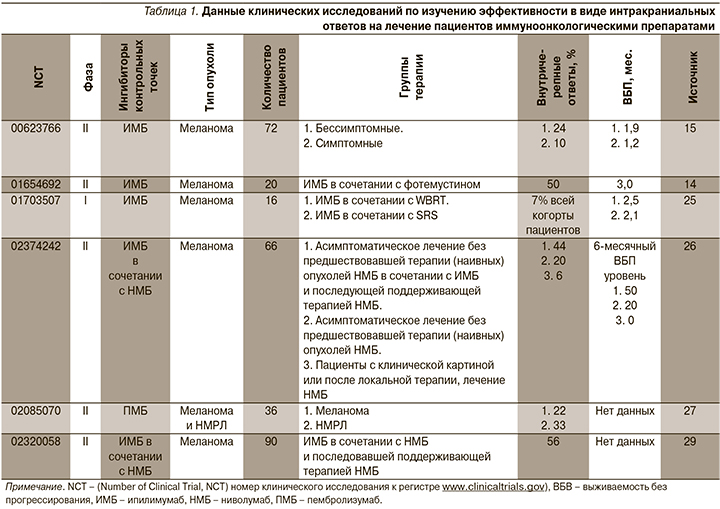
Одними из первых исследований эффективности использования иммунотерапии при метастатическом поражении головного мозга стали исследования III фазы: ChekMate-012 (NCT 01454102), СhekMate-017(NCT 01642004) и KEYNOTE-022 (NCT 02130466), в которые были включены больные с бессимптомными метастазами. Однако не были опубликованы результаты о частоте интракраниальных ответов.
В одноцентровое открытое исследование II фазы по изучению эффективности и безопасности применения пембролизумаба у пациентов с НМРЛ и меланомой с поражением головного мозга были включены 36 больных (из них 18 с НМРЛ и 18 с меланомой) с измеряемыми очагами (очаги размером ≥5 до 20 мм), не получавших системной терапии или с подтвержденным прогрессированием в связи с появлением метастазов в головном мозге [14].
Пациенты с неврологической симптоматикой, требующей коррекции кортикостероидами, в исследование не включались. Пембролизумаб вводился в дозе 10 мг/кг каждые 2 недели. Первичной конечной точкой исследования была частота интракраниальных ответов: достижение полного и частичного ответов. Были проанализированы 36 больных: из них 13 пациентам с меланомой и 16 с НМРЛ не проводилась терапия по поводу метастазов в головной мозг. Частичный регресс достигнут у 4 (22%) из 18 пациентов с меланомой и у 6 (33%) из 18 больных с НМРЛ. У 4 пациентов с НМРЛ был отмечен полный регресс метастазов в головном мозге. В процессе проведения исследования была оценена безопасность проводимой терапии: у 1 больного с меланомой во время лечения были отмечены когнитивные расстройства 3-й степени. Чаще всего встречались следующие нежелательные явления: головная боль (в 19% случаев), головокружение и судороги 1-й ст. (в 17% случаев, у больных меланомой). Это исследование показало, что пембролизумаб активен в отношении метастазов в головной мозг как у пациентов с НМРЛ, так и у больных меланомой.
В 2018 г. на ежегодной конференции американских клинических онкологов (American Society of Clinical Oncology, ASCO) были доложены последние результаты этого исследования: у 34 (29,4%) больных, включенных в это исследование, были достигнуты интракраниальные эффекты. Медиана общей выживаемости составила 8,9 месяца, 31% больных остаются живы в течение двух лет и более. Дискордантность между интракраниальными и системными ответами опухоли была отмечена у 7 пациентов (21%), из них у 4 было зарегистрировано прогрессирование болезни за счет очагов в головном мозге и частичный ответ по экстракраниальным проявлениям болезни, у 3 был отмечен эффект по интракраниальным очагам и системное прогрессирование [15]. Интеграция лучевой терапии (SRS и WBRT) в сочетании с иммунотерапией была предметом интенсивных исследований последних лет. Обоснование подобной комбинации первоначально получено из наблюдений за абскопальным эффектом, явлением при котором облучение опухоли в одном месте приводит к регрессу метастатического очага, не подвергавшегося воздействию какого-либо излучения.
Достижения в области иммунологии последних лет поспособствовали нашему пониманию данного феномена, и, хотя механизмы все еще не полностью понятны, сочетание иммунотерапии и облучения для увеличения частоты абскопального эффекта заключается в появлении опасность-ассоциированных молекулярных паттернов (Danger-associated Molecular Patterns, DAMPs) и неоантигенов или опухоль-ассоциированных антигенов (Tumor-associated Antigens, TAAs) [16]. Неоантигены поглощаются антигенпрезентирующими клетками и предоставляются цитотоксическим Т-лимфоцитам. Таким образом формируется популяция Т-лимфоцитов, прошедших антигензависимую дифференцировку и «обученных» распознавать клетки-мишени, экспрессирующих неоантигены в организме [17]. Редкость этого феномена объясняется неспособностью цитотоксических Т-лимфоцитов преодолевать микроокружение опухоли, обладающее иммуносупрессивными свойствами [18]. Тем не менее настоящая гипотеза заключается в том, что, сочетая облучение с иммунотерапией, мы можем преодолевать иммуносупрессивный эффект микроокружения опухоли, тем самым увеличив абскопальный эффект. Многочисленные исследования последних лет изучали стратегии комбинирования иммунотерапии и лучевой терапии (SRS или WBRT) для повышения внутричерепного ответа. Некоторые из первых ретроспективных данных были получены в исследовании A.P. Kiess et al., в котором оценивалось одновременное лечение ипилимумабом и SRS у 46 пациентов со 113 метастазами в головной мозг. Авторы обнаружили, что пациенты, получавшие SRS во время или до ипилимумаба, имели лучшую общую выживаемость и меньшую частоту регионарных рецидивов, чем пациенты, получавшие SRS после ипилимумаба [19]. Другая группа проанализировала 25 пациентов с 58 метастазами в головной мозг и обнаружила, что если SRS была выполнена в течение 30 дней после иммунотерапии, время до прогрессирования было больше по сравнению с группой пациентов, не получавших одновременной иммунотерапии [20]. Возможно, лучшим доказательством параллельной терапии является исследование J.M. Qian et al., в котором было проанализировано более 560 метастазов меланомы в головной мозг у 75 пациентов. Авторы обнаружили, что одновременная SRS и иммунотерапия значительно уменьшали объем поражения по сравнению с неконкурентной терапией [21]. В то время как большая часть литературы описывает преимущества параллельной терапии, важно отметить, что в одном из исследований с 35 пациентами не было показано эффективности [22].
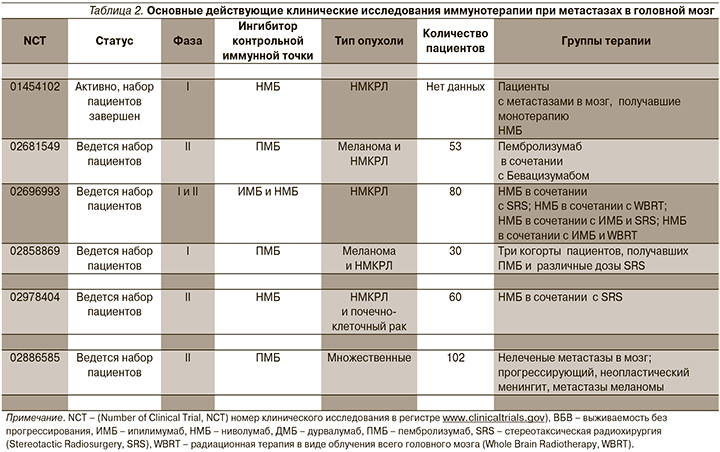
В настоящее время проводятся многочисленные исследования, посвященные изучению эффективности, правильного выбора времени и безопасности сочетания лучевой и иммунотерапии (NCT 02662725, NCT 02107755, NCT 02115139, NCT 02696993, NCT 02858869, NCT 02978404, NCT 03340129). Результаты этих исследований помогут оценить преимущества одновременной иммунотерапии и SRS при метастазировании в мозг (табл. 2).
В данной статье представлен клинический случай, описывающий собственный опыт авторов эффективного применения пембролизумаба у пациентов с НМРЛ с метастатическим поражением головного мозга.
Клинический случай
Пациент К. 1962 г.р. Диагноз: периферический рак правого легкого Т3N3M1 (IV ст.), метастаз в левую теменную область, состояние после удаления метастаза в левой теменной области 21.11.17, терапии пембролизумабом.
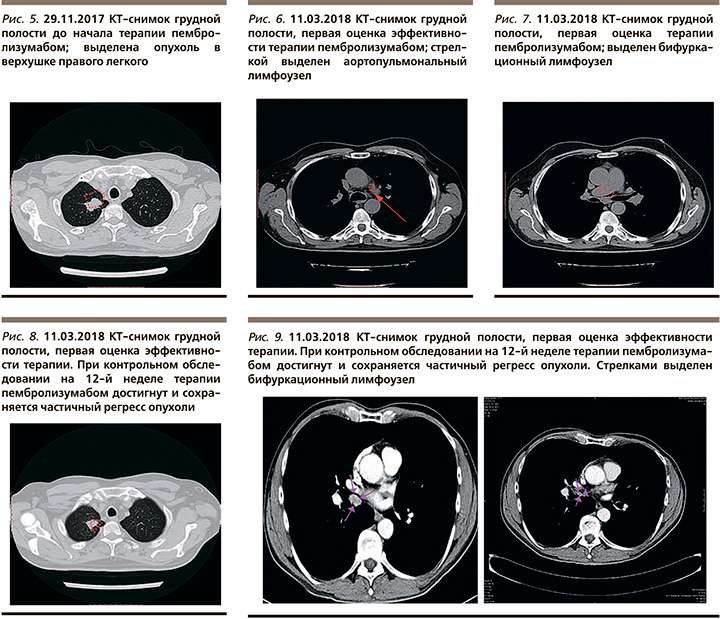
Пациент считает себя больным с 14.10.2017, когда на фоне внезапно развившегося первого эпизода повышения артериального давления до 190/100 мм рт.ст. возникло нарушение речи, появилась слабость в правой руке. Бригадой скорой медицинской помощи пациент был доставлен в городскую клиническую больницу, где во время транспортировки и в приемном отделении у пациента было отмечено несколько эпизодов судорог. После получения результатов компьютерной томографии (КТ) головного мозга с в/в контрастированием состояние пациента было расценено как острая недостаточность мозгового кровообращения и начата консервативная терапия. На фоне проводимой терапии вышеуказанная симптоматика регрессировала и состояние пациента улучшилось. С 06.11.2017 состояние пациента вновь ухудшилось – появилось нарушение речи, нарастание слабости в правой руке и ноге, чувство онемения в правой руке и ноге. 14.11.2017 была выполнена МРТ головного мозга с контрастированием, во время которой была выявлена опухоль в левой задне-теменной области 41×25 мм с выраженным перифокальным отеком (рис. 1). Пациенту была назначена противоотечная терапия: дексаметазон 8 мг рer оs в сутки, и на фоне его приема неврологическая симптоматика частично регрессировала. Пациент обратился в НМИЦ нейрохирургии им. акад. Н.Н. Бурденко, где 21.11.2017 было выполнено оперативное вмешательство в объеме удаления опухоли левой теменной области с применением ультразвукового исследования навигации. По данным гистологического и иммуногистохимического исследования было сделано следующее заключение: иммунофенотип клеток соответствует иммунофенотипу аденокарциномы легкого. По результатам молекулярно-генетического исследования: мутации ЕGFR, ALK, ROS 1, BRAF в опухоли не обнаружены. Экспрессия PD-L1 определяется в 80% опухолевых клеток. Перед началом лечения с целью уточнения распространенности болезни была выполнена КТ грудной, брюшной полости, малого таза с контрастированием. Выявлено поражение бифуркационных, паратрахеальных, аортопульмональных лимфоузлов (рис. 3–5). Размеры опухолевых очагов по данным компьютерной томографии грудной клетки до начала лечения: опухолевый узел на границе S1/S2 размером 20×20 мм, аортопульмональный лимфоузел – 17×15 мм, бронхопульмональный лимфоузел – 15×15 мм.
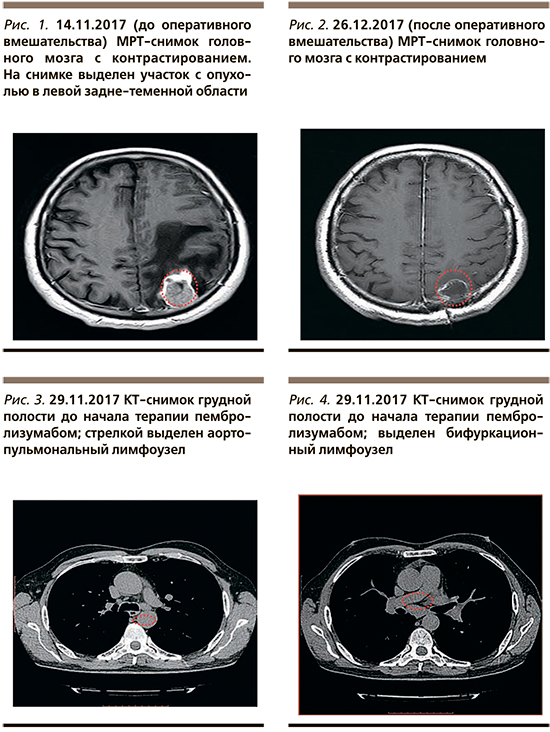
С 16.12.2017 начата терапия пембролизумабом 200 мг в/в капельно 1 раз в 3 недели (рис. 2). С 15.01.2018 по 17.01.2018 проведен курс стереотаксического облучения в режиме гипофракционирования на ложе опухоли левой теменной области, суммарная очаговая доза (СОД)=22,5 Гр. Согласно результатам контрольного обследования, выполненного на 12-й неделе терапии пембролизумабом, был достигнут частичный регресс опухоли. По данной КТ грудной клетки: опухолевый узел на границе S1/S2 размером 10×9 мм, аортопульмональный лимфоузел – 10×5 мм, бронхопульмональный лимфоузел – 10×12 мм (рис. 7–9). Терапия пембролизумабом продолжена. На момент описания клинического случая (октябрь, 2019) продолжается терапия пембролизумабом, сохраняется частичный регресс.
Обсуждение
Таким образом, частичный регресс опухоли у пациента был впервые зарегистрирован на 12-й неделе терапии пембролизумабом и сохраняется в течение 19 месяцев. Появления новых метастатических очагов в головном мозге не наблюдается, что позволяет предположить, что терапия пембролизумабом обеспечивает контроль метастатического процесса в центральной нервной системе в течение 19 месяцев. Нежелательные явления на фоне проводимой терапии не отмечены.
Заключение
Таким образом, пембролизумаб является эффективной и безопасной опцией для лечения пациентов с НМРЛ и поражением головного мозга. Однако остается проблема ведения пациентов с симптомными метастазами в головной мозг, что требует дальнейшего изучения.



