Введение
Препараты класса ингибиторов иммунных контрольных точек являются относительно новым методом терапии онкологических заболеваний, ставшим одним из важнейших достижений современной медицины. Эти препараты усиливают противоопухолевую активность собственной иммунной системы пациента, блокируя иммунные контрольные точки, которые являются физиологическими механизмами регулирования и подавления избыточной активности иммунного ответа. У здорового человека ингибирующие иммунные контрольные точки отвечают за формирование толерантности к собственным антигенам организма, снижая вероятность развития аутоиммунных реакций [1]. Однако у пациентов с онкологическими заболеваниями те же механизмы могут значительно снижать возможности иммуноопосредованного клиренса опухолевых клеток. Происходит это потому, что клетки злокачественной опухоли способны повышать экспрессию молекул иммунных контрольных точек на своей поверхности, тем самым используя их как средство уклонения от иммунного надзора [1–3].
В качестве возможных терапевтических целей исследуются различные физиологические механизмы, вовлекающие иммунные контрольные точки. Сегодня уже разработаны успешные методы лечения, которые работают благодаря блокаде цитотоксический T-лимфоцит-ассоциированных молекул (CTLA-4) или протеинов запрограммированной клеточной смерти 1 (PD-1) и их лигандов (PD-L1). CTLA-4 представляет собой молекулу иммунной контрольной точки, экспрессируемую на Т-клетках. При связывании со своими лигандами B7-1 или B7-2 эта молекула ингибирует активацию Т-клеток [4]. PD-1 представляет собой другую молекулу класса иммунных контрольных точек, экспрессируемую на активированных Т-клетках, В-и NK-клетках. При взаимодействии с лигандами, которыми являются PD-L1 или PD-L2, PD-1 снижает эффекторную активность иммунных клеток в периферических тканях. При ингибировании PD-1 в первую очередь происходит усиление эффекторной функции Т-клеток, однако усиление продукции антител и повышение активности NK-клеток также может играть важную роль [5]. Поскольку ингибирование молекул иммунных контрольных точек CTLA-4 или PD-1 приводит к усиленному противоопухолевому иммунному ответу, для их блокады были разработаны специфичные моноклональные антитела (мкАТ).
В настоящее время в России зарегистрировано 4 препарата класса блокаторов иммунных контрольных точек: ипилимумаб, ниволумаб, пембролизумаб и атезолизумаб. Первым, одобренным для использования в клинической практике, стал препарат ипилимумаб. Он представляет собой мкАТ, нацеленно блокирующий CTLA-4. Ниволумаб и пембролизумаб в свою очередь являются мкАТ, которые ингибируют PD-1, а атезолизумаб – PD-L1. В табл. 1 приведен список наиболее важных блокаторов иммунных контрольных точек, многие из которых, возможно, будут одобрены для использования в России в ближайшем будущем.

Все препараты данного класса обычно применяются в режиме, состоящем из нескольких доз, вводимых в течение нескольких месяцев. Ипилимумаб назначают курсом в 4 дозы каждые 3 недели, а ниволумаб – каждые 2 недели до прогрессирования заболевания или возникновения непереносимости препарата пациентом [6, 7]. Пембролизумаб и атезолизумаб назначают также до прогрессирования заболевания или возникновения непереносимости, но с частотой в 3 недели [8, 9].
Ипилимумаб был первым иммунотерапевтическим препаратом, который продемонстрировал улучшение показателей общей выживаемости (ОВ) у пациентов с метастатической меланомой. В рандомизированном контролируемом исследовании III фазы, сравнивавшем эффективность ипилимумаба со стандартной химиотерапевтической схемой для лечения пациентов с метастатической меланомой, стандартное лечение приводило к ОВ в 6,4 месяца и 2-летней выживаемости в 13,7%. Лечение с помощью ипилимумаба повысило ОВ до 10,1 месяца и 2-летнюю выживаемость до 23,5% [10], что было воспринято как настоящий прорыв в онкологии. Последующие за этим многочисленные клинические исследования ипилимумаба и других ингибиторов иммунных контрольных точек показали значительную противоопухолевую активность данных препаратов.
Cовременные тенденции в области иммунотерапии направлены на все более широкое использование комбинированных схем терапии, которые включают несколько препаратов класса блокаторов иммунных контрольных точек или сочетание иммунотерапии с таргетной терапией [11–13].
В недавнем клиническом исследовании показано, что лечение пациентов с меланомой IV стадии комбинацией ипилимумаба и ниволумаба или монотерапией ниволумабом привело к более высоким показателям выживаемости без прогрессирования по сравнению с монотерапией ипилимумабом. При этом 3-летняя выживаемость в группе пациентов, получавших комбинированную терапию, была намного выше, чем в группе, получавшей монотерапию ниволумабом [14]. Сегодня также ведутся клинические испытания совершенно новых ингибиторов иммунных контрольных точек, направленных на другие молекулы, такие как LAG-3, TIM-3, GITR и OX40 [15, 16]. Вполне вероятно, что в скором времени будет доступно намного больше агентов для применения при более широком разнообразии онкологических заболеваний и число терапевтических комбинаций также увеличится.
В связи с высоким терапевтическим потенциалом и широкой известностью с каждым годом увеличивается число пациентов, получающих иммунотерапию. Однако, несмотря на действительно впечатляющие показатели увеличения продолжительности жизни пациентов, эти препараты обладают широким профилем побочных эффектов, который значительно отличается от такового химиотерапии и может затрагивать любую систему органов. В связи с этим очень важно, чтобы о побочных эффектах иммунотерапии и методах их коррекции были осведомлены не только онкологи, но и врачи других специальностей, особенно врачи первичного звена, которые чаще всего встречаются с тяжелыми состояниями, требующими немедленного вмешательства. Это поможет обеспечить раннее выявление и лечение иммуноопосредованных (иНЯ), что имеет решающее значение для уменьшения их степени тяжести и продолжительности [17, 18]. При надлежащем и своевременно оказанном лечении можно помочь от 85 до 100% пациентов с иНЯ 3-й и 4-й степеней тяжести, которые являются смертельно опасными состояниями. При сборе анамнеза у онкологических пациентов, обратившихся за срочной медицинской помощью, необходимо уточнить о предыдущей терапии блокаторами иммунных контрольных точек (желательно, перечислив коммерческие названия препаратов) и о возможном участии пациента в клиническом исследовании. При положительном ответе пациента или возникновении сомнений у врача и при невозможности объяснить симптомы другими нозологиями следующим этапом должна быть попытка установить связь с лечащим врачом – онкологом пациента.
Общие данные о побочных эффектах иммунотерапии
Использование ингибиторов иммунных контрольных точек приводит к токсическим явлениям, известным как иНЯ, которые являются результатом усиления неспецифической активности иммунной системы. Эти побочные эффекты могут возникать в любой системе органов, однако чаще всего вовлекают кожу, желудочно-кишечный тракт (ЖКТ), эндокринную и дыхательную системы. Наиболее известные проявления иНЯ суммированы в табл. 2.

Проявления НЯ, вовлекающих другие системы органов, встречаются значительно реже, и такие пациенты редко требуют немедленного лечения. Тем не менее могут поражаться печень, почки, глаза, нервная, сердечно-сосудистая и кровеносная системы [19–21]. Профиль побочных эффектов примерно одинаков для всех препаратов класса ингибиторов иммунных контрольных точек. Однако известно, что применение ингибиторов CTLA-4 ассоциировано с большей частотой НЯ по сравнению с применением ингибиторов PD-1, а комбинированная терапия приводит к значительно большей степени тяжести и частоты иНЯ, чем монотерапия [10]. Побочные эффекты иммунотерапии могут возникать в любое время от начала лечения: в самом раннем периоде (дни), во время продолжения лечения (недели и месяцы) или после прекращения терапии (годы) [17]. Например, при применении ниволумаба 85% побочных эффектов начинаются в течение первых 16 недель терапии, однако также могут наблюдаться более чем через год после начала лечения [18, 22, 23]. Это контрастирует с химиотерапией, при применении которой время возникновения побочных эффектов более предсказуемо. Например, осложнения, связанные с нейтропенией, индуцированной химиотерапией, чаще всего происходят в течение первого цикла химиотерапии [24].
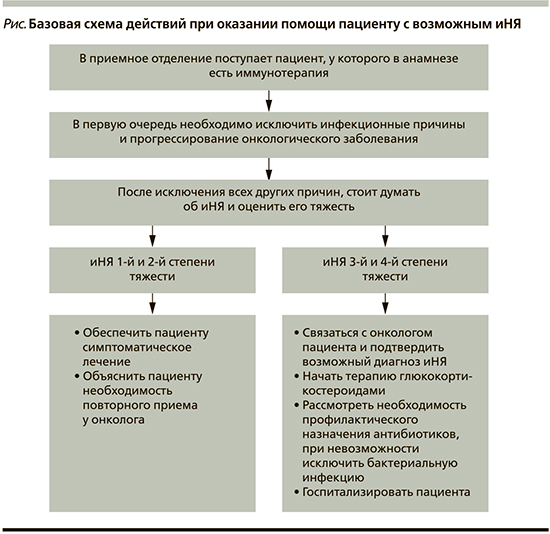
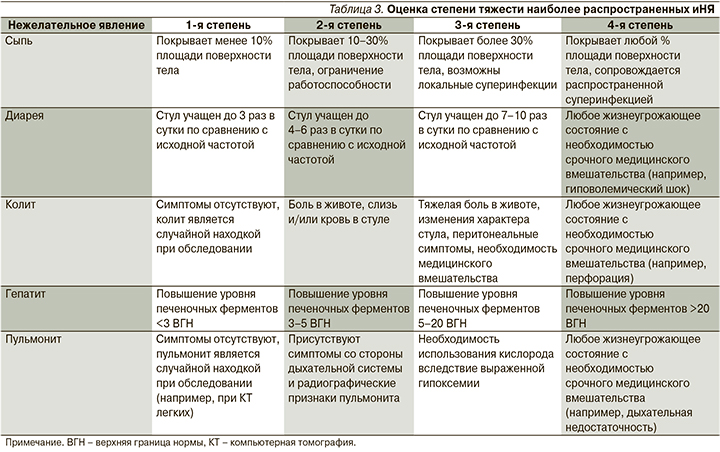
На рисунке представлена базовая схема действий при оказании помощи пациентам, получающим или получавшим терапию ингибиторами иммунных контрольных точек и обратившимся за срочной медицинской помощью. Если лечащий врач-онколог подтверждает наличие у пациента в анамнезе иммунотерапии и при этом исключаются другие причины, то далее необходимо в первую очередь определить степень тяжести иНЯ. Имеются опубликованные рекомендации и руководства, в которых излагаются принципы оказания помощи пациентам с иНЯ [25], однако они в основном ориентированы на онкологов и не оптимизированы для специалистов первичного звена. Тем не менее эти рекомендации служат наилучшим ориентиром как для оценки тяжести иНЯ, так и для выбора дальнейшей терапии. Здесь мы приводим лишь упрощенную таблицу оценки степени тяжести наиболее распространенных побочных эффектов (табл. 3).
Основным методом лечения, применяемым при коррекции иНЯ, является системное введение глюкокортикостероидов (ГКС). В менее тяжелых случаях может использоваться симптоматическое лечение, а в более тяжелых случаях, резистентных к ГКС, можно рассматривать применение других иммуносупрессантов, таких как инфликсимаб или микофенолата мофетил [25, 26]. Несмотря на существование теоретических опасений, будто использование ГКС может снижать эффективность иммунотерапии путем снижения иммунного ответа против опухолевых клеток, клинические исследования не подтверждают существования подобного эффекта [18, 27–30]. Перед лечением пациента с иНЯ очень важно исключить инфекционные заболевания и прогрессирование основного онкологического заболевания, поскольку применение ГКС в данных случаях может ухудшить состояние. Тем не менее даже в отсутствие возможности исключить инфекционную патологию, применение ГКС совместно с профилактической антибиотикотерапией является оправданным методом лечения при высокой вероятности наличия иНЯ. Кроме того, важно помнить, что при назначении курса ГКС длительностью более месяца и в дозах, эквивалентных 20 мг преднизолона в сутки, обязательно нужно также назначать пациенту препараты триметоприм-сульфаметаксозала для профилактики пневмоцистной пневмонии.
Органоспецифичные иНЯ
Кожа. Поражения кожи являются наиболее распространенными и рано возникающими иНЯ у пациентов, получающих терапию блокаторами иммунных контрольных точек [19, 31], и наблюдаются у 62% пациентов на комбинированной терапии ниволумабом и ипилимумабом, 56% пациентов на монотерапии ипилимумабом и 46% пациентов на монотерапии ниволумабом [14]. Проявлениями кожной токсичности могут быть постоянный зуд, макулопапулезная сыпь, синдром Свитта или витилиго [31, 32]. В редких случаях могут возникать более серьезные и потенциально смертельные побочные эффекты, такие как, например синдром Стивенса–Джонсона или токсический эпидермальный некролиз. Считается, что в случае возникновения этих серьезных осложнений иммунотерапия должна быть прекращена на постоянной основе [31].
В большинстве случаев поражения кожи возникают в виде сыпи 1–2-й степеней тяжести, и обычно такие пациенты не обращаются за неотложной помощью. В случае их поступления в приемные отделения этим пациентам рекомендуется продолжить терапию блокаторами иммунных контрольных точек и использовать местные препараты ГКС (например, бетаметазона крем 0,1%) и пероральные антигистаминные препараты по мере необходимости. Очень важно объяснить пациенту, что в случае ухудшения симптомов или их сохранения в течение более двух недель после лечения следует обязательно обратиться к онкологу за дальнейшей консультацией [33]. Приблизительно у 6% пациентов на комбинированной терапии, 3% пациентов на монотерапии ипилимумабом и 2% пациентов на монотерапии ниволумабом проявляются поражения кожи 3–4-й степеней тяжести [14]. При возникновении подобных побочных эффектов следует прекратить иммунотерапию и незамедлительно начать внутривенное введение преднизолона 1–2 мг/кг/сут (или перорально в эквивалентном количестве). В зависимости от тяжести состояния пациента следует госпитализировать и обязательно назначить консультацию дерматолога. Также необходим повторный прием онколога для контроля постепенного снижения количества используемых ГКС и решения вопроса о возобновлении лечения иммунотерапевтическими препаратами [25, 34–35].
ЖКТ. Значимыми и наиболее распространенными побочными эффектами, возникающими со стороны ЖКТ в результате иммунотерапии, являются диарея и гастроэнтероколит, которые чаще встречаются при комбинированной терапии и реже при монотерапии ингибиторами PD-1. В одном из исследований было выявлено, что диарея встречается примерно у 45% пациентов на комбинированной терапии, 34% пациентов – на монотерапии ипилимумабом и 21% пациентов – на монотерапии ниволумабом. В отличие от диареи колиты встречаются намного реже: приблизительно у 11–13% пациентов на комбинированной терапии и на монотерапии ипилимумабом и 2% пациентов на монотерапии ниволумабом [14]. Более редким побочным эффектом со стороны ЖКТ является вторичная перфорация кишечника. Такое состояние наблюдается менее чем у 1% пациентов, но является потенциально опасным для жизни [33, 30]. Важно учитывать и включать в дифференциальный диагноз другие причины желудочно-кишечных поражений у пациентов, получающих терапию ингибиторами иммунных контрольных точек, такие как инфекционные заболевания (например, диарея, вызванная Clostridioides difficile) или прогрессирование основного заболевания. Одним из наиболее важных диагностических тестов в данном случае является колоноскопия, позволяющая выявлять признаки колита.
При диарее 1-й степени тяжести (стул до 4 раз в сутки) необходимо назначить пациенту обильное питье и препараты, снижающие моторную активность ЖКТ. Диарею или колит 2-й степени тяжести также можно лечить симптоматически, но при этом необходимо прекратить иммунотерапию до тех пор, пока симптомы не улучшатся до 1-й степени тяжести. Пациентам следует посоветовать обратиться к лечащему врачу-онкологу, если симптомы иНЯ 2-й степени тяжести сохраняются в течение 5–7 дней после симптоматического лечения, поскольку в данном случае может быть показано назначение ГКС. Если пациент страдает от диареи или колита 3–4-й степеней тяжести, необходимо срочно прекратить иммунотерапию и назначить преднизолон 1–2 мг/кг/сут внутривенно (или эквивалентное количество перорально). Следует также рассмотреть необходимость назначения антисептиков и антибиотиков (например, сульфасалазин и ципрофлоксацин) для профилактического лечения оппортунистических инфекций, которые могут возникать при применении ГКС. Пациенты должны повторно обратиться к онкологу, чтобы определить необходимость снижения дозы ГКС или рассмотреть вопрос о добавлении инфликсимаба к режиму лечения в случае, если симптомы не поддаются терапии ГКС [36, 37].
Печень. Наиболее часто поражения печени проявляются в виде бессимптомного повышения уровней аспартат-(АСТ) и аланинаминотрансферазы (АЛТ), но иногда у пациентов также может быть лихорадка. Редко может наблюдаться повышение уровня общего билирубина [33]. Чаше всего поражение печени наблюдается при комбинированной терапии (до 20%) или при терапии ипилимумабом (до 10%) [38, 39]. Применение ингибиторов PD-1(L1) ассоциировано со значительно меньшей частотой иНЯ со стороны печени (до 5%) [40]. Наиболее часто эти осложнения возникают через 8–12 недель после начала лечения, однако также были описаны случаи очень раннего или значительно отсроченного момента возникновения [33]. Обычно повышение уровней печеночных ферментов является единственным признаком воспаления печени, при этом отсутствуют какие-либо радиографические признаки. Тем не менее иногда КТ может выявлять незначительную гепатомегалию или признаки перипортального отека [41]. Согласно существующим рекомендациям, уровни АЛТ, АСТ и общего билирубина должны определяться перед каждым введением ипилимумаба. При обнаружении повышенных уровней печеночных ферментов и исключении других возможных причин этих изменений необходимо назначать ГКС курсом как минимум на 3 недели [42]. Необходимо помнить, что при поражениях печени противопоказано применение инфликсимаба, т.к. этот препарат сам является гепатотоксичным.
Легкие. Осложнения со стороны дыхательной системы в виде пульмонитов являются одними из основных и наиболее серьезных побочных эффектов иммунотерапии, поскольку могут приводить к летальному исходу в течение короткого промежутка времени. Более того, эти осложнения встречаются чаще при монотерапии ингибиторами PD-1(L1) или при комбинированной терапии, чем при монотерапии ингибиторами CTLA-4 [32]. Этот факт повышает значимость пульмонитов в еще большей степени, поскольку ингибиторы PD-1(L1) на сегодняшний день являются наиболее распространенными иммунотерапевтическими препаратами, показания к назначению которых увеличиваются с каждым годом. Согласно данным клинических исследований и мета-анализов с участием пациентов с раком легкого, меланомой и почечно-клеточным раком, пульмониты встречаются у 2,7–3,5% пациентов при терапии ингибиторами PD-1 [20, 43–46]. В связи с широким распространением данного класса препаратов в последние годы стали появляться публикации с новыми данными, в которых отмечается бóльшая частота осложнений со стороны дыхательной системы. Так, в исследовании, включившем 205 пациентов с немелкоклеточным раком легких (НМКРЛ), получавших терапию анти-PD-1(L1), была выявлена частота пульмонитов, достигающая 19% [47]. Эти данные вызывают значительную тревогу в связи с тем, что пульмонит является наиболее распространенным побочным эффектом, ведущим к прекращению терапии [45] из-за тяжести, а также одним из наиболее смертельно опасных. Кроме вида препаратов на вероятность возникновения пульмонита могут влиять тип опухоли и наличие в анамнезе пациента курения, хронических заболеваний дыхательной системы или предыдущей противоопухолевой терапии. Частота возникновения – наиболее высокая среди пациентов с НМКРЛ и наименьшая среди пациентов с меланомой. Пульмонит может возникнуть в любое время от начала лечения, в литературе описаны случаи развития пульмонита от 9 дней до 19,2 месяца [48]), но чаще проявляет себя в течение первых 12 недель.
Пациенты, получающие или получавшие терапию ингибиторами иммунных контрольных точек и поступившие с новыми симптомами со стороны дыхательной системы, включая кашель, гипоксемию, или одышку, должны быть обязательно обследованы с помощью КТ грудной клетки, поскольку данный метод является наиболее информативным для оценки наличия пульмонита [19]. Тем не менее не существует какого-либо одного паттерна изменений на КТ, характерного для пульмонита. Чаще всего он проявляет себя в виде картины криптогенной организующейся пневмонии, интерстициальной пневмонии или изменений по типу «матового стекла» [48]. Поскольку диагностика очень часто бывает значительно затруднена, в первую очередь необходимо приложить все усилия для исключения инфекционной природы заболевания. Часто возникает необходимость проведения бронхоскопии с забором бронхоальвеолярного лаважа или биопсией, которая позволяет исключить многие инфекционные процессы.
Если исключить инфекционную этиологию невозможно даже после проведения всех основных исследований и при этом существует значительный риск пульмонита, стоит рассмотреть необходимость назначения комбинированной терапии антибиотиками и ГКС.
У пациентов с пульмонитом 2-й степени тяжести необходимо прекратить иммунотерапию и начать вводить внутривенно 1 мг/кг/сут преднизолона (или эквивалентное количество перорально), а также назначить консультацию пульмонолога и инфекциониста. В зависимости от тяжести симптомов следует рассмотреть вопрос о госпитализации пациента. Этим пациентам следует объяснить необходимость обращения к лечащему врачу-онкологу для коррекции дозы ГКС и рассмотрения вопроса о возобновлении иммунотерапии. Пациенты с пульмонитом 3–4-й степеней тяжести обязательно должны быть госпитализированы и получать до 2–4 мг/кг/сут преднизолона внутривенно (или эквивалентное количество другого ГКС). Обычно терапия ГКС длится не менее 2–3 месяцев, и в данных случаях обязательно показана профилактика пневмоцистной пневмонии на весь период лечения. Этим пациентам также может потребоваться назначение профилактических антибиотиков, проведение бронхоскопии и биопсии легких [30, 36].
Эндокринная система. При обращении пациента, получающего терапию ингибиторами иммунных контрольных точек, с неспецифическими жалобами важно помнить о потенциальной возможности поражения эндокринной системы иммунного генеза. Эти иНЯ являются одними из наиболее трудных при диагностике, поскольку симптомы, связанные с эндокринными поражениями (например, усталость, головная боль и тошнота) могут также быть характерными для основного злокачественного заболевания пациента и расцениваться как его проявление [20, 31, 49]. Наиболее часто встречающимися побочными эффектами со стороны эндокринной системы являются гипотиреоз, гипертиреоз или гипофизит, которые наблюдаются у 17%, 11 и 7% пациентов на комбинированной терапии, 11%, 4 и 1% пациентов на монотерапии ниволумабом и 5%, 1 и 4% пациентов на монотерапии ипилимумабом соответственно [14]. Наиболее распространенными симптомами, связанными с гипофизитом, являются головная боль, усталость и артралгии; также пониженный уровень гипофизарных гормонов. Другие эндокринопатии, связанные с применением ингибиторов иммунных контрольных точек, включают тиреоидит, болезнь Грейвса, тиреотоксикоз, сахарный диабет и надпочечниковую недостаточность [20, 50–52]. Надпочечниковая недостаточность является самым серьезным и опасным для жизни эндокринным побочным эффектом иммунотерапии и требует незамедлительного лечения с помощью системных ГКС [19]. Данное состояние может развиться вторично при поражениях гипофиза или первично при поражении самих надпочечников [53].
В отличие от иНЯ, вовлекающих другие системы органов, которые обычно полностью разрешаются после проведения соответствующей терапии, эндокринные побочные эффекты часто требуют постоянной заместительной гормональной терапии [20]. При подозрении на поражения эндокринных органов и исключении всех потенциальных неиммунологических причин необходимы проведение консультации эндокринолога, определение уровней основных гипофизарных гормонов и визуализация гипофиза. У пациентов с симптоматическими эндокринными нарушениями с отклонениями лабораторных показателей или обнаружением нарушений при визуализации гипофиза необходимо срочно прекратить иммунотерапию и назначить пациенту 1–2 мг/кг/сут преднизолона внутривенно (или эквивалентное количество перорально), а также любую дополнительно необходимую гормональную терапию.
В зависимости от тяжести симптомов следует рассмотреть необходимость госпитализации пациента. Если у пациента наблюдается гипотензия, сильное обезвоживание или развивается шок, а также при любом другом подозрении на надпочечниковую недостаточность, следует отменить иммунотерапию и незамедлительно назначить внутривенные растворы кристаллоидов и необходимую дозу ГКС (с минералокортикоидной активностью). Перед тем как начать лечение по поводу надпочечниковой недостаточности, необходимо исключить сепсис как возможную причину этих симптомов [30].
Заключение
Увеличение частоты использования иммунотерапевтических препаратов приводит к повышению числа пациентов, обращающихся за медицинской помощью из-за иммуноопосредованных побочных эффектов. Наиболее распространенными и серьезными являются поражения кожи, ЖКТ, эндокринной и дыхательной систем, однако побочные эффекты блокаторов иммунных контрольных точек могут проявляться в любой системе органов. Одним из ключевых факторов, влияющих на своевременность и успешность лечения этих иНЯ, является налаженное взаимодействие между пациентом, его лечащим врачом-онкологом и специалистом, к которому в настоящий момент обратился пациент. Очень важно, чтобы врачи любой специальности помнили о необходимости включения в дифференциальный диагноз различных видов иНЯ при поступлении онкологических пациентов, получающих терапию ингибиторами иммунных контрольных точек, и при возникновении сомнений всегда связывались с онкологом, который назначил иммунотерапию.
Такой подход позволяет минимизировать риски, связанные с врачебными ошибками, и приводит к своевременному назначению необходимой терапии.


