Введение
Колоректальный рак (КРР) – третье наиболее распространенное онкологическое заболевание в мире: около 1 млн новых случаев и более 500 тыс. смертей в год, при этом отмечается прирост заболеваемости [1, 2]. Проведение хирургического лечения возможно на ранних стадиях рака толстой кишки. Но, несмотря на совершенствование хирургического лечения и адъювантную химиотерапию (ХТ), частота встречаемости рецидивов и отдаленных метастазов составляет 22% пациентов II/III стадий [3]. За последние годы лечение метастатического КРР (мКРР) достигло значительных успехов, главным образом за счет эффективности ХТ, увеличения частоты хирургических вмешательств [4] и, конечно, использования таргетных агентов [5, 6]. По данным зарубежной литературы, более 35% пациентов при установлении диагноза КРР имеют отдаленные проявления болезни (IV ст.), при этом чаще всего вовлекается печень. Более чем у 75% пациентов [7] метастазы в печень неоперабельные. Это обусловлено наличием внепеченочной патологии, вовлечением нерезектабельных структур (т.е. всех вен печени) или недостаточным объемом здоровой ткани печени. Пятилетняя общая выживаемость (ОВ) пациентов данной когорты составляет 5%.
В настоящее время совершенствование системной ХТ, развитие хирургической техники методов лечения, таких как радиочастотная аблация, существенно изменили подходы к лечению этих пациентов. ХТ значительно сокращает размеры метастазов, позволяет выполнять Р0-резекцию с ранее нерезектабельными метастазами в печени. В связи с этим прежние правила резектабельности были пересмотрены и число резектабельных опухолей выросло с 10–15 до 20–30%, а общая 5- и 10-летняя выживаемость составила примерно 33 и 23% соответственно. Перевод метастазов в печени в резектабельное состояние посредством ХТ позволяет добиваться излечения части пациентов с КРР. На сегодняшний день резектабельность – это новая конечная точка, сфокусированная на лечебном потенциале по сравнению с классическими конечными точками ответа (полный или частичный) или выживаемости без прогрессирования (ВБП), – важные, если целями служат сохранение качества и продление жизни пациентов.
В данном ретроспективном исследовании мы проанализировали реальную клиническую практику применения комбинации FOLIRINOX в отношении пациентов с нерезектабельными метастазами в печень. Стандартным режимом терапии являются дуплеты (FOLFOX, FOLFIRI), позволяющие добиваться R0/1-резекции у 30% больных. Режим FOLFIRINOX демонстрирует бóльшую частоту объективных ответов (ЧОО), но при этом сопряжен с большей токсичностью.
Методы
С мая 2017 по июнь 2018 г. 22 пациента (8 женщин, 14 мужчин) с первично выявленным мКРР, ранее не получавших лечения, проходили химиотерапевтическое лечение режимом FOLFIRINOX±бевацизумаб/цетуксимаб с неоадъювантной целью на базе Ташкентского городского филиала Республиканского специализированного научно-практического центра онкологии и радиологии (ТГФ РСНПМЦОиР).
Средний возраст составил 58 лет (до 50 лет – 6 пациентов; свыше 50 лет – 16 пациентов), для всех пациентов функциональный статус составил ECOG (Eastern Cooperative Oncology Group)-0-1.
Критерии включения: гистологически подтвержденная аденокарцинома ободочной и прямой кишки с нерезектабельными метастазами в печень, отсутствие химиотерапевтического лечения, ECOG-0-1-статус.
Критерии исключения: крупные операции в течение предыдущих 28 дней, тромбоз или кровотечение в течение предыдущих 6 месяцев, клинически значимые сердечно-сосудистые заболевания.
Критерии нерезактебельности метастазов в печень: невозможность выполнения R0-резекции, сохранения по меньшей мере двух смежных сегментов печени с сохранением сосудов и желчного дренажа от оставшихся сегментов.
Оценка опухолевого ответа в соответствии с критериями оценки ответа в критериях сóлидных опухолей (RECIST 1.1.) с помощью компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) выполнена после 4 курсов неоадъювантной ХТ (НАХТ). Лечение проведено до прогрессирования заболевания или неприемлемой токсичности в зависимости от того, что наступило раньше.
Медиана наблюдения рассчитывалась от момента начала лечения по июнь 2019 г., что составило 25 месяцев.
ВБП рассчитывали от даты начала терапии до даты прогрессирования заболевания (ВБП-1). Также большой интерес представлял анализ ВБП именно от даты проведения оперативного вмешательства (ВБП-2).
Из 22 пациентов ЧОО зарегистрирована у 13 (60%).
Пациентов лечили по схеме FOLFIRINOX, назначаемой каждые 14 дней, следующим образом: оксалиплатин (85 мг/м2 в течение 2 часов), иринотекан (180 мг/м2 в течение 90 минут), лейковорин – ЛВ (400 мг/м2 в течение 2 часов) и 5-фторурацил – 5-ФУ (болюс 400 мг/м2, затем 2400 мг/м2 в течение 46 часов)±бевацизумаб в дозе 5 мг/кг в 1-й день каждые 2 недели или цетуксимаб в начальной дозе 400 мг/м2 (первая инфузия) и все последующие инфузии в дозе 250 мг/м2 еженедельно или панитумумаб в дозе 6 мг/кг в 1-й день каждые 2 недели. Большинству пациентов назначали вторичное профилактическое лечение гранулоцитарными колониестимулирующими факторами (Г-КСФ).
Основные клинические и биологические характеристики пациентов, включенных в исследование, приведены в табл. 1.
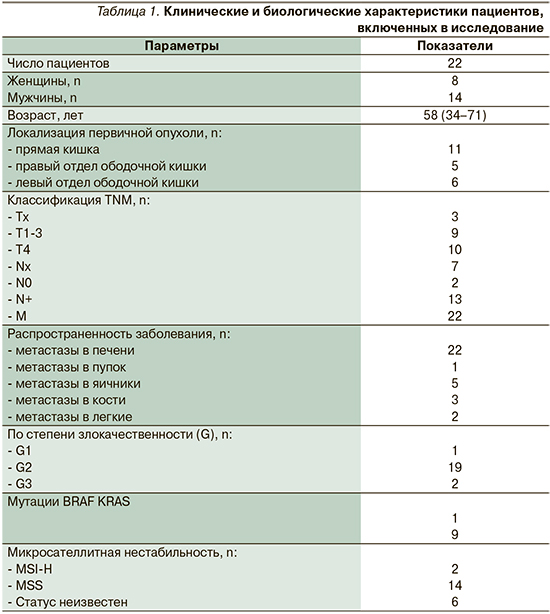
По локализации первичной опухоли у 11 пациентов наблюдалось поражение прямой кишки, у 11 – поражение ободочной кишки (у 5 опухоль расположена справа; у 6 – слева).
Все пациенты были с IV стадией заболевания. Из них Т-Тх – 3, Т1-3 – 9, Т4 – 10; N-Nx – 7, N0 – 3, N+ – 13 пациентов.
Метастатическое поражение было представлено преимущественно метастазами в печень – 22 пациента (у 12 из них были изолированные метастазы в печень). У 11 пациентов помимо печени были вовлечены следующие органы: пупок – 1 человек, яичники – 5, кости – 3, легкие – 2 пациента.
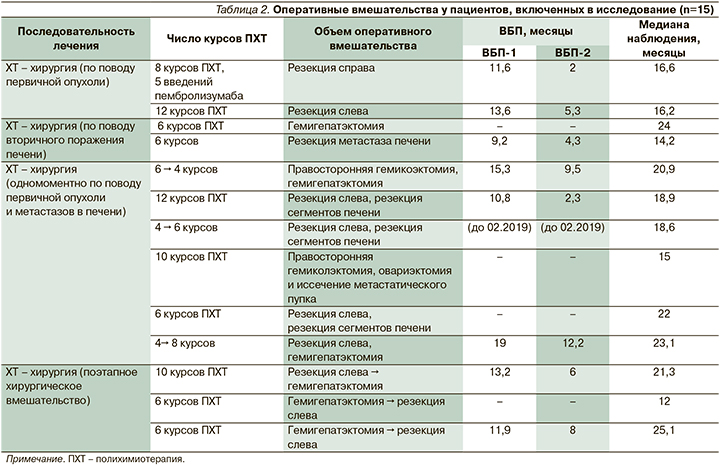
Все гистологические препараты были пересмотрены в ФГБУ НМИЦ онкологии им. Н.Н. Блохина Минздрава РФ. Сопутствующие заболевания: артериальная гипертензия – 9 больных; наличие сочетанной артериальной гипертензии и сахарного диабета – 2. Пациенты получали терапию антигипертензивными препаратами (β-адреноблокаторы и ингибиторы ангиотензинпревращающего фермента) и препаратами группы бигуанидов (метформин). Медиана числа курсов в неоадъювантном режиме для 22 пациентов составила 6 курсов FOLFIRINOX (у 10 из них – 12 курсов). Шести пациентам в адъювантной терапии проводили лечение фторпиримидинами, двоим – оксалиплатинсодержащими режимами ХТ и трем больным в послеоперационном периоде проведена адъювантная ХТ от 4 до 8 курсов в прежнем режиме. Таргетная терапия антиVEGFR (бевацизумабом) проводилась 7 пациентам; антиEGFR (цетуксимабом) – 3 и панитумумабом – 3 соответственно. Редукция препаратов на 25%, в частности оксалиплатина в связи с нарастающей полиневропатией отмечена у 14 пациентов, из которых у 6 редукция представлена до 3-го курса, у 2 и 3 пациентов на 4-м, 5-м курсах соответственно и по 1 больному на 7– 9-м курсах. Из 22 пациентов резектабельность была достигнута 13 пациентами после режима FOLFIRINOX. Двоим пациентам операции выполнены по поводу первичной опухоли, двоим – по поводу метастазов в печень, шести больным проведено одномоментное хирургическое вмешательство по поводу как первичной опухоли, так и метастазов в печень, трем пациентам выполнена поэтапность хирургического лечения (табл. 2).
Результаты
При подгрупповом анализе пациентов с раком толстой кишки с метастазами в печень после НАХТ в режиме FOLFIRINOX определяли ВБП-1, ВБП-2 и медиану наблюдения.
Операции по поводу первичной опухоли выполнены одной пациентке с множественным поражением печени, яичников и большого сальника в виде резекции справа после 8 курсов ПХТ и 5 введений пембролизумаба (MSI-H), края резекции чистые (R0), ВБП-1 и ВБП-2 составили 11,6 и 2 месяца соответственно. При этом прогрессирование наступило за счет роста метастатических очагов и появления очагов в легких. У 2 пациентов после 12 курсов ПХТ резекции нисходящего отдела кишечника, R0, ВБП-1 и ВБП-2 составили 13,6 и 5,3 месяца соответственно.
Операции по поводу метастазов в печень выполнены двум пациентам: у одного метастазы носили множественный характер, были диаметром до 6 см, опухоль располагалась слева. После проведения 6 курсов ПХТ выполнена R0-гемигепатэктомия, лечебный патоморфоз (ЛП) 3-й ст. Период наблюдения за пациентом составил 24 месяца.
Во втором случае выполнена резекция сóлидного метастаза в печени размером до 2,5 см после 6 курсов ПХТ. Прогрессирование наступило спустя 9,2 месяца за счет роста первичной опухоли. При этом от момента операции прогрессирование наступило через 4,3 месяца.
Большинству (6 больных) пациентов проведение НАХТ FOLFIRINOX позволило выполнить одномоментное хирургическое вмешательство по поводу как первичного очага, так и метастаза в печени, у одного из них метастаз был внепеченочным. Пациенту с множественными метастазами в печень до 6,2 см после 6 курсов ПХТ выполнены гемиколэктомия справа (ЛП 2-й ст.) и гемигепатэктомия, R0 с проведением 4 курсов ПХТ по прежней схеме в адъюванте. ВБП составила 15,3 месяца (прогрессирование по печени и появление очагов в легких). При этом от момента операции прогрессирование наступило через 9,5 месяца.
В другом случае после 12 курсов ПХТ выполнена резекция толстой кишки с одномоментной резекцией пораженных сегментов печени (ЛП 3-й ст.). ВБП-1 – 10,8 месяца (прогрессирование по печени), ВБП – 2–3 месяца соответственно. У пациента с солитарным метастазом в печени до 4 см и поражением яичников после 4 курсов выполнена резекция толстой кишки слева с сегментэктомией печени, края опухоли без особенностей, ЛП 3-й ст. Далее 6 курсов в адъювантном режиме. Установить состояние пациента с февраля 2019 г. не представляется возможным.
Интересная распространенность была у пациентки с канцераматозом и метастазами в яичники и пупок. После 10 курсов ПХТ выполнена гемиколэктомия, овариэктомия и иссечение метастатического пупка с чистыми краями резекции (ЛП 3-й ст., но при этом 3 лимфоузла из 23 остаются пораженными). Период наблюдения пациентки без проявлений болезни составил 15 месяцев.
Пациенту с множественным поражением печени до 4,7 см после 6 курсов ПХТ проведена резекция толстой кишки с сегментэктомией печени, края опухоли без особенностей, ЛП ¾-й ст. Пациент без проявлений болезни на протяжении 22 месяцев. Пациенту с множественным поражением печени и легких до 3/2 см после 4 курсов ПХТ проведена резекция толстой кишки слева и гемигепатэктомия (R0, ЛП 2-й ст.) с дальнейшим введением 8 курсов в адъюавантном режиме. ВБП – 19 месяцев (прогрессирование наступило за счет новых очагов в легких), при этом от момента операции прогрессирование наступило через 12,2 месяца.
Последовательность в выполнении хирургического лечения после НАХТ зарегистрирована у 3 больных. Пациенту с множественным поражением печени до 10 см по завершении 10 курсов ПХТ в неоадъювантном режиме выполнена резекция опухоли с последующей гемигепатэктомией спустя 2 месяца. ЛП 2-й ст. ВБП составила 13,2 месяца, прогрессирование наступило за счет метастазов в печень, при этом от момента операции прогрессирование наступило через 6 месяцев. Пациенту с множественным распространением по печени и легким после 6 курсов ПХТ с интервалом 3 недели выполнена гемигепатэктомия (ЛП 2-й ст.) и резекция опухоли слева. Период наблюдения пациента без проявлений болезни составил 12 месяцев. Для пациента с билобарными множественными метастазами до 16 см после 6 курсов ПХТ с последующей гемигепатэктомией (ЛП 2-й ст.) и резекцией опухоли спустя месяц (R0) ВБП составила 11,9 месяца, прогрессирование наступило за счет метастазов в печень, при этом от момента операции прогрессирование наступило через 8 месяцев. В связи с MSI-H-статусом пациенту предоставлена опция к иммунотерапии по месту жительства.
Кроме того, на первом этапе из 22 пациентов двоим было предоставлено хирургическое вмешательство по поводу первичной опухоли (табл. 3).

У пациентов с множественными очагами в печени до 5,6 и 7,7 см соответственно после выполнения определенного объема операции проведено 9 и 12 курсов ПХТ. ВБП-1 и ВБП-2 были следующими: 19,4 и 12,6; 19,7 и 13,2 месяца. Прогрессирование наступило за счет роста метастатических очагов в печени.
Семи больным (у 2 пациентов после 4 курсов, у 2 после 7 и 11 курсов и у 3 после 12 курсов) ХТ по схеме FOLFIRINOX проведена с паллиативной целью. Для 4 из них распространенность заболевания ограничилась множественными метастазами в печень (от 3 до 8,6 см в диаметре), при этом первичная опухоль преимущественно располагалась слева (3 из 4 пациентов). Данные по выживаемости у одного пациента отсутствуют, второй пациент умер, ВБП третьего составила 4,6 месяца, у 4 пациентов ВБП – 7,4 по печени, появились множественные метастазы в легких и костях, у 2 пациентов – в печени, костях, при этом в обоих случаях метастазы были множественными диаметром 4 см, а первичная опухоль располагалась слева (ВБП – 12,8 месяца за счет роста первичной опухоли, у одного их них метастазы были еще представлены в надпочечниках максимальным размером до 2,4 см); у 1 пациентки с расположением первичной опухоли справа поражены печень, яичники и забрюшинные лимфоузлы, метастазы диаметром до 12 см в обоих органах. ВБП – 11,8 месяца.
Медиана ВБП составляет 7,9 месяца. Согласно табл. 2, данные ВБП без прогрессирования демонстрируют наилучшие показатели в группе одномоментного удаления первичной опухоли и метастатического очага после проведения НАХТ. Из 6 пациентов треть все еще находится под наблюдением без проявлений болезни. Медиана наблюдения составила 19,7 месяца. Наихудшие данные по ВБП после операции зафиксированы в группе, где после НАХТ проведена операция по поводу первичной опухоли (2 больных) и после выполнения операции прогрессирование наступило через 3,6 месяца. Медиана наблюдения составила 16,4 месяца. В группе с выполнением оперативного вмешательства по поводу метастазов в печень после НАХТ (2 пациента) медиана наблюдения в 2 раза больше – 38,2 месяца. При этом при меньшем числе курсов НАХТ (12 против 6) 1 (50%) пациент все еще находится под динамическим наблюдением.
Интересно, что при сопоставлении данных о пациентах с одномоментным (6 пациентов) и последовательным (3 больных) хирургическим вмешательством по поводу как первичной опухоли, так и вторичных проявлений после НАХТ (медиана курсов – 6) , значимых отличий в ВБП после оперативного вмешательства (ВБП-2) и в медиане наблюдения не отмечено. ВБП-2 составила 8 месяцев против 7, медиана наблюдения – 19,7 и 19,4 месяца соответственно. Важно отметить, что в группе одномоментного выполнения хирургического этапа лечения по завершении неоадъюватного режима пациенты разделились на две группы – 5 и 9 курсов соответственно. При этом в группе с проведением большего числа курсов НАХТ у 2/3 пациентов (2 из 3 больных) прогрессирования после операции не выявлено, медиана наблюдения составила 18,6 месяца против 20,8. Из этого следует, что проведение большего числа курсов НАХТ (от 9 курсов) с проведением одномоментного оперативного вмешательства по поводу опухоли и метастазов в печень нуждается в дальнейшем исследовании на более крупной когорте пациентов. При рассмотрении группы с проведением хирургического вмешательства по поводу первичного очага с последующей ПХТ (2 человека) обнаружено, что результаты ВБП от даты операции обратно пропорциональны ее объему и курсам ПХТ. У пациента после гемиколэктомии с последующими 12 курсами ПХТ по сравнению с резекцией и 9 курсами разница в ВБП составляет более 6 месяцев (19,4 месяца против 12,6). Данные результаты дают право полагать, что ВБП от момента начала лечения (хирургия либо ХТ) не превышает 20 месяцев (19,4 месяца против 19,7). Тем не менее с учетом отсутствия представления о необходимом числе курсов НАХТ (9 или более) и с персонифицированным подходом к пациентам с мКРР вопрос взаимосвязи числа курсов ХТ и последовательности объема хирургического вмешательства по поводу опухоли и метастазов в печень все еще актуален и нуждается в крупных рандомизированных исследованиях.
Обсуждение
Согласно зарубежным источникам, хотя воздействие всех трех основных активных цитотоксических агентов одновременно дает лучший результат для неоперабельных пациентов с мКРР [8], лишь 50–80% пациентов могут подвергаться лечению трехкомпонентной схемой, что ограничивает в лечении метастатическую когорту пациентов за счет обширной распространенности процесса и статуса ECOG-2-3. Кроме того, по данным G. Folprecht, A. Grothey, у пациентов с КРР с метастазами в печень с увеличением активности ХТ в первой линии растет и вероятность проведения резекции метастазов, что также сказывается на показателе ОВ [9]. Исследования, посвященные изучению эффективности различных комбинаций, сравнительный анализ дуплетов и триплетов берут начало в начале 2000-х гг.
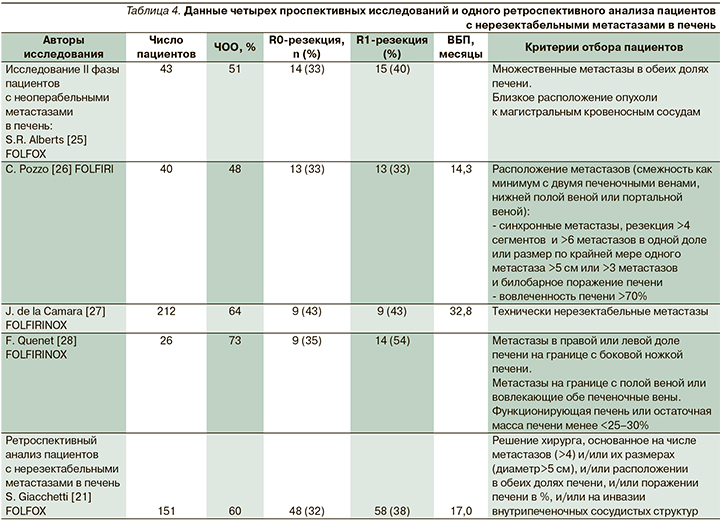
Так, например, в исследовании A. de Gramont, A. Figer добавление оксалиплатина по сравнению с группой 5-ФУ/ЛВ привело к более длительной ВБП (медиана – 9,0 месяца против 6,2; р=0,003) и лучшей ЧОО (50,7 против 22,3%; р=0,0001) [10]. В том же году J.Y. Douillard, D. Cunningham при исследовании 387 пациентов, ранее нелеченных по поводу мКРР, обнаружили, что ЧОО в группе с добавлением иринотекана по сравнению с группой 5-ФУ/ЛВ значительно выше (49 против 31%; p<0,001 для оцениваемых пациентов). ВБП составила 6,7 против 4,4 месяца (р<0,001), а ОВ – 17,4 против 14,1 месяца (р=0,031) соответственно. Позже, в 2004 г., американское рандомизированное исследование, включившее 795 пациентов при сравнении FOLFIRI/FOLFOX/IROX (иринотекан и оксалиплатин) у ранее нелеченных больных мКРР, выявило, что режим FOLFOX более активен и сравнительно безопасен (ВБП, ЧОО, ОВ – 6,9 месяца, 31%, 15 месяцев; 8,7 месяца, 45%, 19,5 месяца; 6,5 месяца, 35%, 17,4 месяца соответственно) [11]. Еще более многообещающие результаты при использовании триплетов поменяли эру ведения пациентов с мКРР. Например, в итальянском исследовании III фазы (FOLFIRI/FOLFIRINOX) у пациентов с мКРР ЧОО составила 41 и 66% соответственно (р=0.0002), 3-летняя ВБП – 11 против 24% (р=0,02) [12]. Объединенный анализ семи исследований III фазы продемонстрировал также, что у пациентов с местнораспространенным КРР медиана ОВ коррелирует с процентом пациентов, получавших три препарата в 1-й линии лечения (р=0,0008), но не с таковым пациентов, получавших какую-либо терапию во второй линии (р=0,19). Более того, использование триплета в 1-й линии связано со значительным улучшением медианы выживаемости – на 3,5 месяца (95% доверительный интервал [ДИ] – от 1,27 до 5,73 месяца; р=0,0083) [9]. Еще один мета-анализ показал, что в то время как инфузионный 5-ФУ [13] или комбинация 5-ФУ/ЛВ [14, 15] приводит к ЧОО<25% и медиане ОВ около 12 месяцев, ХТ, включившая инфузионное введение 5-ФУ/ЛВ, иринотекан и оксалиплатин (FOLFIRINOX), достигает уровня ответа ~50% с медианой ОВ, превысившей 20 месяцев [9, 12, 16–19]. Эти данные подтверждают, что использование более активных режимов в 1-й линии лечения мКРР коррелирует с улучшением показателей ВБП и ОВ [20]. Что же касается лечения мКРР с поражением печени, анализ ряда исследований с использованием трехкомпонентных режимов ПХТ показал [21, 22], что активная ХТ в 1-й линии первоначально неоперабельных пациентов может позволить выполнить радикальную резекцию метастатического очага, из них у 20–40% пациентов контроль заболевания сохраняется в течение длительного времени. В 1996 г. H. Bismuth et al. выполнили первую операцию по резекции нерезектабельных метастазов печени, техника которой со временем была немного видоизменена [23]. Согласно исследованиям H. Bismuth [23] и S. Giacchetti [21], опубликовавших первый крупный ретроспективный анализ лечения пациентов с КРР с метастазами в печень, ставших резектабельными по метастазам в печень после проведения НАХТ, судить о преимуществах 3-компонентной ПХТ не представлялось возможным. В исследование вошли более 150 пациентов, из которых 77 были с первоначально неоперабельными метастазами в печень, после НАХТ FOLFOX 58 (38%) пациентов достигли R0-резекции. Медиана безрецидивной выживаемости составила 17 месяцев, а 5-летняя ОВ после резекции наблюдалась не менее чем у половины пациентов (95% ДИ – 38–61%) [24]. После ученые начали анализировать комбинации дуплетов, но обнаружить значимой разницы в эффективности оксалиплатина и иринотекана не представилось возможным. Анализ ряда литературных работ показал, что в проспективных исследованиях II фазы с использованием FOLFOX [25] или FOLFIRI [26] ЧОО была равноценной (50%), при этом резекция метастазов в печени выполнена 33 и 40% больных соответственно. Данные четырех проспективных и одного ретроспективного анализов пациентов с нерезектабельными метастазами в печень представлены в табл. 4. После таких обнадеживающих результатов в начале 2000-х гг. исследователи начали изучать комбинацию с содержанием трех самых активных цитотоксических агентов. К примеру, в исследованиях J. de la Camara [27] и F. Quenet [28] при использовании триплета FOLFIRINOX у ранее нелеченных пациентов с мКРР зарегистрированы более высокие показатели ЧОО (64 и 73%), резекция метастазов в печени выполнена 43 и 54% пациентов соответственно.
Еще одно исследование A. Falcone, S. Ricci с НАХТ FOLFIRINOX позволило увеличить частоту радикальных резекций метастазов. Восемнадцати (15%) пациентам, получавшим лечение в неоадъювантном режиме, выполнена радикальная (R0) резекция (р=0,033). При этом частота R0-резекций метастазов составила 36 и 12% соответственно (р=0,017). Многофакторный анализ показал, что ПХТ в режиме FOLFIRINOX является независимым прогностическим фактором, влияющим на частоту достижения R0-резекций (95% ДИ – 1,2–7,9; р=0,018) [12]. Схожее исследование, проведенное G. Folprecht et al. [24], демонстрирует корреляцию между ЧОО на ХТ и частотой радикальных резекций метастазов после ХТ FOLFIRINOX у пациентов с изолированными метастазами в печени (r=0,96; p=0,002). Во французском исследовании A.D. Roth et al. с использованием трехкомпонентной комбинации ЧОО у пациентов с КРР с метастазами в печень достигала 79% [29].
Безусловно, сообщения об успешных резекциях у пациентов с изначально нерезектабельными метастазами в печени после системной ХТ впечатляющи. Ведь, согласно J. Scheele, R. Stang et al. [30], 5-летняя ОВ у пациентов с R0-резекцией метастазов КРР после НАХТ – 50% (95% ДИ – 33–68%) сопоставима с таковой у пациентов с первоначально резектабельными метастазами в печени (28–39%) [30–33].
На основании вышеизложенного можно предположить, что лечение FOLFIRINOX – единственный значимый независимый прогностический фактор в достижении объективного ответа и R0-резекции. Помимо усовершенствований в цитотоксической терапии изучение генетических мутаций и добавление тех или иных таргетных препаратов дополнили подход к персонифицированной терапии мКРР. Основываясь на результатах исследований II фазы, цетуксимаб увеличивает эффективность комбинаций на основе оксалиплатина [34] и иринотекана, что приводит к высокой частоте ответа в 1-й линии лечения. К примеру, 5/19 пациентов, получавших цетуксимаб в сочетании с FOLFIRI, стали кандидатами на проведение резекции метастазов, успешно выполненных четырем пациентам (пятый пациент отказался от операции). При этом ремиссия продолжалась до 3 лет [35]. Также известно, что цетуксимаб в монотерапии эффективен в отношении 10% пациентов с резистентным к иринотекану КРР [6, 36, 37] и 23% – в сочетании с иринотеканом соответственно [6, 40]. Согласно исследованиям I/II фаз, использование цетуксимаба в сочетании с иринотеканом или оксалиплатином и 5-ФУ/ЛВ в 1-й линии мКРР приводит к высоким показателям ЧОО – 43–81% [34, 39–41]. Бевацизумаб также способен усиливать действие ХТ, демонстрируя показатели частоты ответов 68,4–73,2% [51, 52]. В дополнение к воздействию бевацизумаба на ангиогенез происходит также усиленная доставка химиотерапевтических агентов в опухоль за счет снижения внутриопухолевого тканевого давления. Однако в крупном исследовании III фазы, где после НАХТ (бевацизумаб+FOLFIRI) выполнено хирургическое лечение по поводу вторичных проявлений болезни, у 5/59 пациентов зарегистрированы осложнения по типу послеоперационного кровотечения или нарушения заживления ран по сравнению с 0/29 пациентами, лечившимися только FOLFIRI [42]. Хотя это различие не было статистически значимым (р=0,12), дальнейшее исследование следует проводить с осторожностью. В связи с этим наблюдением и довольно длительным периодом полувыведения бевацизумаба в настоящее время рекомендуется выполнять операцию через 28 дней после введения данного препарата. Исследование H. Hurwitz, L. Fehrenbacher подтверждает эффективность бевацизумаба в сочетании с иринотеканом и 5-ФУ/ЛВ по сравнению с одним ЛВ. Медиана ВБП (10,6 против 6,2 месяца; р<0,001), ОВ (20,3 против 15,6 месяца; р<0,001). И хотя его влияние на ЧОО и было не таким очевидным, все же статистически значимым (45 против 35%; р=0,004) [5]. Одно из последних проспективных исследований M. Chaix, J. Vincent по изучению эффективности бевацизумаба в сочетании с режимом FOLFIRINOX для пациентов с химиорефрактерным мКРР доказало значимую эффективность данной комбинации даже в отношении пациентов после использования оксалиплатин- и иринотекан-содержащих схем. Медиана ВБП и OВ составила 5,8 и 11,9 месяца соответственно [43]. Данные показатели подтверждают, что отбор пациентов и эффективность предоперационной ХТ служат предиктором резектабельности метастазов в печени.
Критерии резектабельности метастазов печени при КРР
Еще в 1986 г. H. Ekberg et al. предложили несколько общих противопоказаний к резекции печени при метастазах КРР: 4 или больше очагов, наличие внепеченочного распространения, большой размер (более 5 см) метастазов и невозможность достигнуть негативного края резекции в 1 см. Впоследствии эти положения были подвергнуты критике с клинических и методологических позиций. Совершенствование системной ХТ и развитие дополнительных методов лечения, таких как радиочастотная аблация, существенно изменили подходы к лечению этих пациентов. В настоящее время ХТ позволяет переводить нерезектабельные метастазы в печени в резектабельные, в связи с чем прежние «правила резектабельности» были пересмотрены. В результате число резектабельных опухолей выросло с 10–15 до 20–30%, а общая 5- и 10-летняя выживаемость составила примерно 33 и 23% соответственно [44]. Резекция печени стала методом выбора при лечении пациентов с метастазом КРР в печени при наличии возможности ее выполнения. У пациентов, не подвергнутых хирургическому вмешательству, 5-летняя выживаемость составляет менее 10% [45]. В некоторых работах сообщалось, что важную роль в прогнозе заболевания играют размеры метастазов [32]. Другие авторы [46] не смогли продемонстрировать эту связь, обосновывая мнение тем, что размеры метастазов в печени не могут быть приняты в качестве критерия для отказа от оперативного лечения. Одним из наиболее важных факторов, определяющих ОВ после резекции печени по поводу изолированного метастаза КРР, является т.н. отрицательный хирургический край (R0-резекция) [47, 48]. Хирургическое вмешательство не показано, когда хирург считает достижение данного уровня резекции невозможным. В таких случаях должна рассматриваться возможность проведения ХТ, цель которой состоит в достижении клинического и инструментально подтвержденного ответа опухоли с дальнейшим рассмотрением вопроса о возможности и целесообразности хирургического лечения. Требует дальнейшего изучения и ряд других факторов, в частности: какой объем печени должен остаться после резекции (планируемый остаток здоровой печени), его функциональное состояние. Если пациент подвергся интенсивной ХТ или он страдает сопутствующим заболеванием печени, следует оценивать гистопатологию «планируемого остатка печени». Резекцию следует выполнять лишь при условии, что после операции сохранится по крайней мере 25–30% функциональной паренхимы печени, а при наличии сопутствующего заболевания печени или предшествовавшей ХТ объем остаточной функциональной паренхимы должен составлять 30–40% [49]. Кроме того, должны быть оставлены по меньшей мере два непораженных сегмента печени, в которых сохранились нормальный сосудистый приток и отток, а также желчный дренаж. Согласно современным публикациям, оценка прогностического значения клинико-патологических факторов определения «резектабельности» непоследовательная и противоречивая.
Исследования последних лет значительно изменили подход к его оценке, и в настоящее время резектабельность определяется по четырем основным критериям:
- Опухоль должна быть полностью резецирована. Резекции R0 как внутри-, так и внепеченочных метастазов должны быть выполнены.
- Существует возможность оставить по меньшей мере два смежных сегмента печени.
- Существует возможность сохранения сосудов и желчного дренажа от оставшихся сегментов.
- Объем печени, оставшейся после резекции, должен быть адекватным – обычно не менее 20% от общего объема печени для нормальной паренхимы, 30–60% при поражении печени в результате ХТ, стеатоза или гепатита или 40–70% при наличии цирроза печени в зависимости от степени дисфункции печени [50].
Заключение
Пациенты с раком толстой кишки и с метастазами в печень представляют собой большую гетерогенную популяцию, где одной из основных проблем все еще остается последовательность хирургического вмешательства. И хотя существующий с 2006 г. «liver first»-подход остается многообещающей стратегией, стандартизировать идеальную диагностически-терапевтическую схему мКРР все еще представляется сложным. Несмотря на ряд исследований, подтверждающих преимущество трехкомпонентной схемы в неоадъювантном режиме, данное наблюдение подтверждает необходимость дальнейшего изучения числа курсов НАХТ и планирования хирургического лечения.



