Универсальная роль фосфатидил-инозитол-3-киназы
За последние 20 лет было предпринято множество попыток создания эффективного и безопасного ингибитора фосфатидил-инозитол-3-киназы (PI3K). Однако комплексная и мультифункциональная роль PI3K в процессах жизнедеятельности клетки я стали причиной многих таких попыток и неудач.
Молекулярный каскад PI3K/Akt/mTOR представляет собой ключевую и универсальную систему, характерную для большинства клеток человека. PI3K/Akt/mTOR вовлечен в регуляцию основных процессов жизнедеятельности клетки, включая рост, пролиферацию и выживание [1]. На сегодняшний день результаты множества исследований данного сигнального пути являются PI3K, протеинкиназа B (Akt, англ. RAC-alpha serine/threonine-protein kinase, Protein kinase B alpha) и молекулярная мишень рапамицина млекопитающих (mTOR, англ. mammalian target of rapamycin).
Семейство фосфатидил-инозитол-3-киназ – один из важнейших регуляторных белков, находящихся на пересечении различных сигнальных путей и контролирующих ключевые функции клетки [3]. Обнаруженная у PI3K двойная ферментативная активность (липид- и протеинкиназная), а также способность активировать ряд сигнальных белков определяют принципиальное значение PI3K в регуляции таких функций клетки, как метаболизм, дифференцировка, миграция, рост, выживаемость, старение и онкогенная трансформация [4].
Строение и тканевая специфичность PI3K
Семейство PI3K представлено 3 классами (I, II и III), которые отличаются по структурной организации, субстратной специфичности и функциям в клетке. Причем среди всех классов класс I семейства PI3K играет важную роль в процессе онкогенной трансформации [4].
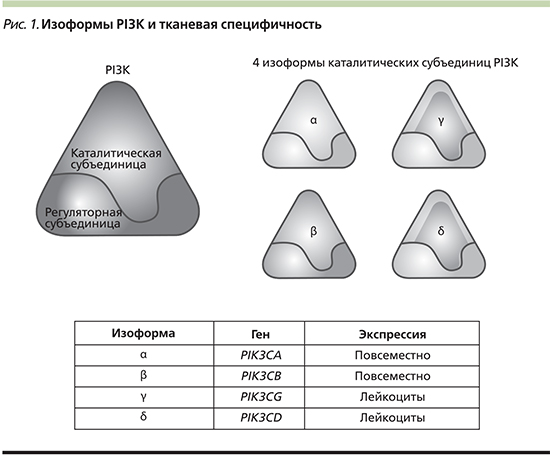
Молекула PI3K представляет собой гетеродимер и состоит из двух субъединиц: каталитической и регуляторной, каждая из которых кодируется разными генами (рис. 1). Молекула PI3K класса IA представлена комплексом из каталитической субъединицы р110 (изоформы р110α, р110β, р110γ, р110δ) и регуляторной субъединицы р85 (изоформы р85α, р55α, р50α), р85β и р55γ) и вовлечена непосредственно в канцерогенез [5]. Гомологичные субъединицы p110α, p110β и p110δ кодируются генами PIK3CA, PIK3CB и PI3KCD соответственно. Класс IB представлен геном PIK3CG, который кодирует каталитическую субъединицу p110γ [6]. Изоформы p110α и p110β экспрессируются во всех тканях организма, в то время как экспрессия p110δ и p110γ ограничена только гематопоэтическими и иммунными клетками [4].
Онкогенная активация PI3K-Akt-mTOR молекулярного каскада
Онкогенная активация сигнального каскада PI3K-Akt-mTOR наряду с патологическим функционированием MAPK-опосредованного пути считаются одними из самых частых нарушений, наблюдающихся на различных этапах канцерогенеза (рис. 2). Аномальная активация PI3K-Akt-mTOR может быть реализована минимум тремя независимыми путями. Во-первых, молекула PI3K воспринимает и опосредует множество внеклеточных сигналов, поступающих от активированных факторами ростами рецепторов на поверхности клетки (таких, как IGF-1, EGFR, HER2, VEGF, ALK, c-Met, c-Kit, PDGF, TGFα; рис. 2) [2, 7, 8–10]. При взаимодействии фактора роста с рецептором тирозинкиназы происходит димеризация последнего. Далее образуется комплекс димера с регуляторной субъединицей PI3K–р85, что служит триггером для активации каталитической субъединицы р110α, в дальнейшем – и всего сигнального каскада. При избыточном поступлении ростовых факторов или наличия активирующей мутации в генах, кодирующих рецепторы тирозинкиназ, происходит постоянная активация PI3K, а следовательно, и сигнального пути PI3K-Akt-mTOR (рис. 2).

Другой причиной патологического функционирования PI3K-Akt-mTOR является потеря активности или подавление экспрессии генов, кодирующих негативный регулятор молекулярного каскада, онкосупрессор, белок PTEN. Потеря функции PTEN часто коррелирует с конститутивной активацией молекулы mTOR, привнося свой вклад в развитие неоплазии [11].
Амплификация или мутация в гене PIK3CA, кодирующем α-изоформу каталитической субъединицы р110-PI3K, относится к одной из наиболее распространенных причин гиперактивации PI3K-опосредованного сигнального каскада [11]. Мутации гена PIK3CA (PIK3CA+) являются соматическими и встречаются с различной частотой во многих опухолях человека, включая РМЖ, рак простаты, колоректальный рак, рак матки, рак яичников, рак легкого, опухоли головы и шеи, лимфомы, рак поджелудочной железы, рак желудка, рак пищевода, рак щитовидной железы, рак печени и глиобластому [12, 13].
PIK3CA+ приводит к развитию процессов онкогенной трансформации, являясь причиной конститутивной стимуляции сигнального каскада PI3K–Akt–mTOR независимо от наличия факторов роста и активации рецепторов тирозинкиназ [6]. В ряде исследований доказано, что наличие PIK3CA+ ассоциировано с резистентностью к таргетной терапии, направленной на подавление функции рецепторов факторов роста (к терапии трастузумабом для HER2+-РМЖ и к анти-EGFR-терапии в лечении немелкоклеточного рака легкого с драйверными мутациями гена, кодирующего EGFR) [14–16]. По данным доклинических исследований установлено, что экспрессия PIK3CA+ в фибробластах и эпителиальных клетках молочной железы приводит к трансформации, неконтролируемой факторами роста пролиферации и резистентности к апоптозу [17, 18]. У трансгенных мышей, экспрессирующих PIK3CA+ с мутацией киназного домена р110α типа H1047R, развивалась аденокарцинома легкого [16]. Амплификация гена PIK3CA в большинстве случаев характерна для опухолей яичников. Однако ее роль в активации PI3K пока не установлена [6].
Мутация гена PIK3CA и потеря функции белка PTEN – одни из самых частых молекулярно-генетических изменений при различных биологических подтипах РМЖ
Мутация гена PIK3CA и потеря функции белка PTEN (PTEN-) – одни из самых частых молекулярно-генетических изменений при РМЖ, встречающихся во всех его подтипах с различной частотой (см. таблицу) [19].
Частота встречаемости PIK3CA+ и PTEN- составляет:
- для люминального А подтипа 49 и 13% соответственно;
- для люминального B 32 и 13% соответственно;
- для HER2-обогащенного (HER2E) 42 и 19% соответственно;
- и для базальноподобного 7 и 35% соответственно.
Высокая частота встречаемости мутаций гена PIK3CA при гормонозависимом РМЖ предполагает их доминирующую роль в процессе опухолевой дифференцировки люминальных подтипов [11].
Создание препаратов, направленных на ингибирование PI3K, строго обосновано знаниями молекулярно-генетических характеристик опухолей и является рациональным подходом к лечению онкологических пациентов в целом и особенно больных РМЖ.
В пользу экспансии мутированных клонов PIK3CA в процессах развития и малигнизации РМЖ свидетельствуют следующие факты:
- высокая частота встречаемости PIK3CA+ при распространенном РМЖ [11, 20];
- факт стимуляции патологической экспрессии PI3K в ответ на длительное применение ингибиторов CDK4/6 [21, 22];
- доказанная эффективность комбинации ингибитора PI3K и эндокринотерапии для преодоления резистентности к ингибиторам CDK4/6 по результатам преклинических исследований [22, 23].
Применение ингибиторов mTOR и CDK4/6 пациентами с PIK3CA+ РМЖ. Прогностическое и/или предиктивное значение мутации гена PIK3CA
Применение ингибиторов mTOR пациентами с PIK3CA+ РМЖ
Биологически направленная терапия, подавляющая действие центральных участников PI3K–Akt–mTOR-каскада привлекает внимание ученых уже много лет. Первым успешным препаратом стал ингибитор комплекса mTORC1 эверолимус.
Эверолимус одобрен FDA на основании регистрационного исследования BOLERO-2. В нем показана эффективность эверолимуса в комбинации с экземестаном для больных HR+- HER2-РМЖ в постменопаузе, получавших в адъювантном режиме нестероидные ингибиторы ароматазы [24].
В исследовании показано, что совместное ингибирование компенсаторного сигнального каскада при помощи эверолимуса удваивало медиану выживаемости без прогрессирования (ВБП) с 3,2 до 7,8 месяца (ОР=0,45; 95% ДИ – 0,38–0,54; p<0,0001) [24].
Наилучшие результаты были получены при применении комбинации эверолимуса с экземестаном в подгруппе пациентов, получавших I линию терапии метастатического заболевания: медиана ВБП составила 11,5 месяцев по сравнению с 4,1 в подгруппе без эверолимуса (ОР=0,39; 95% ДИ – 0,25–0,62; p<0,0001) [25].
Оценка вторичной цели исследования – общей выживаемости (ОВ) – показала численный, но статистически незначимый выигрыш при применении комбинации: 31 месяц по сравнению с 26,6 (ОР=0,89; 95% ДИ – 0,73–1,10; p=0,14) [26].
Биомаркерный анализ исследования BOLERO-2 обнаружил, что наибольшую пользу от терапии эверолимусом в сочетании с экземестаном получили пациенты эстроген-зависимого подтипа (ER+) с минимальными изменениями в генах PIK3CA/PTEN/CCND1 или FGFR1/2 [27].
В другом исследовании ретроспективно оценивали эффективность эверолимус-содержащей терапии по сравнению со стандартной терапией больных HR+-HER2-мРМЖ, рефрактерных к эндокринотерапии. В исследование включали больных с диагностированными мутациями в генах сигнального каскада PI3K–Akt–mTOR вне зависимости от линии лечения. Всего в исследование были включены 54,5% больных с HR+-РМЖ и 42,4% с HER2+-РМЖ. У 85% пациентов была определена мутация гена PIK3CA, а также наличие 2–4 параллельных мутаций в сигнальном пути PI3K–Akt–mTOR.
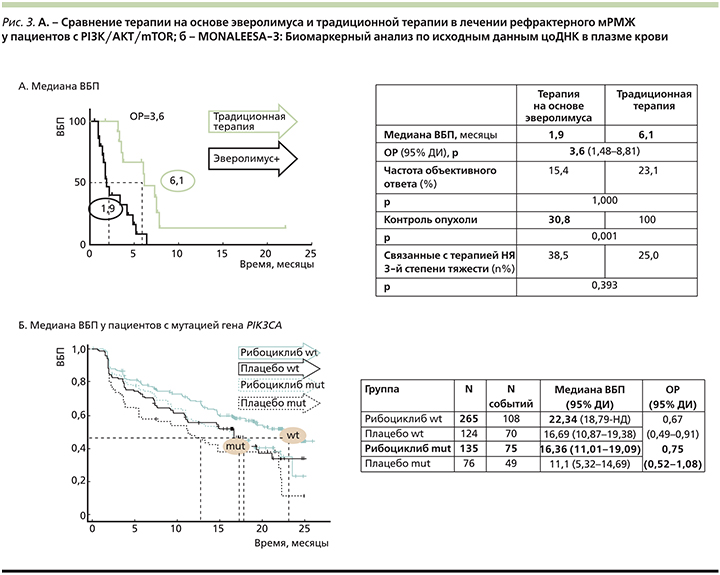
В результате показано, что при использовании эверолимуса вне зарегистрированных показаний (в целях направленного воздействия на каскад PI3K–Akt–mTOR) отмечена большая частота неблагоприятных исходов терапии пациентов с гормонорезистентным РМЖ. Медиана ВБП составила 1,9 месяца в группе эверолимус-содержащей терапии по сравнению с 6,1 месяца в группе традиционной терапии (ОР=3,6). Контроль над заболеванием совместно с более благоприятным профилем безопасности также был отмечен в группе больных, принимавших стандартные режимы терапии (рис. 3А) [28].
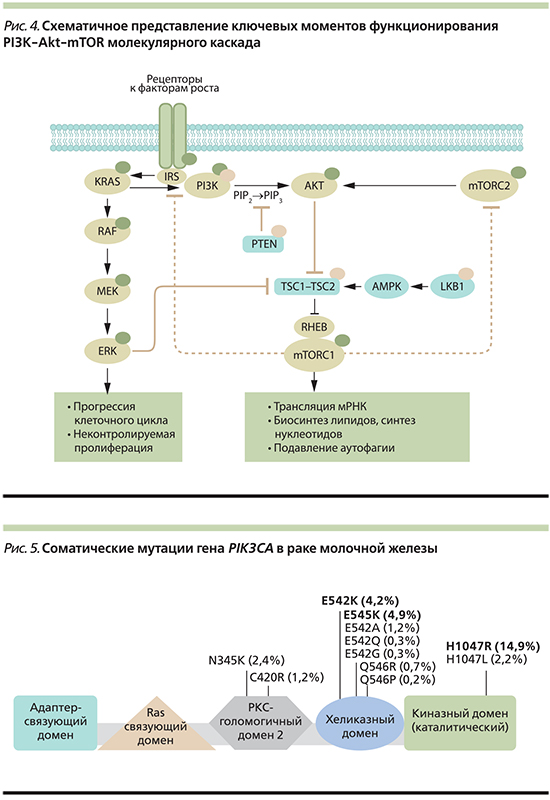
Кроме того, отмечено, что ингибирование комплекса mTORC1 нарушает mTORC1-S6K-опосредованную негативную регуляцию каскада PI3K–Akt–mTOR, что приводит к парадоксальной активации mTORC2, Akt1 и PI3K (рис. 4) [29].
Применение ингибиторов CDK4/6 пациентами с PIK3CA+-РМЖ
Применение другого класса препаратов, направленных на преодоление резистетности к эндокринотерапии (ингибиторы CDK4/6), показало преимущество комбинации рибоциклиба с фулвестрантом по сравнению с терапией фулвестрантом вне зависимости от наличия мутации в гене PIK3CA (рис. 3Б).
В регистрационном исследовании MONALEESA-3 135 больных HR+-HER2-мРМЖ, получавших терапию рибоциклибом в сочетании с фулвестрантом и имевших мутацию гена PIK3CA (35% больных), показали значимо более низкие результаты терапии по сравнению с пациентами без мутации. Медиана ВБП в группе больных с мутацией составила 16,36 месяца (на фоне 25%-ного снижения риска прогрессирования) по сравнению с 22,34 месяца в группе без мутации (на фоне 33%-ного снижения риска прогрессирования; рис. 3Б) [30].
В подгрупповом анализе рандомизированного исследования III фазы PALOMA-3 по изучению эффективности терапии комбинацией ингибитора CDK4/6 палбоциклиба с фулвестрантом пациентов с HR+-HER2-мРМЖ после предшествовавшей эндокринотерапии проспективно оценивали динамику изменений числа копий гена PIK3CA+ по циркулирующей опухолевой ДНК (цоДНК) [31].
Изменения анализировались по соотношению числа копий PIK3CA+/мл в цоДНК на 15-й день после начала приема палбоциклиба в сочетании с фулвестрантом к базовому уровню («отношение цоДНК»). В результате было установлено, что ранние изменения в копийности мутированного гена PIK3CA служат достоверным предиктором эффективности терапии. Если на 15-й день приема комбинации «соотношение цоДНК» сохранялось или оставалось высоким, то медиана ВБП в такой группе пациентов составляла 4,1 месяца [95% ДИ – 3,6–5,5]. При этом у пациентов с низкими показателями «соотношения цоДНК» медиана ВБП значимо возрастала до 11,2 месяца [95% ДИ – 11,1 не достигнут], ОР=4,92 (95% ДИ – 1,98–12,26; р=0.0002, q=0,007 [с-индекс]). Таким образом, динамика содержания PIK3CA+ в цоДНК, оцененная после 2 недель терапии «палбоциклиб+фулвестрант» служил предиктором отдаленных клинических результатов [31].
Определение мутации гена PIK3CA
Большинство мутаций гена PIK3CA локализованы в определенных областях экзонов 9 и 20 (рис. 5). Экзон 20 кодирует каталитический домен р110α, и мутации в этом домене гена PIK3CA могут прямо стимулировать конститутивную ферментативную активность PI3K. Экзон 9 кодирует хеликазный домен р110α, и мутация в этом домене подавляет ингибирующее взаимодействие N-концевого участка р85 с р110α. Часть более редких мутаций обнаружена в домене, кодирующем N-концевой участок р110α, взаимодействующий с р85. Такой тип мутаций усиливает липидную активность PI3K, но не влияет на образование комплекса р85α – р110α [6].
При РМЖ определен спектр наиболее характерных изменений в гене PIK3CA, определяющий патологическую активацию каскада PI3K–Akt–mTOR (рис. 6). Высокая частота миссенс-мутаций в 9-м и 20-м экзонах соответствует аминокислотам E542K и E545K в экзоне 9 хеликазного домена; в экзоне 20 киназного домена – H1047R и H1047L; наиболее частая мутация для люминального А-подтипа РМЖ – E545K (рис. 5) [32, 33].
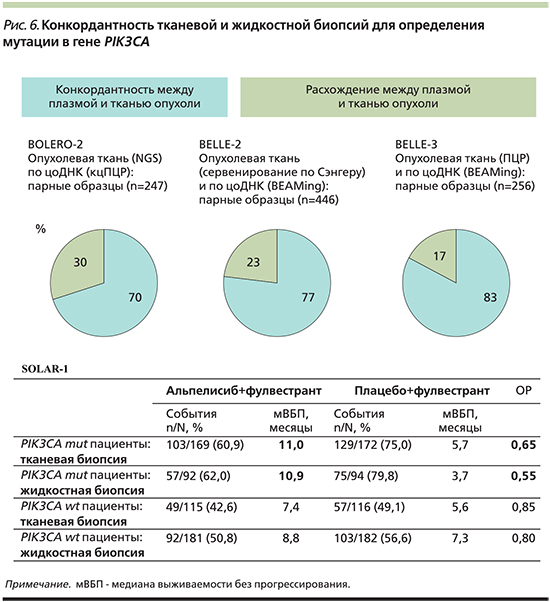
Конкордантность тканевой и жидкостной биопсий для определения мутации в гене PIK3CA
В рамках международных рандомизированных исследований проведен сравнительный анализ мутаций в гене PIK3CA из ДНК, полученной методами тканевой и жидкостной биопсий от больных распространенным HR+- HER2-РМЖ (рис. 6) [34–37].
В исследовании BOLERO-2 сравнивались 247 парных образцов ДНК, полученной из опухолевой ткани и циркулирующей опухолевой ДНК (рис. 6). Образцы ДНК анализировались методами секвенирования нового поколения (NGS, next generating sequencing) и капельно-цифровой ПЦР (кцПЦР). Более высокое соответствие частоты мутации гена PIK3CA наблюдалось в метастатических очагах (82%, n=49) [35].
В исследовании Belle-2 сравнивались 446 парных образцов ДНК, полученной из опухолевой ДНК и анализируемой секвенированием по методу Сэнгера и цоДНК, анализируемой методом BEAMing (высокочувствительный метод цифровой полимеразной цифровой реакцией; рис. 6) [34]. Этот анализ выявил возможность определения мутации не только по цоДНК (конкордантность – 77%), но и по материалам архивных гистологических блоков. Медиана давности блоков, использующихся для анализа, составила 3,8 года [34].
В исследовании Belle-3 сравнивались 256 парных образцов ДНК, полученной из опухолевой ДНК и анализируемой методом ПЦР, и цоДНК, анализируемой методом BEAMing (рис. 7) [36]. Соответствовали материалу, полученному из метастазов, 27% гистологических блоков. По результатам сравнения конкордантность между плазмой и тканью опухоли для определения мутации гена PIK3CA составила 83% [36].

В рамках исследования SOLAR-1 наблюдалось наиболее высокое сходство результатов терапии между образцами ДНК, выделенной из образцов опухолевой ткани, и образцами ДНК плазмы крови пациента (рис. 6) [37]. На момент включения в исследование необходимым условием помимо наличия гистологических блоков был забор плазмы крови у больных для последующего выделения цоДНК и ретроспективного анализа методом ПЦР. 22% гистологических блоков получены из метастатических очагов [37]. Во время оценки эффективности терапии проведено сопоставление результатов по показателю медианы ВБП и оценке рисков прогрессирования (рис. 6). На основании полученных данных была доказана клиническая обоснованность определения мутации в гене PIK3CA по циркулирующей опухолевой ДНК плазмы крови и сопоставимость с тканевой биопсией (рис. 6) [37].
Повторная биопсия в контексте планирования тактики терапии РМЖ
Метастазирование в отдаленные органы и ткани остается главной причиной фатальных исходов больных РМЖ [38].
Метастазирование представляет собой последовательность дискретных шагов, именуемую каскадом инвазии и метастазирования (invasion-metastasis cascade) [39].
Данный каскад отображает цепь цитологических изменений:
- местная инвазия;
- интравазация опухолевых клеток (проникновение в прилегающие кровеносные или лимфатические сосуды);
- передвижение опухолевых клеток через лимфатическую и гематогенную системы;
- переход клеток из просвета таких сосудов в паренхиму отдаленных тканей (экстравазация);
- формирование небольших узелков опухолевых клеток (микрометастазы);
- рост очагов микрометастатических поражений в макроскопические опухоли – «колонизация».
На различных этапах процесса метастазирования опухоль подвергается стрессу и приобретает определенные черты, отличные от первичного очага. Таким образом, знание молекулярно-генетических особенностей злокачественного новообразования каждого пациента на различных этапах канцерогенеза определяет точность прогноза заболевания и прямо коррелирует с планированием тактики терапии.
Исследование Aleskandarany et al. было посвящено разработке алгоритма оценки развития отдаленных метастазов у больных РМЖ [38]. Материалом для данной задачи стали первично-операбельные опухоли I–III стадий инвазивного РМЖ (n=1092). Панель иммуногистохимической верификации включала 31 биологически релевантный маркер для оценки процессов опухолевой трансформации и развития РМЖ.
Значимо высокие уровни экспрессии PIK3CA+ наряду с Ki67, HER2, p53, N-кадгерином и P-кадгерином строго коррелировали:
- с ранним развитием отдаленных метастазов в срок менее 1 года после оперативного вмешательства;
- от 1 до 2 лет после проведения адъювантных режимов терапии (p<0,001) [38].
В то же время повышенные уровни рецепторов эстрогенов и прогестерона, а также антиапоптотического белка BCL-2 были достоверно связаны с более поздними сроками прогрессирования больных РМЖ [38].
Рядом других работ была подтверждена неоспоримая роль мутации гена PIK3CA в стимулировании процессов эпителиально-мезенхимального перехода (ЭМП) на тканях больных РМЖ [40]. Мутации в генах PIK3CA и pAkt-S473 активируют сигнальный каскад PI3K–Akt–mTOR. Активация PI3K-Akt-mTOR приводит к изменению функции трансформирующего фактора роста TGF-1β. При этом TGF-1β утрачивает способность подавлять пролиферацию и активирует программу ЭМП, в результате чего опухоль приобретает класс высокой степени злокачественности и метастазирует [40, 41]. С другой стороны, нарастает уровень белка-репрессора клеточной адгезии (Twist2), что снижает концентрацию E-кадгерина и ослабляет межклеточные взаимодействия [42]. Снижение концентрации E-кадгерина усиливает экспрессию N-кадгерина. Последний стимулирует подвижность и метастазирование клеток РМЖ, а также дополнительно защищает раковые клетки от апоптоза, поддерживая активность PI3K [43, 44].
В другом исследовании, проведенном на биопсийном материале 473 опухолей РМЖ, выявлена корреляция частоты встречаемости мутации гена PIK3CA cо стадией опухолевого процесса и степенью злокачественности [45]. Увеличение частоты соматических мутаций PIK3CA+ было ассоциировано c:
- прогрессированием заболевания (от 2,4 до 28.7% при прогрессировании из I–IIa до III–IV стадий; p=0,0001);
- повышением степени злокачественности опухоли (отсутствие мутаций в G1 по сравнению с 20% при G3).
Появление мутации гена PIK3CA+ в канцерогенезе достоверно снижает безрецидивную выживаемость в общей группе пациентов с диагнозом РМЖ III стадии по сравнению с пациентами без мутации (p<0,05; рис. 7):
- 1-летняя выживаемость была снижена на 20%;
- 2-летняя – на 30%;
- 3-летняя – на 50%;
- 5-летняя – на 30%.
Медиана 5-летней безрецидивной выживаемости пациентов с PIK3CA wt не была достигнута, в то время как у пациентов с PIK3CA+ она составила 35,8 месяца.
Таким образом, статистически значимое накопление соматических мутаций в каталитическом домене PIK3CA наблюдается при прогрессировании различных типов РМЖ и ассоциировано с повышенным риском развития метастатического заболевания [45].
Прогностическое и/или предиктивное значение мутации гена PIK3CA
Полученные результаты согласуются с мета-анализом 2018 г., целью которого было определить клинический прогноз больных распространенным HR+-HER2-РМЖ в популяциях с мутациями/без мутаций гена PIK3CA [46]. На основании результатов мета-анализа было заключено, что мутации гена PIK3CA, по-видимому, имеют прогностическое и предиктивное значения для исходов терапии HR+- HER2- распространенного РМЖ.
С целью оценки клинического прогноза был проведен сравнительный анализ 558 публикаций на основании результатов 12 рандомизированных исследований [46]. Выделено 8 групп пациентов, получавших терапию комбинацией ингибитора PI3K с эндокринотерапией (фулвестрантом – 5 групп; летрозолом – 2 группы; тамоксифеном – 1 группа).
Из 12 исследований 6 групп пациентов получали стандартные режимы эндокринотерапии (фулвестрант – 4 группы; летрозол – 1 группа; экземестан – 1 группа); 4 группы пациентов получали таргетную терапию неингибиторами PI3K (ингибиторы mTOR – 2 группы; ингибиторы CDK4/6: рибоциклиб – 1 группа; палбоциклиб – 1 группа).
Из 10 групп пациентов без терапии ингибиторами PI3K в 9 наблюдалось статистически значимое снижение медианы ВБП у больных с мутацией гена PIK3CA по сравнению с пациентами без мутации (PIK3CA wt; таргетная терапия неингибиторами PI3K, 4/4; стандартная эндокринотерапия 5/6).
Все 4 группы, получавшие ингибиторы PI3K, показали значимое увеличение медианы ВБП у больных PIK3CA+ по сравнению с PIK3CA wt пациентами.
Таким образом, пациенты с PIK3CA+-зависимыми опухолями, получавшие терапию, не содержавшую ингибиторы PI3K, характеризовались более низкими показателями медианы ВБП по сравнению с пациентами PIK3CA дикого типа. И наоборот, больные с мутациями гена PIK3CA, получившие таргетную терапию ингибиторами PI3K, достигли более высоких показателей эффективности лечения, чем пациенты без мутации [46].
В мета-анализе 2018 г. c участием 4392 пациентов из 20 клинических исследований доказано, что больные HER2+-РМЖ ранних стадий с мутацией гена PIK3CA достигали достоверно меньше полных патоморфологических ответов опухоли на проведение неоадъювантной молекулярно-направленной анти-HER2-терапии по сравнению с пациентами без мутации (рис. 8А) [47].
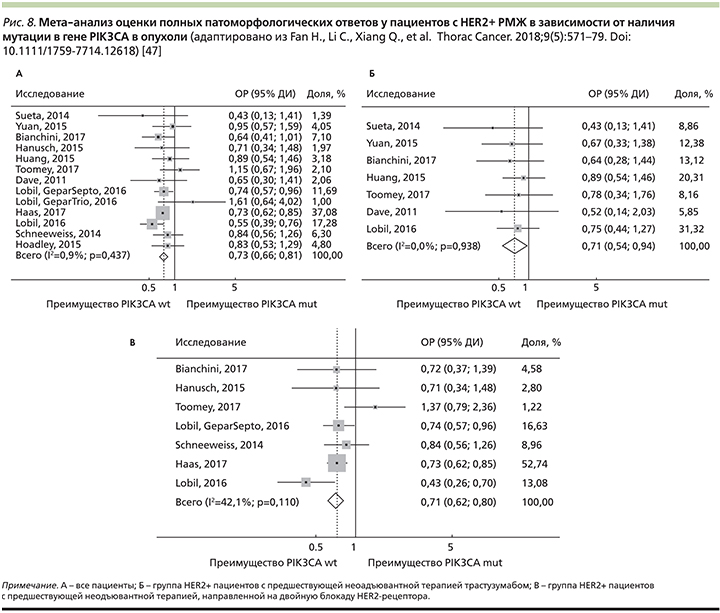
При подгрупповом анализе была выявлена корреляция между ответом на таргетную анти-HER2-терапию трастузумабом или лапатинибом и наличием мутации PIK3CA+.
Больные диким типом PIK3CA wt достигали более высоких статистически значимых ответов на лечение при использовании трастузумаба по сравнению с PIK3CA+-пациентами (ОР – 0,71; 95% ДИ – 0,54–0,94; рис. 8Б).
В то же время при применении лапатиниба в неоадъювантном режиме достоверных различий в ответе вне зависимости от мутации PIK3CA выявлено не было (ОР=0,76; 95% ДИ – 0,42–1,37).
Достоверные различия в оценке полных патоморфологических ответов опухоли в зависимости от наличия мутации в гене PIK3CA наблюдались и при HER2+/HR+ подтипе РМЖ (ОР=0,50; 95% ДИ – 0,27–0,93), а также при применении двойной блокады HER2-рецептора (ОР=0,71; 95% ДИ – 0,62–0,80; рис. 8В) [47].
Данные самого крупного ретроспективного мета-анализа, представленный на конференции в Сан-Антонио (SABCS, San Antonio Breast Cancer Symposium), с участием 27 895 больных РМЖ подтвердили, что достижение полного патоморфологического ответа опухоли после проведения неоадъювантной химиотерапии является суррогатным маркером увеличения безрецидивной и общей выживаемости. Отмечено снижение риска рецидива на 70% и увеличение выживаемости на 80% при всех основных подтипах РМЖ (ОР=0,31), особенно при трижды негативном РМЖ (ОР=0,18) и HER2-позитивном РМЖ (ОР=0,32). При гормонозависимом подтипе РМЖ различия между группами были близки к достижению статистической значимости (ОР=0,15). Патоморфологический ответ после проведения неоадъювантной терапии также был связан со снижением смертности (ОР=0,22) для каждого из трех подтипов РМЖ [48]. Возможность же выявления мутации гена PIK3CA у больных РМЖ ранних стадий на этапе планирования неоадъювантой лекарственной терапии позволит не только выделить группу больных неблагоприятного прогноза, но и интенсифицировать лечение в будущем за счет назначения биологически направленной таргетной анти-PIK3-терапии.
Заключение
- Мутация гена PIK3CA – важнейший прогностический и предиктивный маркер у больных РМЖ независимо от стадии и биологического подтипа.
- Определение мутации гена PIK3CA у больных РМЖ должно войти в рутинную клиническую практику наряду с оценкой уровня экспресии рецепторов эстрогенов, прогестерона и рецептора эпидермального фактора роста человека 2-го типа (HER2).
- Выполнение повторной биопсии пациентам с метастазами злокачественных новообразований становится «золотым» стандартом на этапе выбора оптимальной тактики лечения больного. Так, появление мутации гена PIK3CA+ в канцерогенезе служит фактором неблагоприятного прогноза в отношении показателей выживаемости у больных РМЖ по сравнению с пациентами без мутации.
- Отмечена конкордантность тканевой и жидкостной биопсий для определения мутации в гене PIK3CA. Доказана клиническая обоснованность определения мутации в гене PIK3CA по циркулирующей опухолевой ДНК плазмы крови и сопоставимость результатов последней с тканевой биопсией.
- За последние 20 лет предпринято множество попыток создания эффективного и безопасного ингибитора PI3K. Однако комплексная и мультифункциональная роль PI3K в процессах жизнедеятельности клетки стала причиной многократных попыток и неудач. В эпоху внедрения знаний молекулярной биологии в рутинную клиническую практику определение мутации гена PIK3CA+ позволяет выделить особую группу больных (PIK3CA+ HR+ HER2- РМЖ), получающих наибольшую пользу от молекулярно-направленной анти-PI3K-терапии.


